Náplň podkapitoly:
1. Chemické složení nervové tkáně
2. Energetický metabolismus CNS
_
Chemické složení nervové tkáně
Nervová tkáň je charakteristická svým vysokým obsahem lipidů a proteinů. Sacharidy se v ní nevyskytují ve velkém množství. Z lipidů převažují složené lipidy (např. glycerolfosfolipidy a sfingofosfolipidy) a neesterifikovaný cholesterol. CNS je schopná syntézy vůbec nejdelších mastných kyselin v lidském organismu, typická je pro ni přítomnost MK s dlouhým řetězcem (často ve formě hydroxykyselin). Triacylglyceroly v nervové tkáni naopak chybí.
Proteiny mají nezastupitelnou úlohu jako kanály, přenašeče, receptory a neurotransmitery. Nevýznamnější přenašeč membrány neuronů, Na+/K+–ATPáza, zodpovídá za stálé udržování klidového membránového potenciálu, a to i na úkor vysoké spotřeby energie (u neuronů je její činnost zodpovědná až za 70 % celkové energetické spotřeby, ostatní buňky organismu si přitom vystačí s přibližně 30 %).
Myelinová pochva, vynikající izolátor, se skládá z lipidů (glykolipidy, sfingomyelin atd.) a proteinů (např. myelinový bazický protein).
_
Energetický metabolismus CNS
I když mozek tvoří jen 2 % tělesné hmotnosti, jsou jeho metabolické nároky velmi vysoké. Podílí se až 20 % na celkové spotřebě kyslíku a 25 % na celkové spotřebě glukózy. Největší podíl této spotřeby se využije na průběžné udržování membránového potenciálu prostřednictvím Na+/K+-ATPázy a na další děje související s přesunem iontů přes membránu.
Současně je mozek orgánem nejvíce citlivým na deficit kyslíku i glukózy. Po zástavě přívodu kyslíku dochází po pár desítkách sekund k bezvědomí a po přibližně pěti minutách k ireverzibilnímu poškození neuronů. Jak rychle se odumírání dostaví, závisí na více faktorech. Jedním z nich je například teplota. Při hypotermii se totiž metabolismus tkání zpomaluje, klesají nároky na dodávku kyslíku a živin, a buňky tak i při jejich nedostatku přežijí déle.
Hodnota respiračního kvocientu (RQ, vypočítaný jako podíl vyprodukovaného CO2a spotřebovaného O2 – RQ = VCO2 / VO2) mozku se velmi blíží 1. To znamená, že metabolismus mozku využívá téměř výhradně sacharidové zdroje, konkrétně glukózu. Denní spotřeba činí asi 120 g.
Co se týká jiných energetických zdrojů, mozek (na rozdíl od většiny periferních tkání) nevyužívá mastné kyseliny, protože jsou v krvi transportovány ve vazbě na albumin, a tak je pro ně hematoencefalická bariéra nepropustná. Mozek se ale při dlouhotrvajícím hladovění umí metabolicky adaptovat na spotřebu ketolátek. Plná adaptace vzniká asi po třech týdnech hladovění a poté může oxidace ketolátek krýt až 50 % energetické spotřeby.
Úloha astrocytů
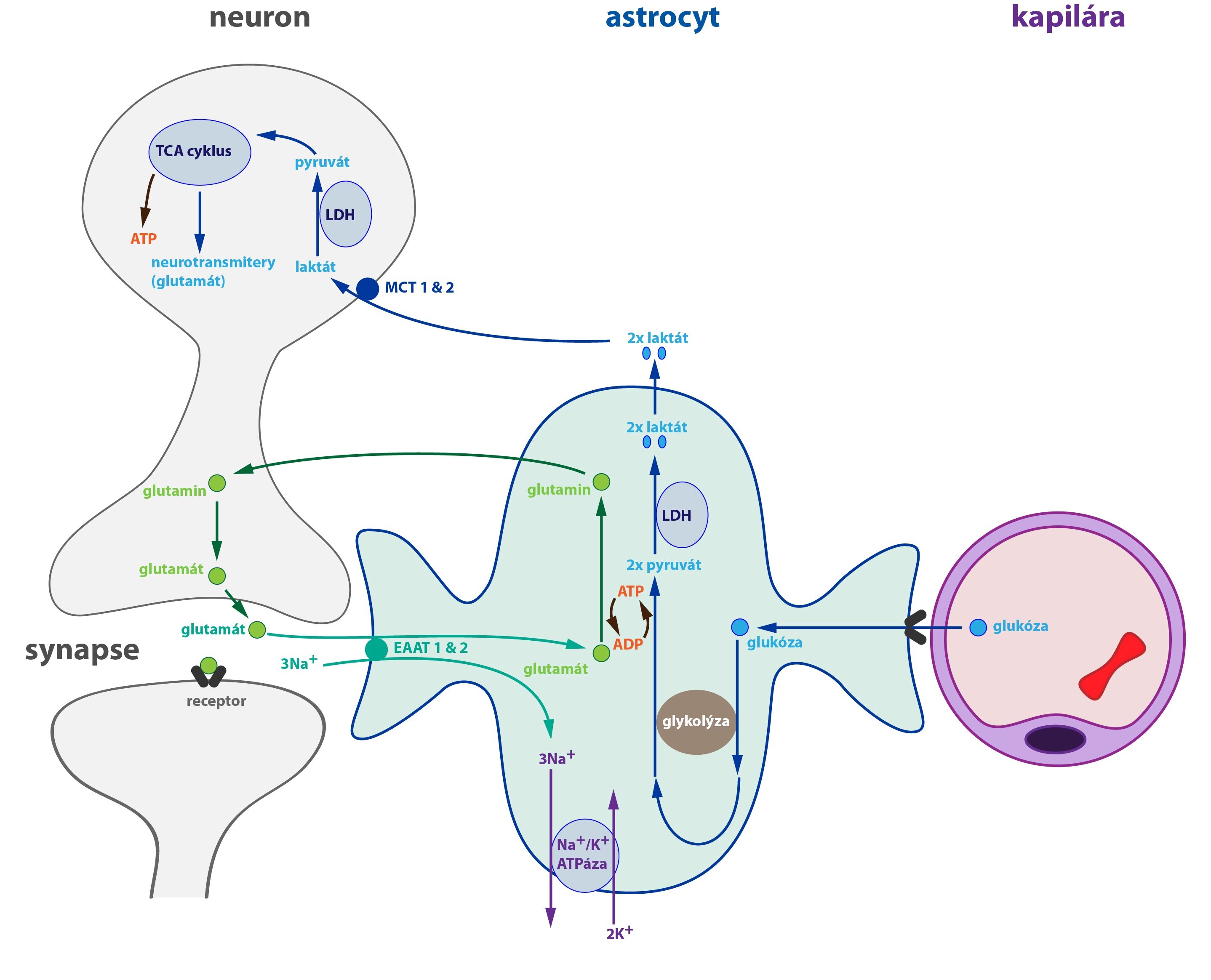
Hlavním substrátem metabolismu mozku je sice glukóza, ale tu přijímají především astrocyty. Samotné neurony využívají ve svém metabolismu jiné substráty, především laktát a pyruvát. Ty jsou uvolňovány do extracelulárního prostoru právě astrocyty a neurony je odtud následně vychytávají. Produkce laktátu v astrocytu souvisí s aktivitou neuronu.
Kromě metabolismu glukózy má astrocyt důležitou úlohu i v recyklaci glutamátu (nejdůležitější excitační neurotransmiter CNS). Ze synaptické štěrbiny je glutamát do astrocytu přenášen symportem se sodnými kationty (přenašeče EAAT 1 a 2). Zvýšená koncentrace Na+ v astrocytu poté aktivuje Na+/K+-ATPázu, která tak obnovuje elektrochemický gradient nutný pro transport. V astrocytu se glutamát přemění na glutamin a ten se vrací do neuronu k dalšímu použití. Oba popsané procesy vyžadují ATP.
Interakce mezi astrocytem a neuronem tedy funguje takto: při vysoké aktivitě, která vyžaduje přísun laktátu, secernuje neuron do synaptické štěrbiny hodně glutamátu. Zvýšený transport glutamátu do astrocytu způsobí zvýšenou aktivitu Na+/K+-ATPázy a zvýšenou konverzi glutamátu na glutamin. Tím se zvyšuje spotřeba ATP a jeho množství v astrocytu klesá. Toto stimuluje glykolýzu, což vede k vyššímu přísunu glukózy z krve a k tvorbě ATP. Zároveň vzniká i více laktátu, jejž mohou neurony využívat.
Astrocyty obsahují pouze malé množství glykogenu, který prodělává velmi intenzivní metabolismus (degradace a resyntéza). Z toho vyplývá závislost CNS na dodávce sacharidů přes oběhový systém. Glykogen slouží jako krátkodobá zásoba energie (než se podaří zvýšit přísun glukózy).
Klinická korelace:
PET (positron emission tomography) je diagnostická zobrazovací metoda, která umožňuje sledovat přítomnost a distribuci radiofarmaka v těle. Využívá přitom radionuklidy vyzařující pozitrony, jež téměř ihned anihilují s elektrony za vzniku páru fotonů záření gama. Ty jsou vyzářeny v opačných směrech a detekovány detektorem.
Při vyšetření mozku se jako radionuklid využívá derivát glukózy – FDG (18F-2-deoxy-2-fluoroglukóza), která je vychytávána astrocyty, ale po své fosforylaci se již dále nemetabolizuje. Její množství ve tkáni odráží metabolickou aktivitu (astrocyty vychytávají při vyšší aktivitě více glukózy → i více FDG), a PET tedy umožňuje zobrazit funkčně aktivní oblasti mozku.
Metabolismus amoniaku v CNS
Amoniak má schopnost volného prostupu přes hematoencefalickou bariéru. Pokud je jeho koncentrace v krvi zvýšená (horní hranicí je přibližně koncentrace 50 μmol/l), významně interferuje s metabolismem mozku. Inkorporací do α-ketoglutarátu a glutamátu způsobuje zastavení Krebsova cyklu, depleci ATP a kumulaci glutaminu a glutamátu v astrocytech. Dochází tak ke kolapsu metabolismu astrocytů a neuronů.
Nadbytek glutamátu také vede k poruše jeho transportu ze synaptické štěrbiny a k tzv. excitotoxickému poškození neuronů s poruchou neurotransmise. Nadbytek glutamátu, kterého se astrocyt nemůže zbavit, způsobuje poruchu osmotických poměrů a zvýšený influx vody. Vzniká edém mozku (zpočátku intracelulární, později i extracelulární).
Příčinou hyperamonemie může být například insuficientní syntéza močoviny při poruše jaterních funkcí. Zejména rychlé (tzv. fulminantní) selhání jater, například při otravě paracetamolem, směřuje k souboru příznaků z toxického působení amoniaku na mozek, jež nazýváme jaterní encefalopatie (příznaky zahrnují zmatenost, dezorientaci, neklid, bezvědomí až hluboké koma). Ta podle míry rozsahu dosahuje stupně I-IV.
Autoři podkapitoly: Josef Fontana a Petra Lavríková