Náplň podkapitoly:
1. Úvod do synaptického přenosu
2. Struktura synapse a procesy na synapsi
_
Úvod do synaptického přenosu
Tkáň mozku byla dlouhou dobu považována za syncytium. Staří histologové měli za to, že cytoplazma jednotlivých buněk je spojená a mozek tak tvoří mnohobuněčný útvar připomínající houbu.
Toto přesvědčení vyvrátil až Santiago Ramón y Cajal, který řezy mozkem stříbřil a zjistil, že je tvořen diskrétními buňkami – neurony, které jsou od sebe odděleny úzkými vysoce specializovanými štěrbinami, synapsemi.
Typy synapsí
Existují dva typy synapsí – chemické a elektrické.
Chemické synapse
Téměř všechny synapse v CNS člověka jsou chemickými. Jejich charakteristickou funkcí je to, že první neuron na zakončení svého axonu sekretuje chemický působek zvaný neurotransmiter a ten je registrován příslušným receptorem na dendritu, těle nebo dokonce axonu druhého neuronu, kde vyvolá specifické změny (v závislosti na typu svého receptoru).
Jednou z nejdůležitějších vlastností chemické synapse je tzv. jednosměrný převod. Neuron, který sekretuje neurotransmiter, nazýváme presynaptický a jeho axon končí na dalším neuronu s příslušnými receptory na své membráně – neuronu postsynaptickém. Přestože akční potenciál může vzniknout na kterékoliv části membrány neuronu a následně se šíří oběma směry, v jednom směru vyhasne na dendritech, neboť zde není přítomen molekulárně biologický aparát pro exocytózu vezikul s neurotransmiterem. Přepojení nervového impulsu (akčního potenciálu) na další neuron nastává pouze v jednom směru a to na zakončení axonu. Můžeme tedy říci, že nervový impuls se vždy šíří z presynaptického neuronu na neuron postsynaptický.
Tento princip je velmi významný neboť umožňuje nervové soustavě vést signál pouze ke specifickým oblastem. Impulsy tak mohou být velmi účinné a specializované.
Elektrické synapse
Elektrické synapse jsou v CNS o mnoho vzácnější. Fungují tak, že cytoplazma jednotlivých neuronů je propojena prostřednictvím gap junctions (nexon), které přímo umožňují přestup iontů a tím i elektrických změn na membráně jednoho neuronů na druhý. Toto propojení hraje kruciální roli zejména v srdci, kde gap junctions nacházíme ve velké denzitě na interkalárních discích kardiomyocytů. Zde umožňují synchronní kontrakci srdečního svalu.
Tento typ synapse je funkční oběma směry, neboť se v podstatě jedná pouze o kanál, kterým přecházejí ionty.
_
Struktura synapse a procesy na synapsi
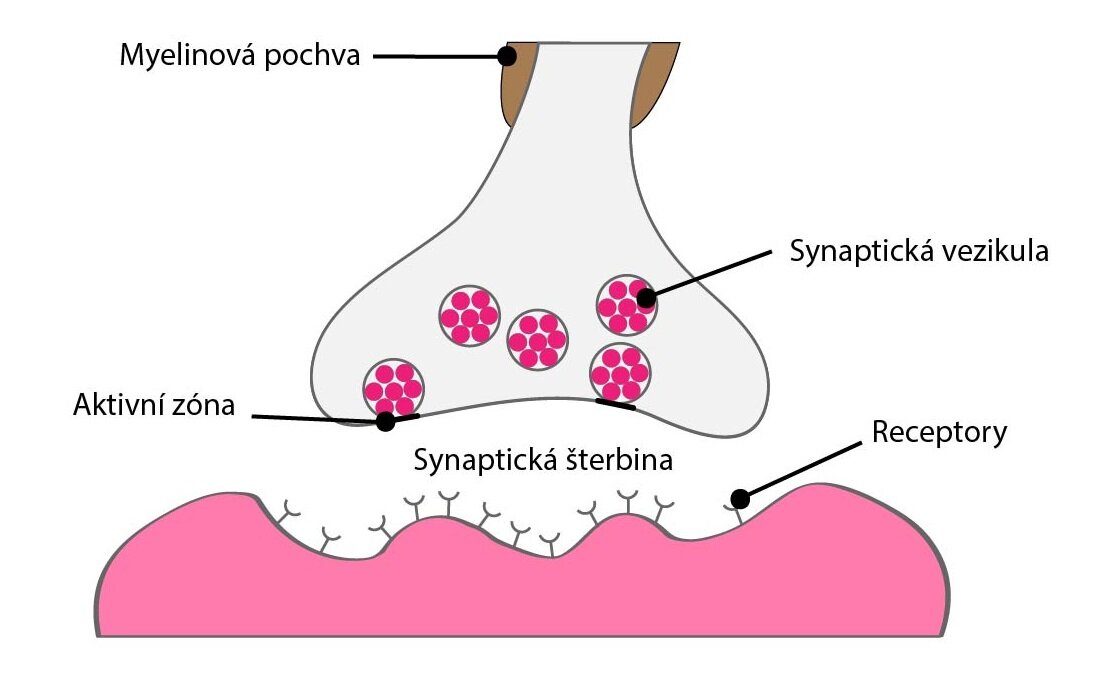
Presynaptický terminál
Na těle a dendritech každého neuronu se nachází až 200 000 zakončení presynaptického neuronu. Z toho až 95 % na dendritech postsynaptického neuronu. Tato zakončení se nazývají presynaptické terminály. Jedná se o terminální části axonů neuronů, které leží v různých částech CNS.
Terminál má tvar malého oválného uzlíku, proto je někdy nazýván bouton terminaux. Mezi presynaptickým terminálem a dendritem (nebo tělem) postsynaptického neuronu je drobný prostor nazývaný synaptická štěrbina široká asi 20 nm. Tato štěrbina není zcela prázdná, ale nachází se v ní kromě intersticiální tekutiny řídce propletená síť nejrůznějších proteinů, kde mnohé vykazují enzymatickou aktivitu.
Presynaptický terminál obsahuje dvě velmi významné struktury: synaptická vezikula v aktivní zóně a velké množství mitochondrií.
Aktivní zóna je modifikovaná část membrány, která sousedí se synaptickou štěrbinou. Obsahuje molekulárně biologický aparát pro vylití synaptických vezikul a už v inaktivním stavu váže několik váčků, které jsou připraveny k okamžité exocytóze.
Synaptická vezikula obsahují kvantum neurotransmiteru. Kvantum je minimální množství, které může presynaptický terminál uvolnit. Počet uvolněných kvant závisí na frekvenci a počtu akčních potenciálů, které dorazí k zakončení axonu.
Mitochondrie vytvářejí ATP, které je nutné pro syntézu neurotransmiterů.
Mechanismus uvolňování kvant neurotransmiteru
Membrána presynaptického terminálů obsahuje ve velké denzitě napěťově řízené kalciové kanály. Jakmile akční potenciál depolarizuje membránu, otevřou se kalciové kanály a vápenaté kationty začnou po svém koncentračním gradientu difundovat do cytoplazmy terminálu. Počet vylitých synaptických vezikul (kvant) je přímo úměrný počtu otevřených kalciových kanálů. Vápenaté ionty se váží na proteiny aktivní zóny. Tyto speciální proteiny se řadí do nadrodiny SNARE a existuje jich celá řada. Nacházíme je v membráně aktivní zóny i v membráně synaptických vezikul. Po navázání iontů kalcia mění svou konformaci a SNARE proteiny vezikula a aktivní zóny se začnou proplétat. Tisknou tak k sobě membránu váčku a membránu presynaptického terminálu, až nakonec dojde k jejich splynutí a kvantum transmiteru se uvolní do synaptické štěrbiny. Tento mechanismus se nazývá zipová teorie.
Na presynaptické membráně se navíc nacházejí receptory pro vlastní uvolňovaný neurotransmiter, zvané autoreceptory. Tyto proteiny zastávají regulační úlohu a monitorují koncentraci neurotransmiteru v synaptické štěrbině.
Kromě monitorace vlastního neurotransmiteru je presynaptický terminál ovlivňován i chemickými působky z jiných neuronů, může jít o paracelulární signály nebo neurotransmitery sekretované jinými neurony do okolí štěrbiny. Tyto signály aktivují tzv. heteroreceptory, které také mění aktivitu presynaptického terminálu.
Aby mohl být receptorový protein považován za heteroreceptor, musí ovlivňovat metabolismus jiné látky než svého vlastního ligandu.
Postsynaptický terminál
Postsynaptickým terminálem je myšlena ta část postsynaptického neuronu, která sousedí s terminálem presynaptickým a vystavuje na svém povrchu ve velké hustotě specifické receptory. Na terminálu popisujeme dvě funkčně významné struktury: postsynaptickou denzitu a receptorové proteiny.
Postsynaptická denzita
Postsynaptická denzita je komponenta intimně naléhající na membránu terminálu z cytoplazmatického povrchu. Jedná se o hustou síť vláknitých proteinů s řadou funkcí:
1) Udržuje receptorové proteiny v příslušné pozici
Aby byla zachována vysoká hustota receptorů na relativně malém úseku membrány, je nutné “zakotvit” jejich molekuly v membráně. Vzhledem k tomu, že membrána má fluidní charakter a receptorové proteiny jsou v ní volně zanořeny, bez “kotvení” by se spontánně přemístily na jiné místo a nebylo by možné udržet jejich vysokou denzitu.
2) Reguluje počet vystavených receptorů
Může receptorové proteiny z membrány stahovat buď z důvodu opotřebení nebo přebytečnosti (internalizace receptoru). Popřípadě může vystavit na membráně nové receptorové proteiny, které jsou v mnoha případech již připraveny ve vezikulech vázaných v postsynaptické denzitě.
3) Mění morfologii synapse
V některých případech může postsynaptická denzita měnit i vzhled synapse. Při časté a dlouhodobé stimulaci se v některých částech CNS tvoří tzv. dendritické trny. Ty mění celou řadu vlastností synapse a má se za to, že se mimo jiné podílejí na uchování paměťových stop. Tyto útvary jsou schopny se přeskupovat z minuty na minutu, zanikat a znovu vznikat. Někteří autoři poeticky popisují, že dendritické trny tančí. Jedná se o velmi složitý proces, který ale poukazuje na to, že CNS je velmi dynamický systém schopný rychlých změn. A jsou to mimo jiné právě vlastnosti postsynaptické denzity, které mohou za formovaní nových propojení mezi neurony a za zánik propojení starých neužitečných.
Receptory
Receptory jsou proteiny zavzaté do cytoplazmatické membrány, které nesou vazebná místa pro neurotransmitery. Navázáním transmiteru je receptor aktivován a signál z aktivovaného receptorového proteinu je přepojen. Toto přepojení je obecně trojí:
1) Spřažení s iontovým kanálem
2) Spřažení s G-proteinem
3) Spřažení s enzymem
1) Spřažení s iontovým kanálem
Pokud je receptor spřažen s iontovým kanálem je obvykle jeho aktivací docíleno změny membránového potenciálu cílové buňky. Otevřený kanál umožňuje migraci náboje napříč membránou. Tato změna je okamžitá a vede k aktivaci dalších kanálů, které jsou otevírány napětím (tzv. voltage-gated). Aktivita kanálů – jak těch spřažených s receptory, tak těch otevřených následně změnou potenciálu – mění permeabilitu membrány a především se mění iontové složení v jejím nejbližším okolí. Charakter této změny závisí na tom, zda je aktivovaný kanál prostupný pro kationty nebo anionty.
Kationtové kanály jsou v závislosti na svém průměru a dalších vlastnostech propustné pro sodík, draslík a nebo vápník. Jejich ústí je záporně nabité, což přitahuje kladně nabité ionty a odpuzuje anionty.
Aniontové kanály umožňují prostupovat zejména chloridům. Hydratované ionty sodíku, draslíku a vápníku jsou příliš velké, než aby prošly ústím, a proto většina chloridových kanálů nemusí být kladně nabitá.
2) Spřažení s G-proteinem
Některé funkce CNS, jako například učení a paměť, vyžadují dlouhodobé změny, které přetrvají i po zániku neurotransmiter-receptorového komplexu. Aktivace iontových kanálů trvá velmi krátkou dobu a po deaktivaci kanálu mizí jeho účinky v řádu jednotek milisekund. Přepojení signálu na druhé posly, ať už se jedná o G-protein nebo o intracelulární enzym vyvolají změny, které mohou přetrvat až měsíce.
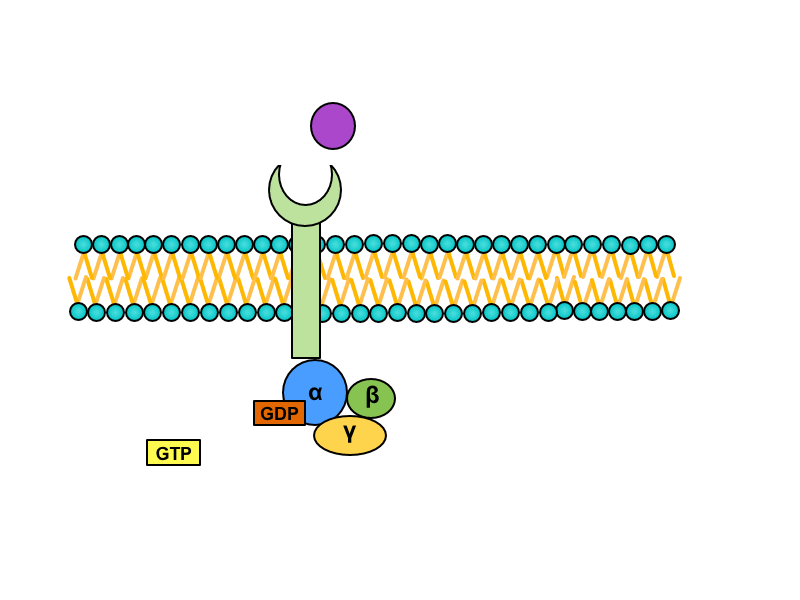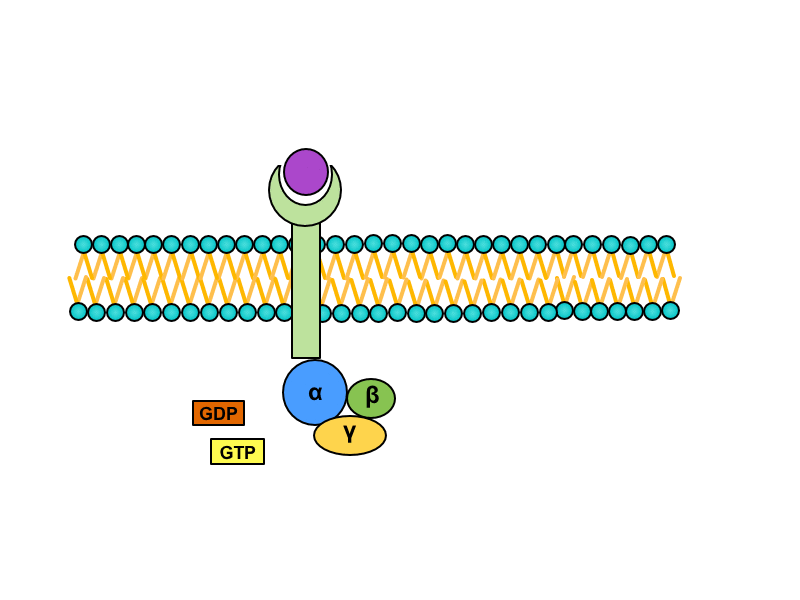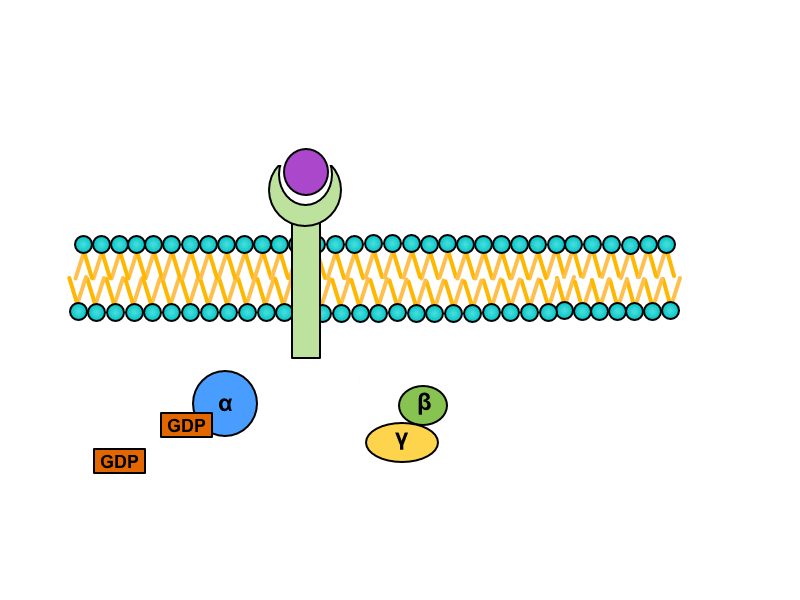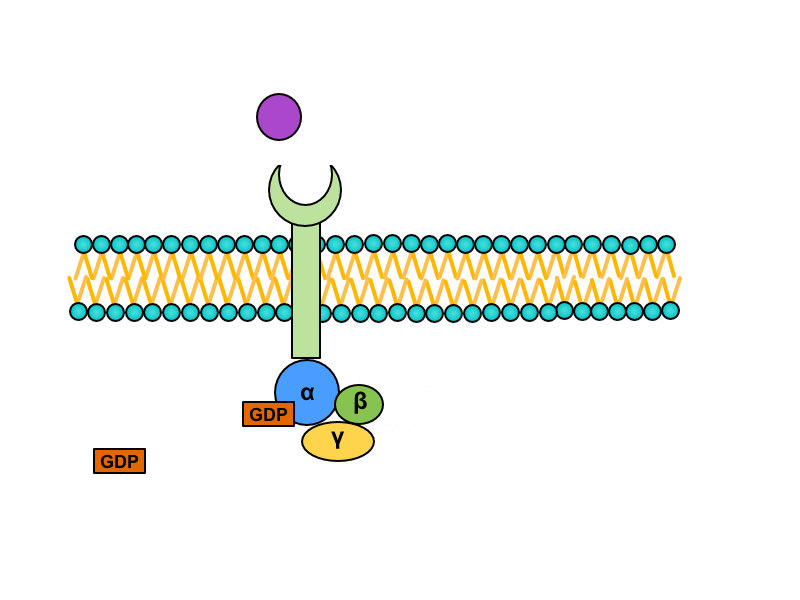
Serpentinové receptory, jejichž transmembránová doména prochází sedmkrát membránou, jsou spřaženy s tzv. G-proteinem. Jedná se o heterotrimerní GTP – vázající protein, který je v inaktivním stavu asociován s receptorem a složen z podjednotek alfa, beta a gama. Na jednotce alfa je vázáno GDP. Při aktivaci serpentinového receptoru dochází ke konformační změně G-proteinu, z jednotky alfa je uvolněno GDP a jeho místo zaujme GTP. Tato změna vede k disociaci heterotrimeru. Výsledkem této disociace je monomer alfa a heterodimer beta-gama. Oba produkty difundují podél membrány a spojují se s enzymy, které pro ně nesou vazebná místa.
Výsledným efektem může být celá řada jevů od aktivace enzymů, které modifikují postsynaptickou denzitu, až ke změně exprese genů, díky které neuron dlouhodobě moduluje svou enzymatickou výbavu nebo strukturu.
Dnes rozeznáváme tři významné typy G-proteinů:
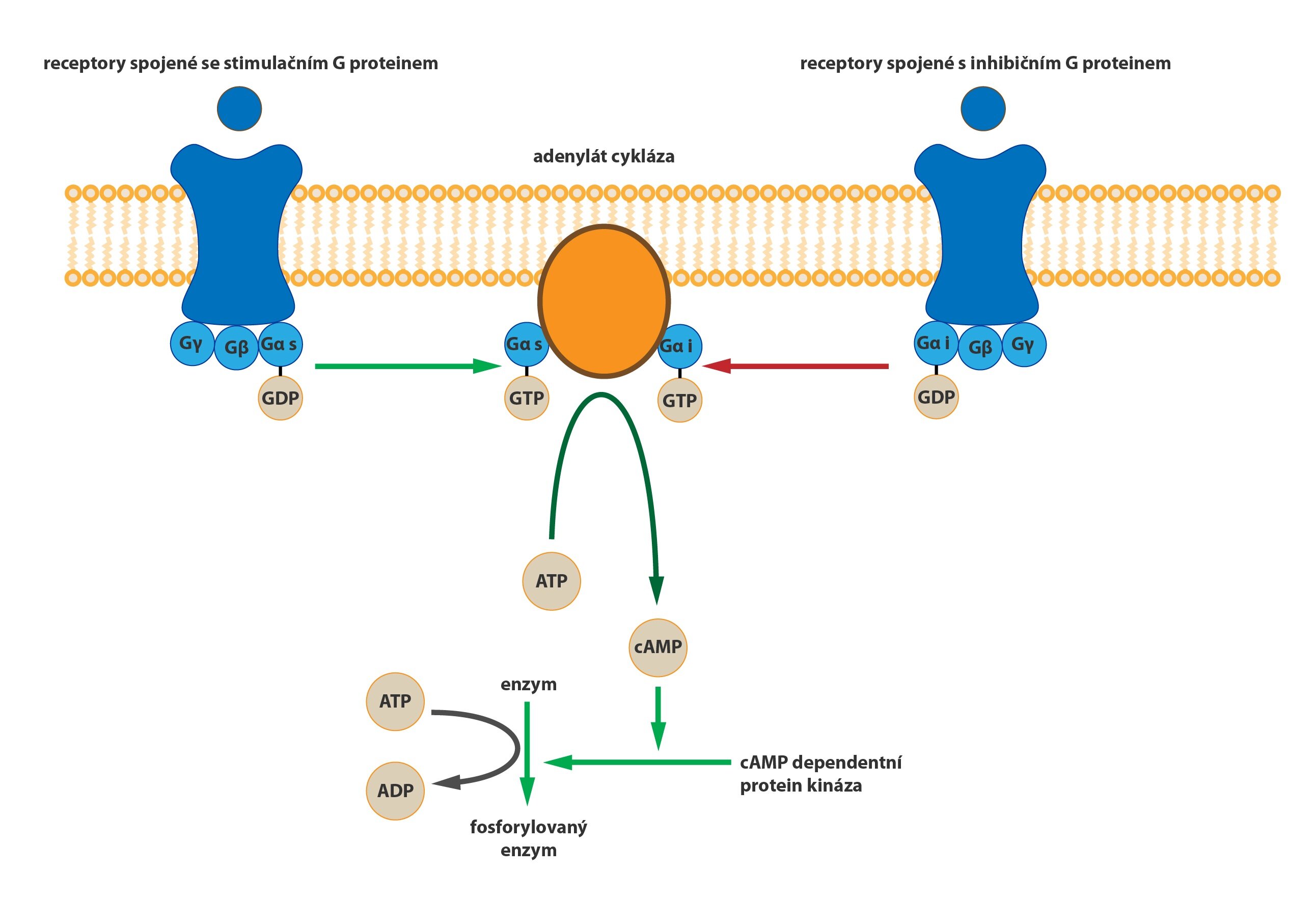
a) Gs-protein
Aktivuje adenylátcyklázu, čímž dojde k nárůstu koncentrace cAMP. Tento jev mění aktivitu cAMP-dependentních protein kináz a spouští tak různé signalizační kaskády v závislosti na expresi daného neuronu.
b) Gi-protein
Inaktivuje adenylátcyklázu, což vede k postupnému snížení koncentrace cAMP v cílové buňce.
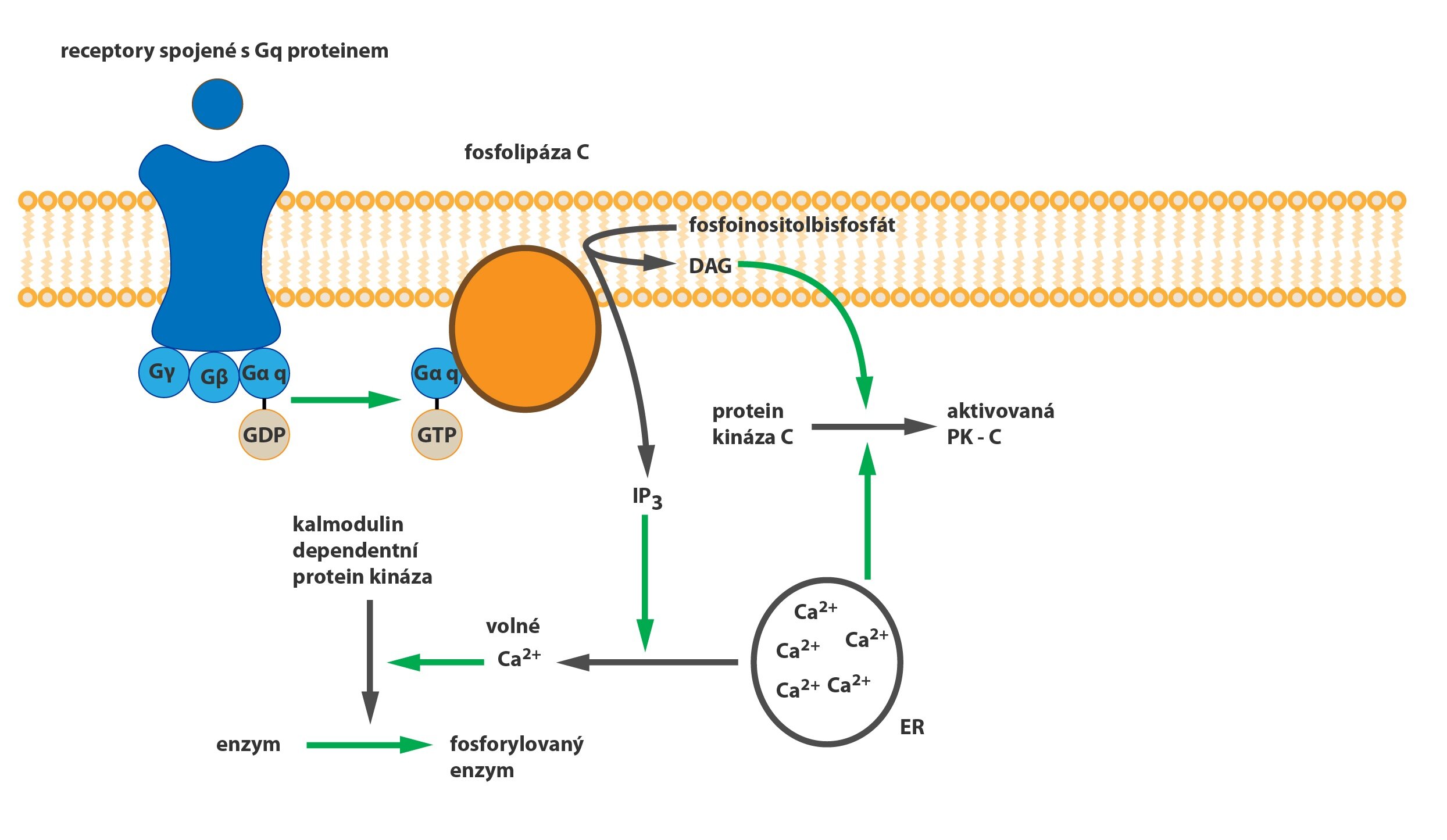
c) Gq-protein
Působí na fosfolipázu C (PLC). Ta pak přeměňuje fosfatidylinositolbisfosfát (PIP2) přítomný v cytoplazmatické membráně na inositoltrifosfát (IP3) a diacylglycerol (DAG). IP3 uvolňuje zásoby vápenatých iontů z endoplazmatického retikula (a částečně z mitochondrií), které pak spouští kalcium-kalmodulinovou kaskádu (aktivace kalmodulin-dependentních proteinkináz). DAG v cytoplazmě spolu s kalciem aktivuje proteinkinázu C (PKC).
Inaktivace G-proteinu
Podjednotka alfa vykazuje GTPázovou aktivitu, takže po určitém čase rozštěpí navázané GTP na GDP a anorganický fosfát. Tato změna vede k reasociaci podjednotek alfa a beta-gama do původního trimeru spřaženého s receptorem.
3) Spřažení s enzymem
Vykazuje ve výsledku velkou podobnost se spřažením s G-proteinem. Rozdíl je v iniciální aktivaci intracelulárních kaskád a samozřejmě i v tom, jaké dráhy jsou na receptor napojeny.
Receptorové proteiny jsou spřaženy s enzymem, buď ve formě asociované molekuly enzymu, která je aktivována spolu s receptorem, nebo vykazují vlastní enzymatickou aktivitu.
Excitační a inhibiční působení receptorů
Aby CNS mohl reagovat na změny prostředí, je nutné, aby mohl přísně regulovat aktivitu odpovídajících systémů. A to jak ve smyslu zvýšení aktivity (excitace), tak naopak jejího snížení (inhibice).
Excitace
Na membráně probíhají tyto molekulární pochody vedoucí k excitaci:
1) Otevření sodíkových kanálů
Otevření sodíkových kanálů umožní migraci velkého množství kladného náboje do nitra postsynaptického neuronu. Tento náboj vyvolá změnu membránového potenciálu a je-li dostatečná k překročení prahu, tak spustí akční potenciál. Je však dobré upozornit, že pro překročení prahu je potřeba aktivace mnoha postsynaptických terminálů najednou (prostorová sumace) nebo mnohočetná aktivace jednoho terminálu s drobným časovým odstupem (časová sumace). Aktivace sodíkových kanálů je nejčastěji užívaný mechanismus excitace v CNS.
2) Uzavření draslíkových kanálů
Zábrana exfluxu kladně nabitých K+, vede k hromadění kladného náboje v cytoplazmě postsynaptického neuronu. Membránový potenciál se stává pozitivnější a blíží se prahu.
3) Uzavření chloridových kanálů
Brání influxu záporného náboje (chloridových iontů) do cytoplazmy neuronu a vede ke stejné změně, jako retence draslíku. Opět dochází k postupnému nárůstu membránového potenciálu, což je excitační děj.
4) Změny v postsynaptické denzitě
Mohou být vyvolány buď aktivací některých enzymů nebo změnou genové exprese. Za excitační jsou považovány ty změny v postsynaptické denzitě, které zvýší počet excitačních receptorů či sníží počet receptorů s inhibičními účinky.
Inhibice
Má následující membránové a molekulární podklady:
1) Otevření chloridových kanálů
Otevření chloridových kanálů vede k rychlé difúzi negativního náboje do cytoplazmy postsynaptického neuronu. Influx záporně nabitých chloridových iontů vede k poklesu membránového potenciálu a tím vzdálení jeho hodnoty od hodnoty prahu.
2) Otevření draselných kanálů
Zvýšení permeability membrány pro draslík umožňuje exflux kladného náboje z nitra neuronu ven. Tím dojde ke “zvýšení negativity” membránového potenciálu.
3) Změny v postsynaptické denzitě
Jsou vyvolány aktivací jiných enzymů než v případě excitačních modifikací. V případě inhibičních změn v postsynaptické denzitě dochází ke zvýšení počtu inhibičních receptorů nebo k internalizaci excitačních receptorů.
Uniformní distribuce elektrických změn
Vzhledem k tomu, že perikaryon neuronu má relativně velký průměr a je naplněn elektrolytickým roztokem (intracelulární tekutinou), představuje pro vedení proudu pouze minimalní odpor. Proto jakákoliv změna potenciálu na části membrány těla neuronu se projeví na celém perikaryu. Tento princip je velmi významný při sumaci změn potenciálů a velmi se tak liší od vedení v dendritech, jak uvidíme dále.
Excitační postsynaptické potenciály (EPSPs)
Pokud dojde k aktivaci excitačních receptorů na postsynaptickém terminálu, nastane změna membránového potenciálu, která je jen velmi vzácně dostatečně velká na to, aby vyvolala akční potenciál. Obvykle je tato změna jen částečná např. z -65 mV na -60 mV, jinými slovy přebytečný kladný náboj z excitačních jevů neutralizuje část negativity membránového potenciálu. Tuto pozitivní změnu nazýváme excitační postsynaptický potenciál – EPSP. V našem případě byla hodnota EPSP +5 mV. Ve chvíli, kdy EPSPs změní membránový potenciál neuronu dostatečně na to, aby přesáhl práh, je spuštěn akční potenciál. Jeho začátek však není v místě, kde poprvé membránový potenciál dosáhl požadované hodnoty, ale v iniciálním segmentu axonu.
Jelikož je tělo neuronu vynikající vodič, změny v potenciálu se projeví po celém perikaryu (viz výše) a je to právě iniciální segment, jehož membrána je modifikovaná tak, aby snadno generovala akční potenciál. Obsahuje totiž několikanásobně více sodíkových kanálů než zbytek membrány. Díky této vlastnosti je iniciální segment schopen generovat akční potenciál, pokud EPSPs vyvolají změnu mezi +10 až +20 mV. Jakmile je akční potenciál vyvolán, cestuje od iniciálního segmentu oběma směry. Jak k zakončení axonu, kde spustí vylití kvant transmiteru, tak zpět do těla, kde vyhasíná na dendritech.
Mohlo by se zdát, že retrográdní směr k dendritům je zbytečný. Opak je pravdou. Akční potenciál zde působí tzv. efekt smazání tabule. Iontové změny spojené s akčním potenciálem po fázi repolarizace obnoví iontové složení podél membrány do původního stavu a připraví tak terén další interneuronální signalizaci.
Inhibiční postsynaptické potenciály (IPSPs)
Klidový membránový potenciál α-motoneuronu v míše je přibližně -65 mV. Jelikož je Nernstův potenciál pro chloridové ionty -70 mV, dojde po otevření chloridových kanálu ke snížení membránového potenciálu. Maximálně však na -70 mV, pak i při otevírání dalších chloridových kanálů membránový potenciál dál nepoklesne, neboť chloridové ionty nebudou difundovat dovnitř neuronu. Při -70 mV se ustanoví dynamická rovnováha. Tyto “přebytečně otevřené kanály” ale umožňují snadněji negovat efekt jakýchkoliv EPSPs.
Nernstův potenciál pro draslík, ale leží v negativnějších hodnotách (-86 mV). Otevření draslíkových kanálů je proto velmi snadno schopno hyperpolarizovat membránu postsynaptického terminálu. Jakákoliv změna membránového potenciálu, která změní jeho hodnotu z klidové na negativnější, se nazývá IPSP. Např. změna z -65 mV na -70 mV může být způsobena IPSP = -5 mV.
Tento typ inhibice se nazývá postsynaptická inhibice a je způsobena hyperpolarizací postsynaptického neuronu prostřednictvím IPSPs.
Presynaptická inhibice
Existuje ještě jeden typ inhibice, při kterém je měněna aktivita presynaptického neuronu ještě předtím, než je vůbec spuštěna exocytóza vezikul do synaptické štěrbiny. Tento typ spočívá ve vylití inhibičního neurotransmiteru do okolí axonu presynaptického neuronu. Tím se otevřou chloridové kanály axonu, hyperpolarizují membránu Ranvierových zářezů a inhibují propagaci akčního potenciálu k zakončení axonu.
Nejčastěji tímto způsobem účinkuje GABA v senzorických drahách, kde se jednotlivá vlákna vzájemně inhibují, aby zvýšila přesnost reprezentace stimulu, například výšku tónu u sluchu.
Prostorová sumace
Jak již bylo několikrát zmíněno, jediný EPSP nestačí, aby iniciální segment generoval akční potenciál. Normálně je ale stimulována celá řada postsynaptických terminálů na různých místech perikarya najednou a jelikož je tělo neuronu téměř ideální vodič, tak všechny EPSPs, které na membráně postsynaptického neuronu vznikly v jednom čase, můžeme prostě sečíst. Tento fenomén se nazývá prostorová sumace.
Časová sumace
Pokaždé, když na membráně postsynaptického neuronu vznikne EPSP, tak vyvolá iontové změny, které přetrvávají až 15 ms po uzavření příslušného iontového kanálu. Pokud je během tohoto intervalu stimulováno stejné místo, dojde k přičtení iontových změn. Opakované výboje jednoho presynaptického terminálu, pokud mezi výboji není interval delší než 15 ms, lze sečíst. Tento jev nazýváme časovou sumací.
Od EPSPs se pomocí stejných principů dají odečítat IPSPs. Případně lze sčítat efekt IPSPs.
Facilitace
Pokud se stane, že ani sumovaný EPSP není dostatečně vysoký k překročení prahu, začne jeho hodnota postupně klesat. Ale i přesto zůstává hodnota jeho membránového potenciálu po určitou dobu blíže hodnotě prahu než v naivním stavu. Pokud v této době dorazí k neuronu další excitační impuls, tak může vyvolat akční potenciál, přestože nemusí dosahovat prahové hodnoty. Tento jev se nazývá facilitace. Facilitovaný neuron tak může generovat akční potenciál i při podprahovém impulsu.
Dendrity
Dendrity jsou vysoce specializovanou strukturou neuronu na přijímání signálů z presynaptických terminálů. Do teď jsme popisovali různé jevy na těle neuronů. Mezi dendrity a perikaryem však existuje celá řada podstatných rozdílů.
Dendrity nemohou generovat akční potenciál, vystavují na svých membránách totiž relativně málo sodíkových kanálů. Dendrity jsou schopny pouze elektrotonického vedení – tedy prostého vedení iontovými toky – do těla neuronu. Navíc mají velmi malý průměr, a proto kladou proudu vyšší odpor. Na rozdíl od těla nejsou ideálním vodičem. Dále je jejich membrána tenká a permeabilní pro ionty. Při vedení proto dochází ke ztrátám, které jsou tím větší, čím vzdálenější je místo vzniku EPSP somatu tohoto neuronu. Např. EPSP, který v místě vzniku byl roven +5 mV může být během vedení k perikaryu zcela ztracen a nevyvolá tak žádnou účinnou změnu v iniciálním segmentu axonu. Vedení se ztrátami se nazývá vedení s dekrementem – je doménou dendritů. EPSPs vzniklé na těle neuronu jsou vedeny bez dekrementu.
Jak již bylo zmíněno, dekrement roste se vzdáleností od perikarya. Proto jsou mnohem účinnější ty synapse, které se nacházejí na odstupu dendritů. Jejich efekt (excitační či inhibiční) bude mnohem významnější.
Z uvedeného také vyplývá, že mocný excitační stimulus v terminálním větvení může být kompletně negován slabým inhibičním stimulem v místě odstupu dendritu. Tento fenomén velmi ztěžuje sumaci.
Únava synapsí
Pokud v rychlém sledu stimulujeme presynaptický terminál, je množství výbojů postsynaptického neuronu zprvu velmi vysoké, ale po několika sekundách se začne progresivně zmenšovat. Tento jev se nazývá únava synapsí. Mechanismem tohoto jevu je zejména vyčerpání zásob kvant neurotransmiteru, které stačí asi na 10 000 akčních potenciálů. Spolupodílí se i postupná inaktivace receptorů postsynaptického terminálu a vznik abnormální koncentrace iontů v cytoplazmě postsynaptického neuronu.
Význam únavy synapsí spočívá v ochraně systémů CNS před excesivní aktivitou neuronů. Nejlépe patrný je její význam při epileptickém generalizovaném tonicko-klonickém záchvatu. Záchvat ustává právě díky únavě synapsí v epileptogenním ložisku.
Autoři podkapitoly: Patrik Maďa a Josef Fontana