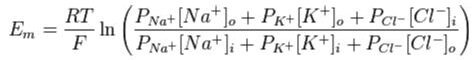Náplň podkapitoly:
1. Úvod
2. Klidový membránový potenciál
3. Akční potenciál
_
Úvod
V této podkapitole opakujeme informace o klidovém membránovém potenciálu a akčním potenciálu, jež byly uvedeny v Kapitole 3.
Mezi koncentracemi různých iontů uvnitř a vně membrány existují velké rozdíly. Buňky jsou obklopeny intersticiální tekutinou bohatou na sodík a chloridy. Cytoplazmatická tekutina je naopak bohatá na draslík a svým složením imituje podmínky, které panovaly v pramoři, kde buňky vznikly.
Tyto významné rozdíly vedou ke vzniku elektrického potenciálu napříč cytoplazmatickou membránou všech buněk v těle. Buňky, které označujeme jako dráždivé jsou schopny svůj membránový potenciál rychle měnit a využít jej k přenosu informace nebo k zahájení svalové kontrakce.
_
Klidový membránový potenciál
V lidském těle je membrána propustná pro celou řadu iontů. Proto nelze použít vztah pro výpočet Nernstova potenciálu, ale musíme užít tzv. Goldman-Hodgkin-Katzovu rovnici:
Jedná se o vztah, velmi podobný Nernstově rovnici, akorát zlomek koncentrací udává všechny uvažované ionty násobené svou propustností membrány P.
Difuzní potenciál na takovéto membráně se vyvíjí na základě:
1) Polarity náboje, který je nesen iontem
2) Permeability membrány, která je pro daný iont specifická
3) Jeho koncentrací na obou stranách membrány
Klidový membránový potenciál je pak taková hodnota difuzního potenciálu, která se za stálých podmínek s časem nemění, a popisuje biologické systémy, ve kterých se na elektrických změnách podílí více různých nosičů náboje. Za fyziologických stavů se právě sodné, draselné a chloridové ionty podílí na klidovém membránovém potenciálu.
Pokud bychom klidový membránový potenciál změřili na axolemně alfa-motoneuronu předních rohů míšních zjistili bychom hodnotu -90 mV. To znamená, že cytoplazma je o 90 mV negativnější než intersticiální tekutina. Obecně lze říci, že intracelulární tekutina je negativnější než extracelulární.
Důvod tohoto jevu je stejný jako v našem příkladu s nádobou (viz výše). Membrána všech buněk vykazuje největší permeabilitu pro draselný iont (asi 100x více než pro sodný). Dochází proto ke ztrátám kladného náboje z vnitřní strany membrány. Jak navíc vyplývá z Goldman-Hodgkin-Katzovy rovnice, tak iont s nejvyšší hodnotou permeability membrány se největší měrou podílí na klidovém membránovém potenciálu.
Vliv draselných iontů na klidový membránový potenciál
Pokud uvažujeme draselné ionty, jejichž hodnota koncentrace na vnitřní straně membrány je přibližně 140 mmol/l a vně 4 mmol/l, tak Nernstův potenciál je roven -94 mV. Všimněte si, že díky vysoké hodnotě propustnosti membrány pro draselné ionty se klidový membránový potenciál alfa-motoneuronu (-90 mV) blíží hodnotě “draselného” Nernstova potenciálu. Draslík je klíčový pro vznik a zachování klidového membránového potenciálu.
Membrány všech buněk jsou pro kalium dobře propustné, neboť obsahují tzv. “stále otevřené” iontové kanály pro draslík, někdy též nazývané draselné “leak” kanály. Oba tyto názvy jsou zavádějící neboť kanál není stále otevřený, ale spíše se v pravidelných krátkých intervalech otevírá a zavírá. K významnému efluxu (“leak”) draselných iontů za klidového stavu také nedochází, jelikož mu brání Coulombovské síly. Naopak je ustanovena dynamická rovnováha, takže počet iontů, které kanálem uniknou z cytoplazmy odpovídá počtu iontů, které se jím navrátí.
Vliv sodných iontů na klidový membránový potenciál
Vliv sodných iontů je naopak díky nízké permeabilitě membrány minimální. Nernstův potenciál pro sodné ionty je asi +61 mV, při koncentraci 142 mmol/l extracelulárně a 14 mmol/l intracelulárně.
Sodík nemůže vstupovat do cytoplazmatické membrány přes draselné “leak” kanály, poněvadž ty obsahují selektivní filtr, který je molekulárně sestaven tak, aby přesně interagoval s hydratačním obalem draselných iontů. Vzhledem k tomu, že sodné ionty jsou menší, nemůže selektivní filtr přesně interagovat s dipólem molekul vody. Nedojde tak k navázání sodíku v lumen kanálu a jeho uvolnění z hydratačního obalu. V hydratovaném stavu ionty sodíku neprojdou kanálem.
Vliv Na+/K+-ATPázy na klidový membránový potenciál
Vliv Na+/K+-ATPázy v udržení klidového membránového potenciálu je zanedbatelný. Přestože tento protein je schopen překonat obrovský koncentrační gradient a to i v elektrogenním režimu (tzn. 3 Na+ vně a 2 K+ dovnitř, přičemž vytváří úbytek kladného náboje v cytoplazmě) její hlavní úloha je v obnově iontových poměrů po proběhlém akčním potenciálu.
Kdyby byla Na+/K+-ATPáza vyřazena v buňce z funkce, změnil by se klidový membránový potenciál z -90 mV na -86 mV. Na+/K+-ATPáza tak v klidovém stavu přispívá pouze 4 mV.
_
Akční potenciál
Akční potenciál je speciální vlastnost vyhrazená buňkám dráždivých tkání – tedy svalové a nervové. Např. signály na nervových vláknech jsou kódovány prostřednictvím akčních potenciálů, respektive jejich frekvence a počtu. Obecně lze říci, že akční potenciál je náhlá změna membránového potenciálu. Obvykle je zahájen jako změna polarity membrány (např. z -90 mV na +35 mV) a pokračuje obnovou do výchozího stavu.
Celý tento děj trvá zhruba půl milisekundy a membrána dráždivé buňky projde několika stavy:
1) Klidový stav
2) Depolarizace
3) Přestřelení
4) Repolarizace
5) Hyperpolarizace
Klidový stav
V této chvíli je na membráně měřitelný klidový membránový potenciál (uvažujme -90 mV). Membránu neuronů a myocytů charakterizuje tzv. dráždivost. Je to schopnost měnit membránový potenciál při elektrické stimulaci a při dostatečně silném podnětu spustit akční potenciál. Dostatečně silný podnět je ten, který překoná hodnotu membránového potenciálu zvanou práh, který je u neuronů předního rohu míšního mezi -70 mV až -50 mV. Podnět musí vyvolat změnu v potenciálu alespoň 20 mV.
Pokud je podnět podprahový dojde k dočasné změně potenciálu (např z -90 mV na -80 mV). Ta je činností Na+/K+-ATPázy negována a membránový potenciál rychle klesá zpět na svou původní úroveň. Klidový stav membrány má tedy sebezáchovnou funkci při neadekvátních podnětech.
Přesnou hodnotu prahu lze určit měřením reobáze a chronaxie.
Reobáze je nejmenší možný podnět, který působí-li na membránu nekonečně dlouho vyvolá akční potenciál. V praxi se jako stimulus používá slabý proud a za nekonečně dlouhou dobu je považováno 300 ms. Začíná se s minimální amplitudou proudu, která se postupně zvyšuje, než během 300 ms vyvolá akční potenciál. Tak získáme hodnotu reobáze.
Chronaxie je doba, po kterou musí působit podnět dvojnásobku reobáze, aby byl vybaven akční potenciál. Jakmile je známá reobáze, nastaví se stimulace na dvojnásobek amplitudy proudu a změří se čas do vyvolání akčního potenciálu.
Pomocí chronaxie a reobáze lze sestavit křivku síla-doba, která přesně udává hodnotu prahu pro podnět o dané síle a dané době působení.
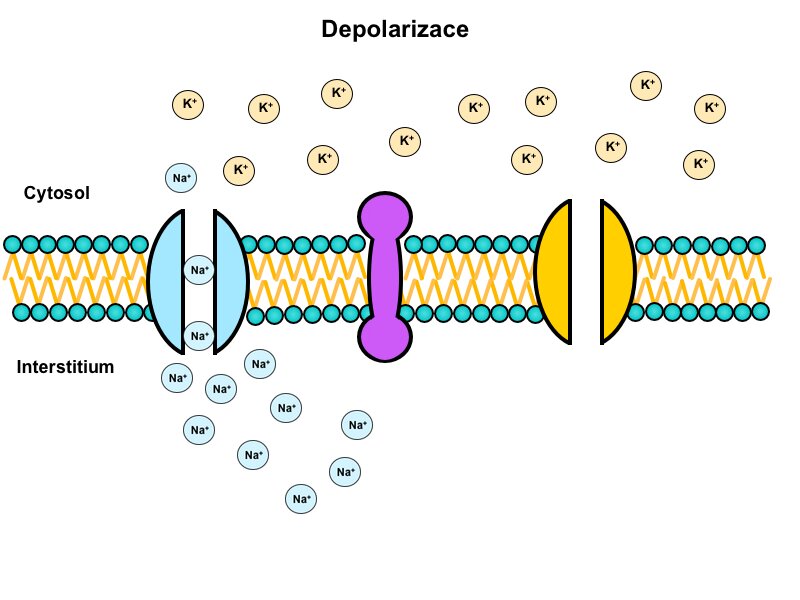
Depolarizace
Pokud podnět překoná hodnotu prahu, je vnitřní negativita dráždivé buňky okamžitě neutralizována influxem kladného náboje. Tento děj se nazývá depolarizace.
Za depolarizaci odpovídají napěťově řízené sodíkové kanály (voltage-gated), které se v dostatečném počtu otevírají při překročení prahu. Tyto kanály mají dvě domény, které slouží jako branky: aktivační a inaktivační. V klidovém stavu je aktivační branka uzavřená a inaktivační otevřená. Při překročení prahu dojde k otevření aktivační branky a kanál se stane propustným pro sodný iont. Tím se až 5000x zvýší propustnost membrány pro sodík. Jsou překonány sebezáchovné mechanismy klidového stavu zprostředkované Na+/K+-ATPázou. A během desetin milisekundy se membránový potenciál vychýlí do kladných hodnot.
Pokud je jednou překročena hodnota prahu je akční potenciál pro danou membránu vždy stejný. Má stejnou amplitudu i tvar a je rozveden po celé membráně dráždivé buňky. Tento fenomén se nazývá princip vše nebo nic.
Depolarizace je automaticky ukončena uzavřením inaktivační branky. Její doména automaticky prodělá konformační změnu po několika desetinách milisekundy od otevření aktivační branky, tím vyhasne influx sodných iontů.
Není bez zajímavosti, že napěťově řízené sodné kanály se otevírají i při podprahových podnětech. Jejich počet však není dostatečný na překonání udržovací funkce Na+/K+-ATPázy. Odpovídají tedy i za podprahové depolarizace, které jsou účinně zvráceny sebezáchovnými mechanismy.
Přestřelení – “oveshoot”
Jedná se o charakteristický projev akčního potenciálu na velkých nervových vláknech, kde z původního klidového akčního potenciálu (např. -90 mV) dosáhne amplituda akčního potenciálu až do kladných hodnot (+35 mV). U malých vláken, jako jsou například ta, která vedou bolestivé podněty, tento jev nepozorujeme a amplituda akčního potenciálu dosahuje asi -5 mV.
Je však nutné si uvědomit, že amplituda nekóduje žádné informace. Nositelem kódované informace je pouze počet a frekvence akčních potenciálů. Z informatického hlediska, tak není přítomnost přestřelení významná.
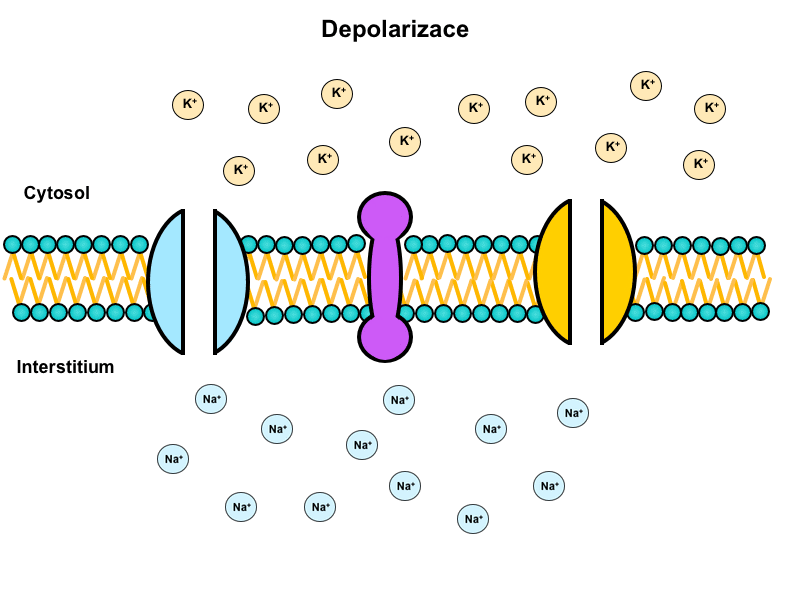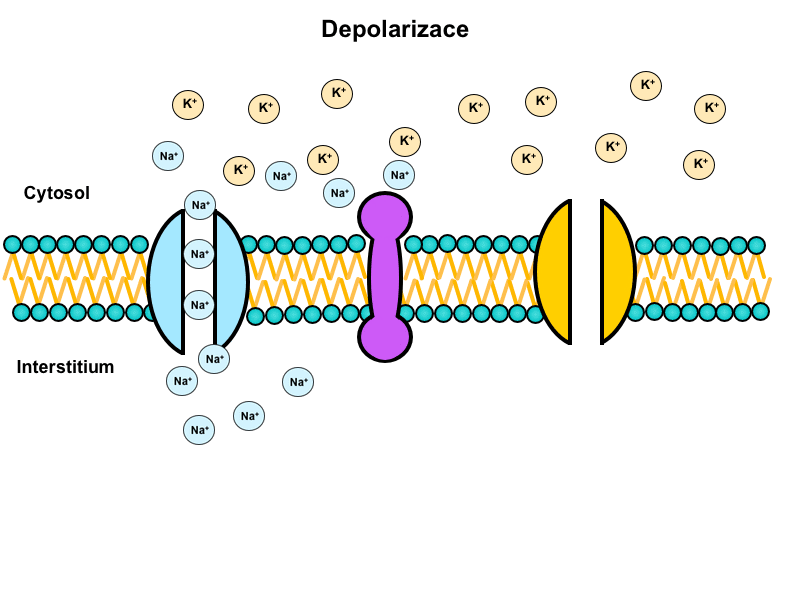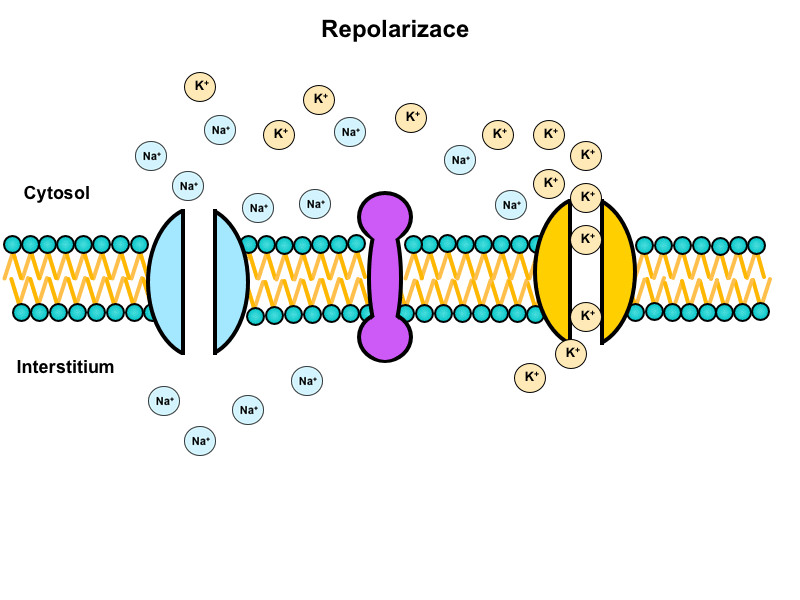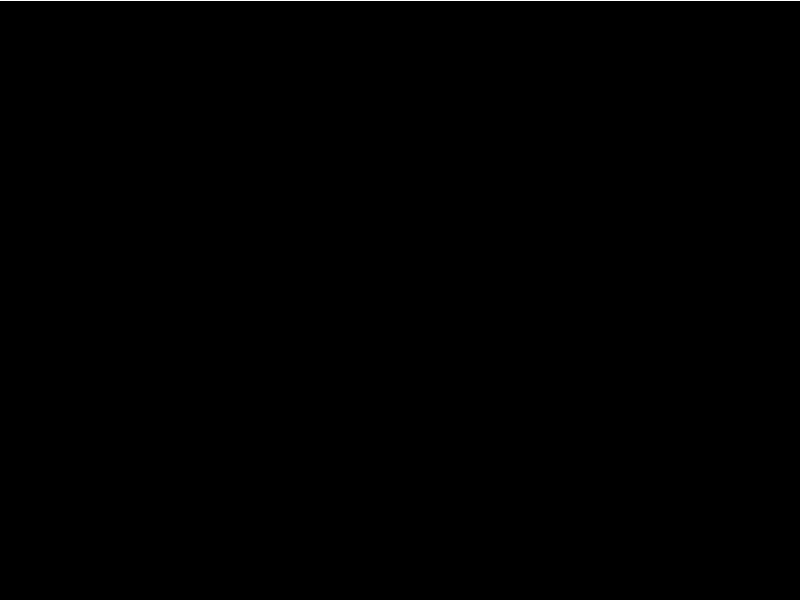
Repolarizace
Je děj, při kterém se membrána vrací do původního stavu. Jinak řečeno membránový potenciál se navrací do hodnot klidového membránového potenciálu.
Molekulární podklady repolarizace jsou tři:
1) Uzavření inaktivační branky napěťově řízených sodíkových kanálů
2) Otevření napěťově řízených draselných kanálů
3) Aktivita Na+/K+-ATPázy
Uzavření inaktivační branky napěťově řízených sodíkových kanálů
Toto jsme diskutovali již výše v textu. Je zabráněno dalšímu influxu sodných iontů.
Podstatné je, že inaktivační branka se neotevře, dokud membrána nedosáhne zpět klidového membránového potenciálu. Proto v prvních dvou třetinách repolarizace nevyvolá akční potenciál žádný, jakkoliv velký podnět. Tento jev nazýváme absolutní refrakterní fází.
Otevření napěťově řízených draselných kanálů
Tyto kanály ještě zvýší propustnost membrány pro draslík. Díky přebytku kladného náboje v cytoplazmě dojde ke změně směru elektrického gradientu pro draselné ionty a jejich masivnímu efluxu.
Přestože je membrána pro draselné ionty dobře propustná, jsou v ní přítomny i speciální kanály, jejichž úkolem je zvýšit únik draslíku během repolarizační fáze akčního potenciálu tak, aby došlo ke kompenzaci excesivního kladného náboje, který byl vnesen do buňky sodnými ionty. Tyto napěťově řízené draselné kanály mají pouze jednu branku, která začne prodělávat konformační změnu ihned po překročení prahu (tedy spolu se sodnými kanály). Jedná se ovšem o změnu relativně pomalou, která je dokončena zhruba ve chvíli, kdy jsou uzavřeny inaktivační branky sodných kanálů. Díky těmto vlastnostem se napěťově řízené draselné kanály někdy nazývají pomalé a sodné rychlé.
Činnost Na+/K+-ATPázy
Jak v průběhu depolarizace, tak repolarizace nastávají podél membrány změny ve složení iontů. Aby byla membrána připravena na další akční potenciály a bylo obnoveno normální perimembranózní iontové složení, je nutná aktivita Na+/K+-ATPázy.
Tato pumpa přečerpává 3 Na+ ionty ven výměnou za 2 K+ ionty za současného štěpení ATP. Díky energii z makroergních vazeb je schopna překonávat obrovské koncentrační gradienty.
Její významnou vlastností je to, že úroveň její aktivity je přímo úměrná třetí mocnině intracelulární koncentrace sodných iontů. To znamená, že při desetinásobné koncentraci sodíku stoupne její aktivita 1000x.
Také je nutné si uvědomit, že iontové změny, které byly popsány výše se odehrávají pouze v okolí membrány. Aby byla měřitelná jakákoliv změna v intracelulární koncentraci iontů je nutné, aby průměrně velký neuron prodělal asi 20 000 000 akčních potenciálů v rychlém sledu.
Hyperpolarizace
Je stav, kdy membránový potenciál poklesne pod úroveň klidového membránové potenciálu. Např. místo -90 mV klesne až na -94 mV. Tento jev je způsoben zejména pomalým uzavíráním napěťově řízených draselných kanálů.
Vzhledem k tomu, že Nernstův potenciál pro draselný iont je -94 mV, vede dočasné zvýšení permeability k dalšímu efluxu draselných iontů (a s nimi i kladného náboje). Tento děj je odvoditelný z Goldman-Hodgkin-Katzovy rovnice.
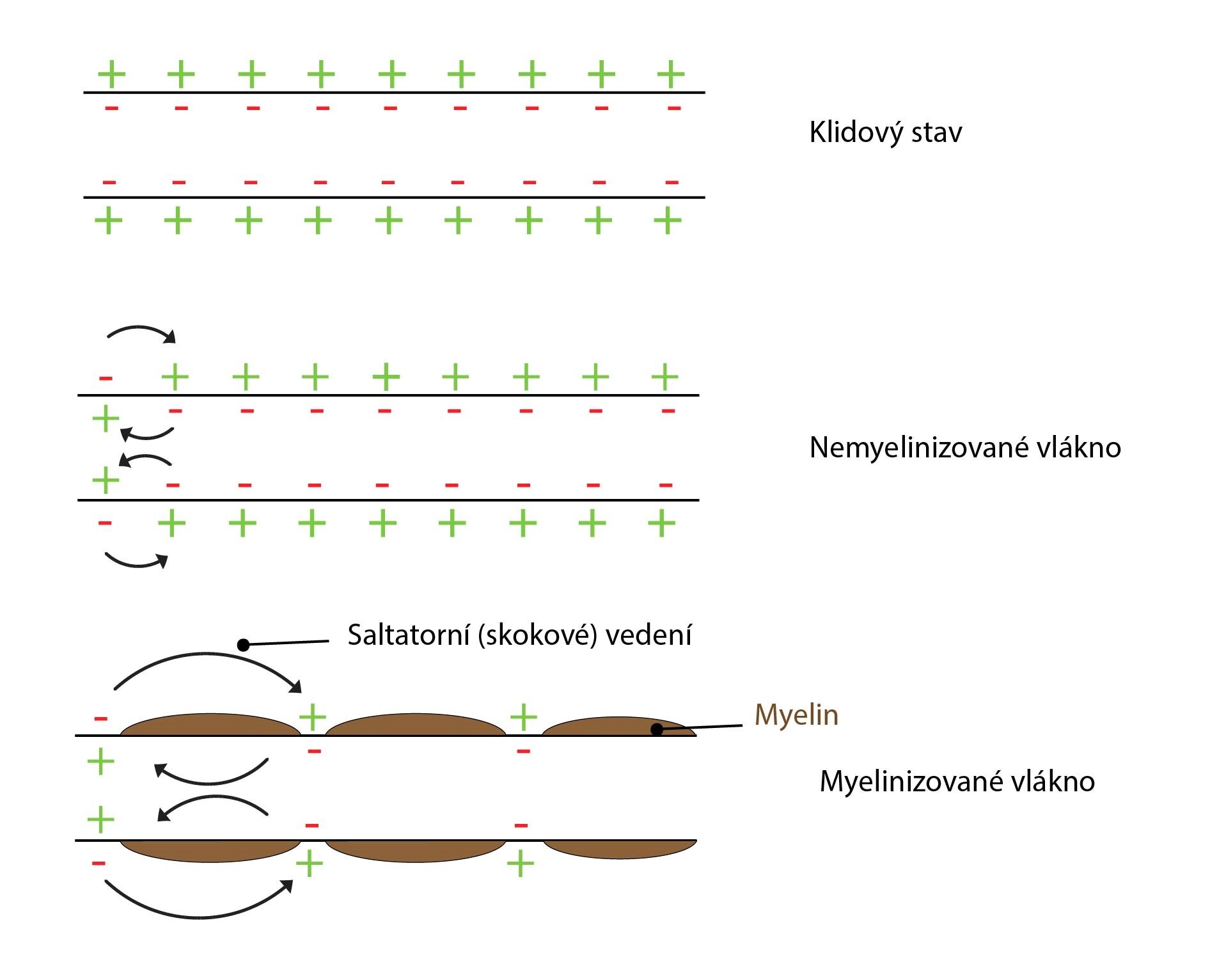
Vedení akčního potenciálu
Jakmile vznikne akční potenciál, je veden po celé délce membrány v obou směrech. Vznikají proudové branky, což jsou místní toky iontů. Sodné ionty se šíří podél vnitřního povrchu membrány a draselné podél vnějšího, čímž depolarizují další úseky membrány a akční potenciál vzniká v jejich přilehlých částech. V místě vzplanutí dalšího akčního potenciálu opět vzniká proudová branka a celý děj se cyklicky opakuje. Možný je postup pouze vpřed v obou směrech podél membrány (nikoli na zpět místa, kde již cyklus proběhl), neboť v místě vzniku předchozího akčního potenciálu je membrána v absolutní refrakterní fázi, a není proto možné ji depolarizovat proudovou brankou.
Na velkých myelinizovaných axonech se akční potenciály šíří skokově tzv. saltatorním vedením. Proudové branky zde dosahují do vzdálenosti až 3 mm a nové akční potenciály vznikají pouze v místě Ranvierových zářezů. Zbytek axonu je izolován a nenachází se zde molekulárně biologický aparát pro propagaci vzruchu (pomalé a rychlé kanály, Na+/K+-ATPáza).
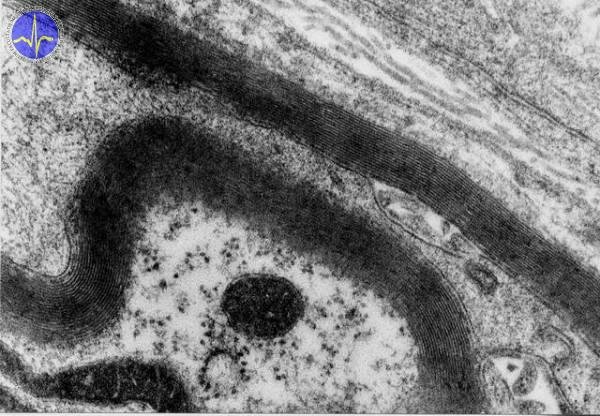
Myelinová pochva
Autoři podkapitoly: Patrik Maďa a Josef Fontana