Náplň podkapitoly:
1. Úvod k hormonům štítné žlázy a příštítných tělísek
2. Hormony štítné žlázy
3. Hormony příštítných tělísek
_
Úvod k hormonům štítné žlázy a příštítných tělísek
Štítná žláza je jednou z největších endokrinních žláz lidského těla. Hlavní hormony, které produkuje, se nazývají trijodthyronin a tyroxin. Tyto mají účinek téměř na všechny buňky těla a regulují jejich metabolickou aktivitu. Jejich hypersekrece může zvýšit metabolický obrat až dvakrát, hyposekrece ho může naopak snížit na polovinu. Dalším hormonem produkovaným štítnou žlázou je kalcitonin. Ten nemění metabolický obrat, ale zasahuje do metabolismu iontů kalcia (a fosfátů). Iontu, který mimo jiné zodpovídá i za stabilizaci membránových potenciálů a sebemenší změny v jeho metabolismu tedy mohou mít velmi zásadní důsledky.
Pokud vezmeme v potaz i fakt, že poruchy funkce štítné žlázy jsou jedny z nejčastějších endokrinologických patologií, se kterými se lékař – internista – ve své praxi setkává, je jisté, že thyreoidálním hormonům je potřeba věnovat zvýšenou pozornost.
_
Hormony štítné žlázy
Buňky štítné žlázy produkují jednak trijodthyronin (T3) a tyroxin (T4) a jednak kalcitonin. V této části se budeme nejdříve podrobně věnovat trijodthyroninu a tyroxinu. O kalcitoninu, jehož význam v lidském těle je nejspíše značně omezený, se zmíníme na závěr.
Trijodthyronin a tyroxin
Struktura trijodthyroninu a tyroxinu
Struktura hormonů štítné žlázy je jedinečná díky přítomností jódu v jejich molekulách – jedná se o jodované deriváty aminokyseliny tyrosinu. T3 (3,5,3’-trijodthyronin) obsahuje tři a T4 (3,5,3’,5’-tetrajodthyronin, nebo také tyroxin) čtyři atomy jódu.
Kromě T3 a T4 nalézáme v krvi i malé množství tzv. reverzního T3 (rT3, 3,3’,5’-trijodthyronin), který vzniká metabolickou přeměnou T4 a na rozdíl od T3 (který z T4 vzniká také) je jeho neúčinným metabolitem.
Syntéza trijodthyroninu a tyroxinu
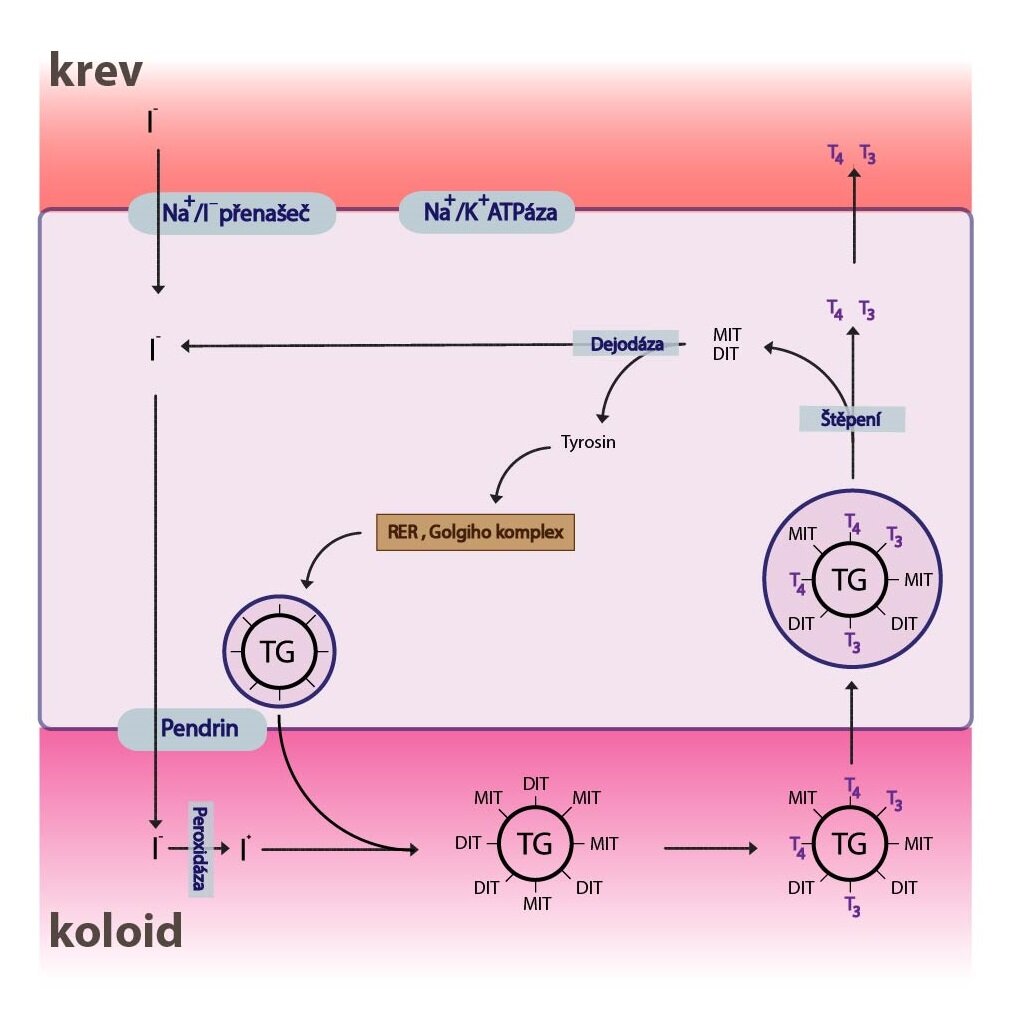
Prekurzorem hormonů štítné žlázy je rozměrná jodovaná a glykosylovaná molekula proteinu thyreoglobulinu, která obsahuje více než sto tyrosinových zbytků. Větší část molekuly sestává z neaktivních prekurzorů – MIT (monojodtyrosin) a DIT (dijodtyrosin) a menší z jodthyronylových zbytků – T3 a T4. Tvorbu T3 a T4 můžeme rozdělit do několika kroků:
1) Syntéza thyreoglobulinu
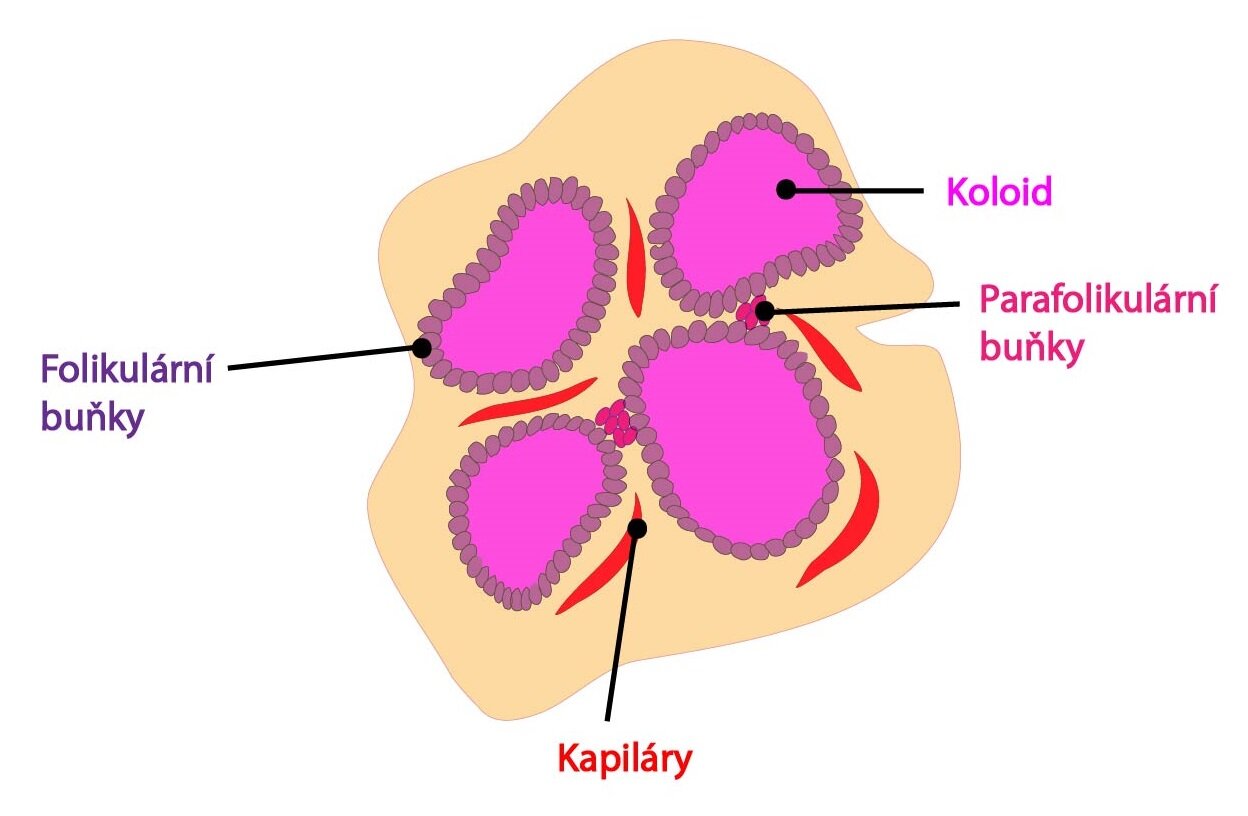
Syntéza thyreoglobulinu probíhá na rER a GA folikulárních buněk, odkud je thyreoglobulin následně transportován do lumina folikulů (tvoří součást tzv. koloidu).
2) Zisk jódu a jeho transport do koloidu
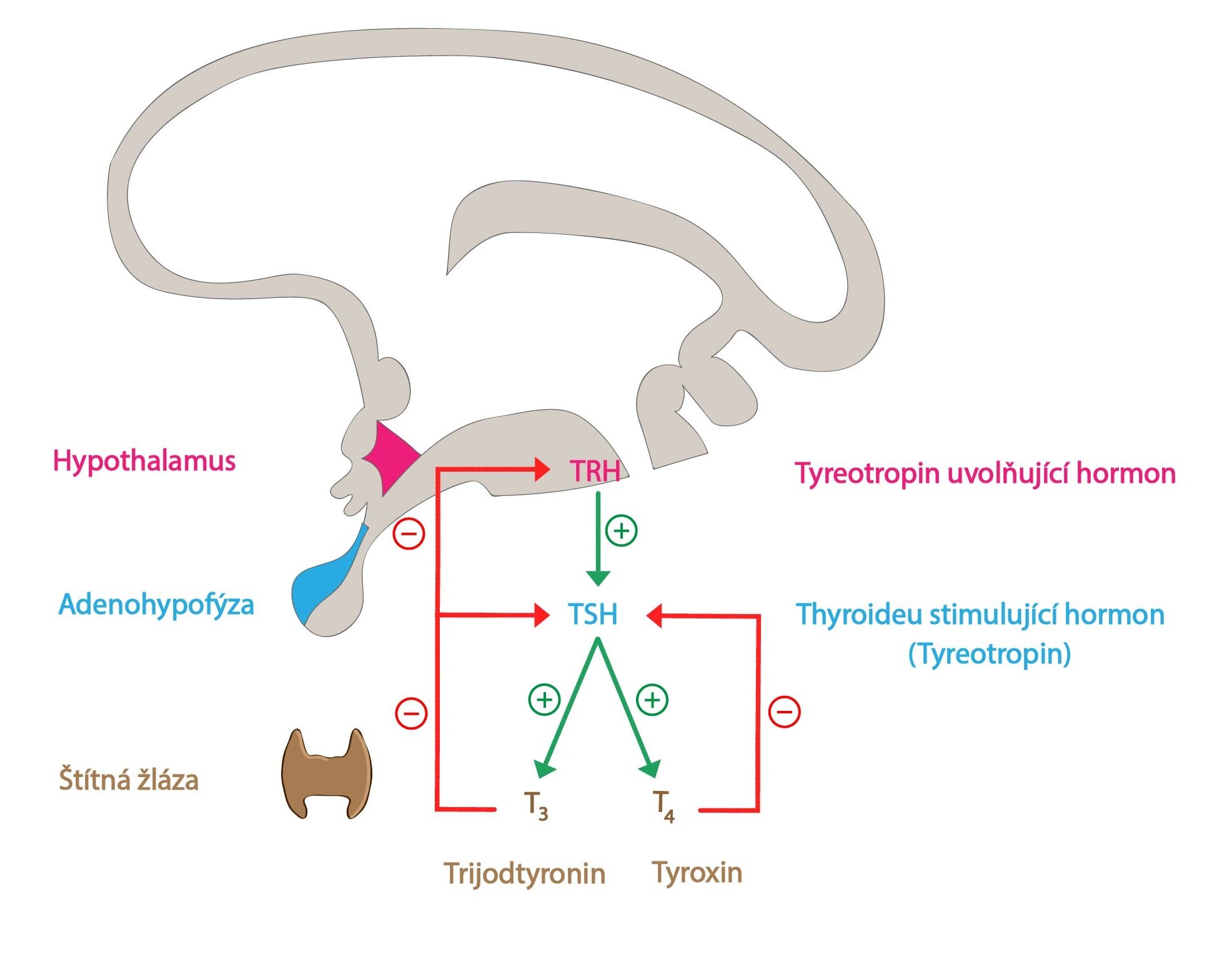
Jód se získává činností thyreoidální iodidové pumpy (Na+/I– symport). Jedná se o sekundárně aktivní transport, při kterém je využíván koncentrační gradient Na+ (tvořený Na+/K+-ATPázou) k současnému přenosu I– proti jeho koncentračnímu gradientu. Tento proces primárně regulován TSH produkovaným v adenohypofýze.
Efektivita tohoto přenosu se dá popsat pomocí tzv. T:S poměru (poměr jodidů v thyreocytech vůči sérovým jodidům). Při běžné stravě činí T:S poměr ~ 20:1. Transport jodidů z cytosolu do koloidu provádí přenašeč nazývaný pendrin.
3) Oxidace jodidů
Dalším krokem je oxidace jodidu I– prostřednictvím enzymu thyroperoxidázy, jež obsahuje hem, na molekulární jód I2. Reakce vyžaduje H2O2, který je tvořen za spotřeby NADPH. Tento krok se odehrává na luminální membráně thyreocytů, při přestupu jodidu do koloidu.
4) Organifikace jódu (jodace tyrosinu)
Vzniklé molekuly jódu se následně váží na tyrosylové zbytky thyreoglobulinu v procesu jodace tyrosinu (organifikace). Této reakce se nejspíše též účastní thyreoperoxidáza. Nejprve vzniká MIT a následně DIT.
Klinická korelace:
Existuje skupina látek působících jako inhibitory thyreoperoxidázy, které brání oxidaci jodidu, a tak zastavují tvorbu hormonů štítné žlázy. Mezi nejznámější patří deriváty thiourey jako propylthiouracil nebo methimazol (a jeho neaktivní prekurzor karbimazol). Jejich využití je především v terapii hyperfunkce štítné žlázy, kde snižují původně vysoké koncentrace hormonů v krvi. Jejich efekt na biosyntézu je okamžitý, ale kvůli relativně vysokému množství zásobních forem hormonů (skladovaných v kolodiu nebo vázaných na transportní proteiny) se klinický účinek dostaví až s určitou latencí.
5) Kondenzace
Ke vzniku T3 a T4 dochází kondenzací. Ze dvou molekul DIT vzniká T4 a z jedné molekuly DIT a jedné molekuly MIT vzniká T3. Za normálního stavu, při dostatečném přívodu jódu je poměr vzniklých T4:T3 přibližně 6:1. Nasyntetizované hormony zůstávají součástí thyreoglobulinu a představují zásobu na několik týdnů (až 3 měsíce).
6) Endocytóza a rozklad thyreoglobulinu v lyzosomech a uvolnění T3 a T4
V důsledku působení TSH dochází ke stimulaci endocytózy koloidu a vytvořené fagosomy se sloučí s lyzosomy. Ve vzniklých fagolyzosomech dochází k hydrolýze thyreoglobulinu na fragmenty. Kromě T3 a T4, které jsou následně secernovány do krevního řečiště, vznikají i MIT a DIT. Ty jsou zbaveny jódu dejodázou (závislá na NADPH) a jód je reutilizován.
Transport trijodhtyroninu a tyroxinu v krvi
T3 a T4 jsou (jako i ostatní lipofilní hormony) v krvi transportovány ve vazbě na plazmatické proteiny. Toto podmiňuje existenci rovnováhy volné (fT4, fT3) a vázané formy, přičemž jen volná frakce je fyziologicky účinná (a má inhibiční vliv na sekreci TSH). Vázáno na proteiny je více než 98 % T4 a T3. Hormony přenáší TBG (thyroxin vázající globulin), TBPA (thyroxin vázající prealbumin) a také albumin. Nejvyšší afinitu má TBG, a fyziologicky tak váže téměř veškerý T3 a T4. Množství TBG v plazmě je regulováno a může být změněno různými mechanismy (účinkem hormonů, onemocněním). Při laboratorním stanovení koncentrace T3 a T4 je třeba rozlišovat, zda se měří jejich volná (fT3 a fT4) či celková koncentrace. Celková koncentrace totiž může být změněna i bez toho, aby se změnila hladina volných hormonů (např. při změně koncentrace TBG).
Metabolismus trijodthyroninu a tyroxinu
Plazmatický poločas tetrajodthyroninu (tyroxinu) je přibližně 6 dnů, v případě trijodthyroninu jen přibližně jeden den. T3 se ale váže na intracelulární receptory s mnohem vyšší afinitou, a proto zajišťuje většinu účinku thyreoidálních hormonů v tkáních.
V periferních tkáních dochází působením dejodáz k přeměně většiny cirkulujícího T4. 5’-dejodáza přeměňuje tyroxin na T3, 5-dejodáza na rT3. T4 tedy můžeme chápat jako prohormon s určitou vnitřní aktivitou. Syntéza 5-dejodázy se zvyšuje při hladovění a některých onemocněních. Cílem je šetření energie, rT3 totiž vykazuje minimální účinnost.
Thyreoidální hormony jsou při svém katabolismu úplně zbaveny jódu a následně jsou inaktivovány deaminací a dekarboxylací. V játrech se glukuronidují a sulfatují a v této hydrofilnější podobě jsou vyloučeny žlučí do střeva. Část z nich se vyloučí stolicí, část podléhá enterohepatální recirkulaci a je vyloučena močí v konjugátech s kyselinou glukuronovou.
Účinek trijodthyroninu a tyroxinu na intermediární metabolismus
Thyreoidální hormony mají významný kalorigenní účinek a jsou zodpovědné za dlouhodobé „metabolické ladění“ (odpověď organismu během dnů a týdnů). Zvyšují spotřebu O2 v tkáních (zejména mozek, varlata, uterus, lymfatické uzliny, slezina a adenohypofýza), zvyšují počet a velikost mitochondrií a celkově aktivují buněčný metabolismu. Dochází ke zvýšené tvorbě tepla a to i přímo působením na hnědou tukovou tkáň, aktivací uncoupling proteinů (např. termogeninu).
V rámci metabolismu sacharidů zvyšují jejich vstřebání ve střevě a stimulují utilizaci glukózy na periferii. Při provedení oGTT (oral glucose tolerance test) se při nadbytku thyreoidálních hormonů (hypertyreóza) popisuje tzv. gotický tvar křivky (pro rychlé vstřebání glukózy a současně rychlý návrat k výchozí hodnotě).
V rámci metabolismu lipidů dochází jednak ke zvýšenému metabolismu mastných kyselin (aktivuje se lipolýza a snižují se zásoby tukové tkáně v organismu), jednak se snižuje hladina cholesterolu v krvi (snížení syntézy cholesterolu a jeho zvýšené vylučování žlučí).
V rámci metabolismu proteinů je jejich účinek komplexní. Thyreoidální hormony stimulují syntézu některých proteinů (Na+/K+-ATPáza, enzymy dýchacího řetězce), u jiných proteinů naopak vedou k jejich katabolismu (např. zvýšené odbourávání svalových proteinů).
Kromě přímých efektů na metabolismus modulují thyreoidální hormony i funkce jiných hormonů – například zvyšují počet adrenergních receptorů, čímž zesilují účinky katecholaminů, či zvyšují expresi růstového hormonu (STH). Thyreoidální hormony tedy mají i prorůstový význam.
Kalcitonin
Kalcitonin je hormon tvořený parafolikulárními buňkami (tzv. C-buňky) štítné žlázy. Jedná se o peptid tvořený 32 aminokyselinami s poločasem přibližně 10 minut. Alternativním sestřihem genu pro kalcitonin může vznikat CGRP (calcitonin gene related peptide, peptid spřízněný s kalcitoninovým genem).
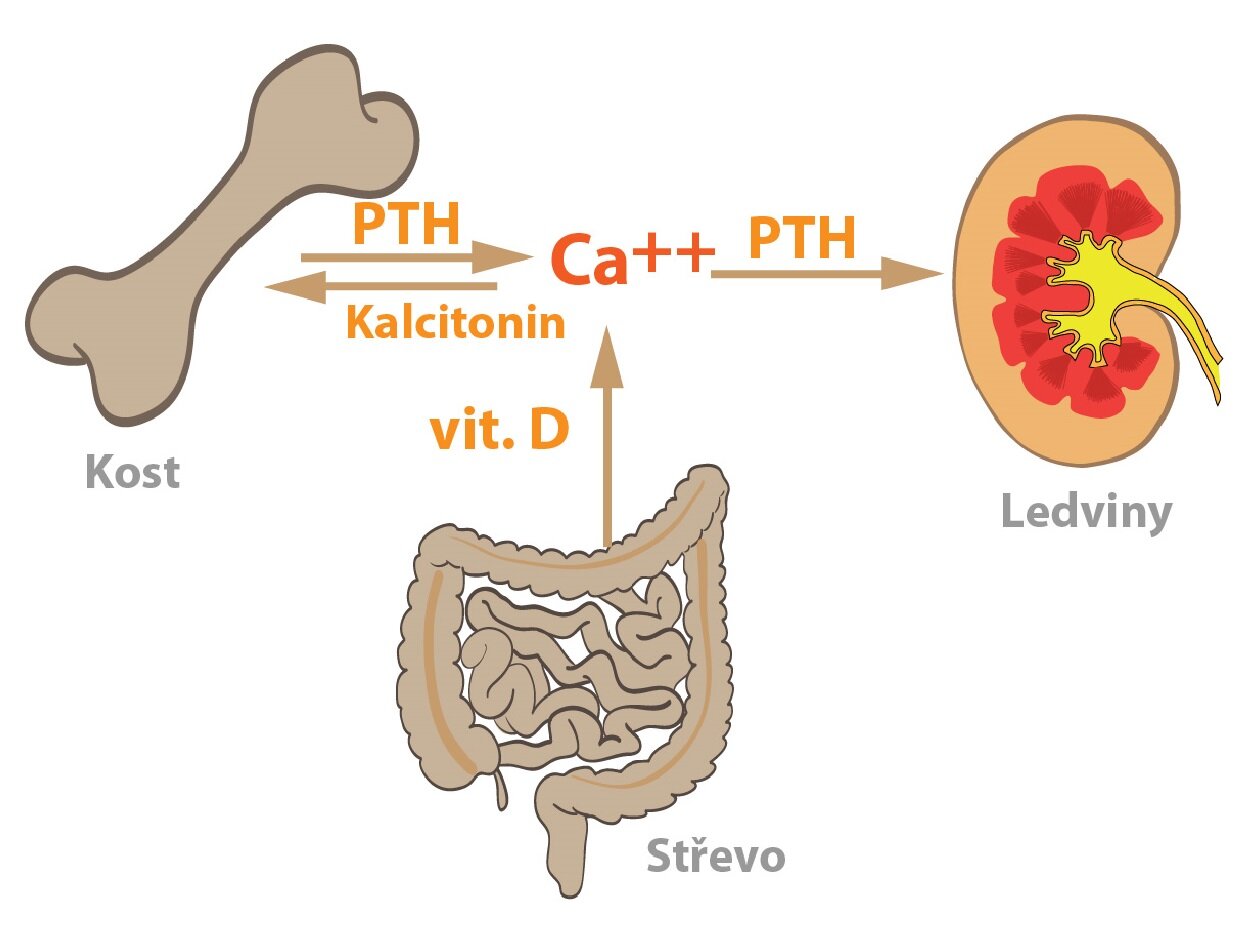
Kalcitonin snižuje hladinu plazmatického kalcia. Děje se tak třemi mechanismy:
1) Inhibuje absorpci ionizovaného kalcia ze střeva
2) Inhibuje zpětné vstřebávání (reabsorpci) kalcia v ledvinných tubulech
3) Inhibuje aktivitu osteoklastů
Jeho sekrece je zvýšená při hyperkalcemii, stavu, kdy je zvýšená hladina plazmatického kalcia. O míře jeho fyziologického účinku se vedou spory, neboť výše zmíněné účinky se projevují in vitro až za koncentrací kalcitoninu, které se v lidském organismu běžně nevyskytují.
_
Hormony příštitných tělísek
Struktura a syntéza parathormonu
Parathormon (PTH) je lineární polypeptid tvořený 84 aminokyselinami bez navázaných sacharidů, či jiných molekul. Za jeho biologickou účinnost zodpovědný N-terminální konec (asi 1/3 molekuly).
Parathormon je syntetizován na rER jako 115 aminokyselinový prekurzor preproPTH. Po odštěpení signální sekvence dochází ke vzniku proPTH o délce 90 aminokyselin, který je bezprostředním prekurzorem PTH. K odštěpení dochází v cisternách rER a proPTH je následně transportován do GA, kde se oddělí další část molekuly a vzniká PTH. Ten může být secernován do krve, nebo vytvořit pohotovostní zásobu v buňce.
Funkce parathormonu
Uvádí se, že PTH zvyšuje hladinu ionizovaného kalcia v plazmě svým účinkem na následující orgány:
a) Kosti
b) Ledviny
c) Střeva
Kosti
V kostní tkáni nepřímo zvyšuje aktivitu osteoklastů. Původně byl efekt PTH považován za přímý, ale bylo zjištěno, že osteoklasty neexprimují příslušný receptor. PTH se váže na receptory na osteoblastech, které pak ve vyšší míře stimulují prekurzorové buňky osteoklastů k diferenciaci. Tak se postupně (a relativně dlouhodobě) zvyšuje míra resorpce kostní tkáně a roste i hladina ionizovaného kalcia. Parathormon vyvolává u osteoblastů zvýšenou expresi RANKL, což je peptid, který spolu s M-CSF aktivuje signalizační cesty pro diferenciaci prekurzorů osteoklastů.
Ledviny
Parathormon působí v distálním tubulu ledvin a zvyšuje míru resorpce vápenatých a hořečnatých iontů z lumina tubulu. Souběžně zvyšuje sekreci fosfátů do lumina tubulu a tím i jejich vylučování.
Střevo
Ve střevě parathormon nepřímo zvyšuje resorpci vápenatých iontů. Děje se tak zvýšením aktivity enzymu, který se účastní přeměny prekurzorů vitaminu D na konečný – hormonálně aktivní – produkt. Jedná se upregulaci ledvinné 1α-hydroxylázy.
Degradace parathormonu
Poločas rozpadu PTH je přibližně 10 minut. Většina de novo syntetizovaného PTH se ihned po syntéze degraduje a jen menšina vstupuje do oběhu. Periferního odbourávání PTH se účastní především játra a ledviny. V Kupfferových buňkách jater dochází k proteolýze na karboxy- a amino-fragemty. Amino-fragmenty podléhají rychlé degradaci, karboxy-fragmenty zůstávají nějakou dobu v cirkulaci. Z krve jsou fragmenty vyloučeny ledvinami.
Autoři podkapitoly: Petra Lavríková, Patrik Maďa a Josef Fontana