Náplň podkapitoly:
1. Úvod do regulačních mechanismů lidského těla
2. Hormony
3. Kontrola sekrece hormonů
4. Mechanismus účinku hormonů
5. Poruchy funkce žláz s vnitřní sekrecí
_
Úvod do regulačních mechanismů lidského těla
Základní úlohou všech orgánových systémů lidského těla je udržování homeostázy. Aby tento úkol mohl být splněn, musely se během evoluce s rostoucí složitostí organismů vyvíjet stále důmyslnější integrační systémy, které regulovaly funkce jednotlivých tkání a orgánů tak, aby homeostázy bylo docíleno jejich koordinovanou činností.
U člověka tuto funkci zastává jednak nervová soustava schopná registrovat okamžité změny vnějšího i vnitřního prostředí a rychle na ně reagovat, jednak celá řada žláz s vnitřní sekrecí, jejichž reakce je obvykle pomalejší, ale zato vyvolá dlouhodobější změny. Tyto dva systémy jsou tak úzce spojeny celou řadou vzájemných interakcí, že dnes bývají souhrnně označovány jako systém neuroendokrinní. V neposlední řadě se v situacích, kdy je homeostáza ohrožena chorobným procesem, do integrační funkce zapojuje i systém imunitní.
V této kapitole se zaměříme pouze na jednu část integračního plánu lidského těla a to na žlázy s vnitřní sekrecí. Nejdříve se budeme podrobněji věnovat obecným principům endokrinních regulací v lidském organismu.
_
Hormony
Žlázy s vnitřní sekrecí ovlivňují funkce cílových tkání prostřednictvím působků, které sekretují do krve a které jsou cirkulací unášeny na velké vzdálenosti. Jejich cílem může být pouze specifická populace buněk. Například hypotalamický hormon kortikoliberin (CRH) stimuluje pouze kortikotropy adenohypofýzy. Nebo právě naopak mohou ovlivnit většinu buněk v těle, tak jak to vidíme u hormonu štítné žlázy tyroxinu. Hormony jsou také schopny regulovat jen určitou funkci (např. vodní bilanci) nebo vyvolat komplexní změny v růstu a vývoji organismu, případně být příčinou změn nálad.
Z uvedeného textu vyplývá, že se jedná o látky velmi různorodé. To, zda můžeme látku považovat za hormon, určují následující kriteria (je ale nutno zdůraznit, že s pokrokem fyziologie ztratila absolutní platnost a jedná se spíše o orientační specifikace):
1) Cílený efekt
2) Specifický účinek
3) Vysoká účinnost
Cílený efekt
Znamená, že daná látka reguluje funkci pouze určitých buněk, tkání nebo orgánů.
Specifický účinek
Znamená, že daná látka vyvolá změny, které jsou v organismu jedinečné a které nevyvolá žádná jiná endogenní látka.
Vysoká účinnost
Znamená, že látka je účinná (tzn. vyvolá cílený a specifický efekt) v nízkých plazmatických koncentracích – obvykle pikomolárních, maximálně mikromolárních.
Účinek a vlastnosti jednotlivých hormonů se odvíjejí od jejich chemické struktury, na jejímž podkladě je můžeme rozdělit do tří skupin:
1) Proteiny a polypeptidy
2) Steroidní látky
3) Deriváty aminokyseliny tyrosinu
Proteiny a polypeptidy
Tvoří nejpočetnější skupinu hormonů. Jsou produkovány např. v hypotalamu, hypofýze, pankreatu a příštitných tělíscích.
Jejich syntéza začíná obvykle na ribozomech drsného endoplazmatického retikula jako tzv. preprohormon. Ten je uvnitř endoplazmatického retikula naštěpen na prohormon a následně transportován do Golgiho aparátu. Zde je balen do jednotlivých sekrečních vezikul, ve kterých jsou přítomny aktivní enzymy štěpící prohormon na účinný hormon a inaktivní fragment. Hormon je v sekrečních vezikulách skladován, dokud se neobjeví adekvátní podnět, který změní permeabilitu membrány pro vápenaté kationty nebo zvýší intracelulární koncentraci cAMP. Tyto změny spouští mechanismy vedoucí k fúzi cytoplazmatické membrány s membránou vezikula a v konečném důsledku k exocytóze hormonu.
Hormony charakteru proteinů a peptidů jsou hydrofilní látky, jež se dobře rozpouštějí v krevní plazmě a nepotřebují tak žádný přenašeč. To mimo jiné znamená to, že celá porce hormonu uvolněná z vezikul do cirkulace je účinná, a tedy schopná vyvolat specifické změny v cílových tkáních.
Steroidní látky
Hormony, jejichž chemická struktura je odvozena od cholesterolu, se produkují převážně v kůře nadledvin, ovariích, varlatech a placentě.
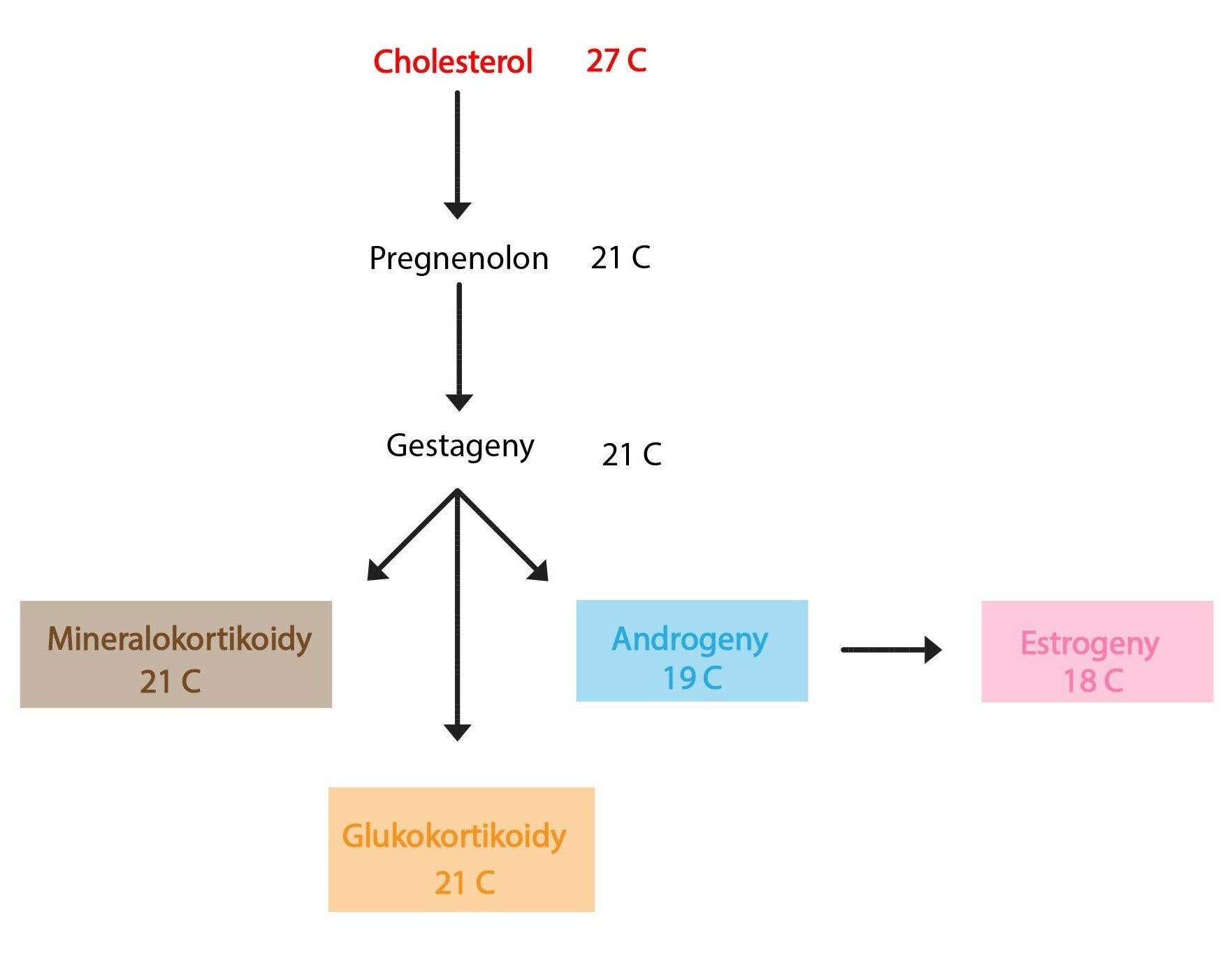 Jejich syntézu nelze jednoduše shrnout, je totiž založena na sekvenci reakcí specifických pro každý jednotlivý hormon. Dá se ale říci, že jako základní substrát těchto syntéz figuruje samotný cholesterol.
Jejich syntézu nelze jednoduše shrnout, je totiž založena na sekvenci reakcí specifických pro každý jednotlivý hormon. Dá se ale říci, že jako základní substrát těchto syntéz figuruje samotný cholesterol.
Vznikají tak lipofilní látky, které nelze skladovat v sekrečních vezikulech, neboť by kvůli své rozpustnosti v tucích snadno prostoupily systémem membrán do krve. Adekvátní stimulus zde proto spouští syntézu, nikoli vylití hormonu. Je však nutné zdůraznit, že v cytoplazmě buněk produkujících steroidní hormony nalézáme četné vakuoly s estery cholesterolu, které slouží jako rychle mobilizovatelná zásoba základního substrátu syntézy.
Díky své lipofilitě se steroidní hormony nerozpouštějí v plazmě, musí proto existovat transportní systémy, jež hormon dopraví k cílové tkáni. Transportérem obvykle rozumíme protein, který tvoří s hormonem komplex na principu nekovalentních interakcí. Existuje celá řada plazmatických molekul, které plní roli specifických přenašečů pro určitý hormon (transkortin, sex hormone-binding globulin), současně se na transportu podílejí i nespecifické plazmatické proteiny jako například albumin. Ten má sice výrazně nižší afinitu k transportovaným hormonům než jejich specifický přenašeč, zato je ale v plazmě zastoupen ve vysokých koncentracích.
Na tyto transportní proteiny se naváže více než 90 % celkové porce hormonu. Vzniknou tak vázaná a volná frakce vzájemně v dynamické rovnováze.
Podstatné je, že komplex hormon-přenašeč tvoří relativně velkou molekulu, která nemůže kapilárním řečištěm difundovat k cílovým tkáním. Vázaná frakce je proto neúčinná a fyziologicky je pouze zásobárnou („poolem”) volné frakce. Jen malá část hormonu je tedy schopna vyvolat svůj specifický účinek.
Přítomnost transportního systému nabízí organismu další cestu, jak ovlivnit okamžitou koncentraci volné frakce, a tím i regulovat účinek hormonu:
1) Syntéza daného steroidního hormonu
Zvýší celkovou koncentraci hormonu a tím i volné frakce. Tato změna ale bude neproporcionální, neboť zvýšení rychlosti syntézy povede k většímu nárůstu ve vázané – inaktivní – frakci než ve volném hormonu.
2) Syntéza specifického transportéru
Probíhá v hepatocytech. Relativně sníží koncentraci volné frakce, aniž by snížila celkovou koncentraci hormonu. Dojde k posunu chemické rovnováhy na stranu vázané frakce.
Deriváty aminokyseliny tyrosinu
Hormony této skupiny vznikají ve dřeni nadledvin a štítné žláze. I přes velmi specifický název se jedná o heterogenní skupinu, kterou lze rozdělit na další dvě specifické podskupiny:
a) Thyreoidální hormony
b) Hormony dřeně nadledvin (katecholaminy)
Thyreoidální hormony
Jsou syntetizovány ve folikulárních buňkách štítné žlázy. Díky jodaci mají tyto hormony velmi specifické vlastnosti, zejména lipofilitu. Aby je bylo možné ve folikulech žlázy skladovat (nedifundovaly přes systémy membrán), jsou inkorporovány do makromolekuly thyreoglobulinu, který tvoří koloid. Při adekvátním stimulu dojde k uvolnění hormonů z makromolekuly, jejich navázání na plazmatický transportní protein a cestě k cílovým tkáním.
Katecholaminy
Od thyreoidálních hormonů se liší svou chemickou strukturou (nejsou jodované), a proto jsou hydrofilní. Tyto hormony je možné skladovat v sekrečních vezikulech (podobně jako proteiny a peptidy) a v případě adekvátního stimulu pouze vylít preformované hormony prostřednictvím exocytózy do cirkulace. V krevní plazmě se vyskytují rozpuštěné.
_
Kontrola sekrece hormonů
Hladina koncentrace hormonů v plazmě se mění na základě nejrůznějších stimulů, vždy je ale velmi přísně kontrolována. Existuje několik mechanismů, které se na této regulaci podílejí:
1) Negativní zpětná vazba
2) Pozitivní zpětná vazba
3) Cyklické změny
Negativní zpětná vazba
Je základním kontrolním mechanismem. Změna vyvolaná hormonem v cílové tkáni je monitorována (tzv. kontrolní proměnná) a zpětně inhibuje sekreci hormonu.
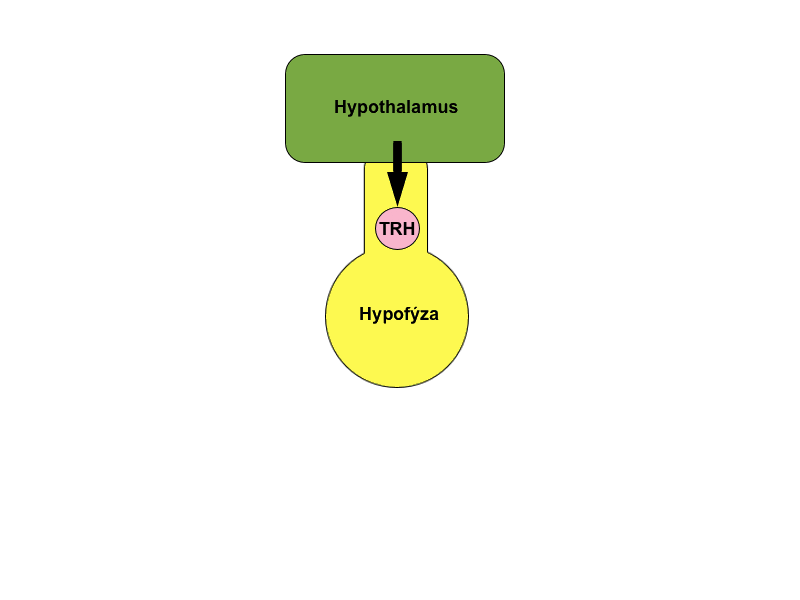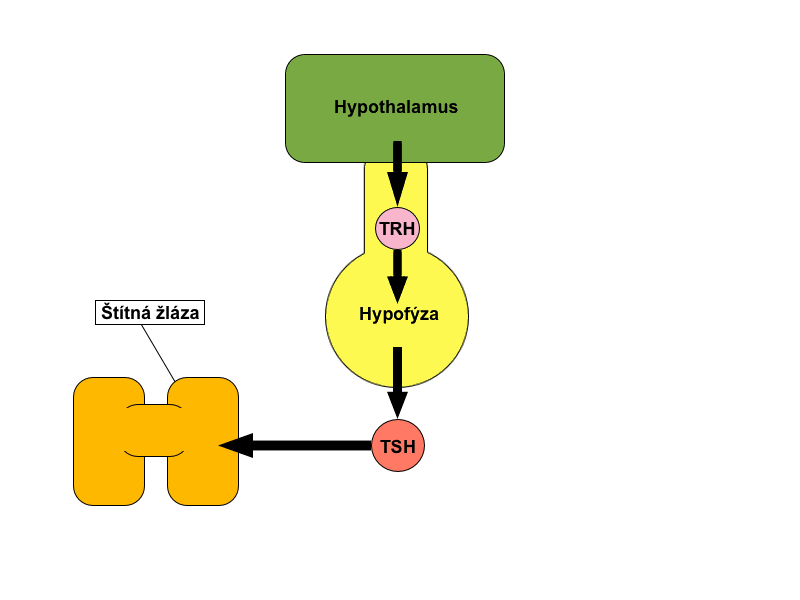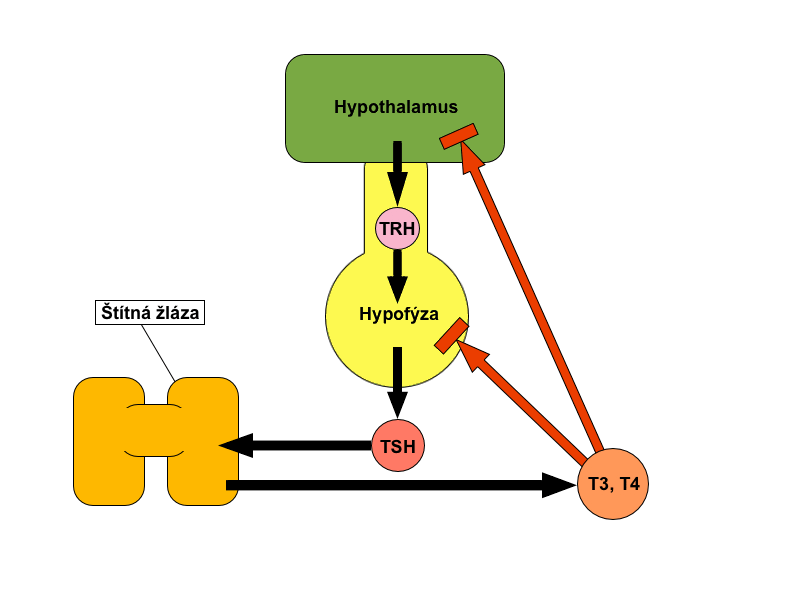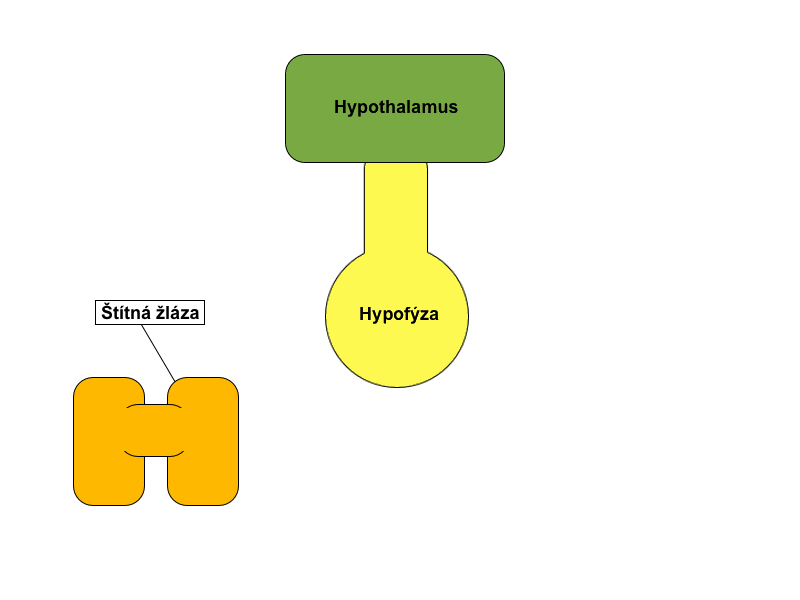
Takto například pokles glykemie inhibuje postprandiální sekreci insulinu nebo dosažení dostatečné plazmatické koncentrace kortizolu a kortikosteronu inhibuje sekreci adrenokortikotropního hormonu (ACTH) z adenohypofýzy. Na stejném principu funguje i kontrola tvorby hormonů štítné žlázy – hypotalamický TRH (thyreotropin releasing hormone) podněcuje sekreci hypofyzárního TSH (thyreotropní hormon), který stimuluje buňky štítné žlázy k produkci tyroxinu a trijodthyroninu. Tyto hormony následně zpětnou vazbou tlumí sekreci jak TSH, tak i TRH.
Na těchto příkladech vidíme, že kontrolní proměnou je často ta, která je sama regulována. Tím se zabráňuje hypersekreci hormonu, neboť jeho uvolňování je při dosažení cílové úrovně kontrolní proměnné okamžitě utlumeno na udržovací hladinu. Tento jev se nazývá jednoduchá zpětná vazba.
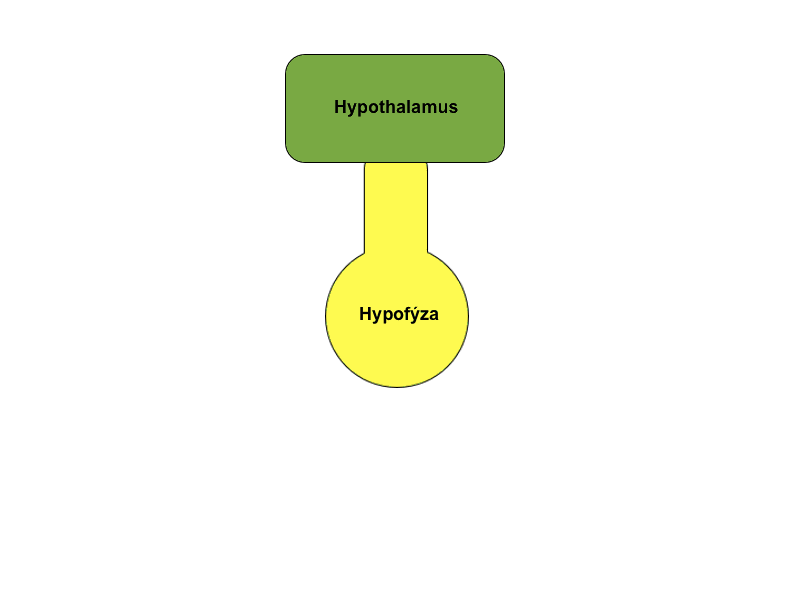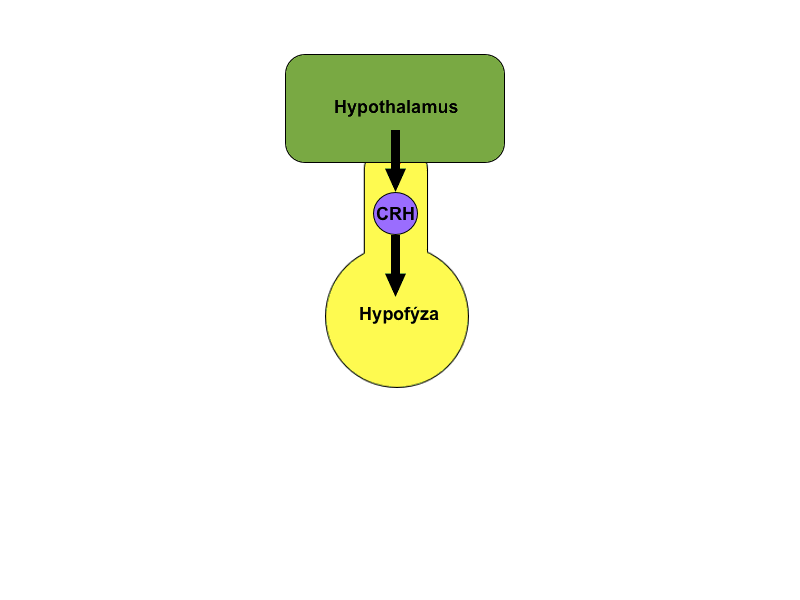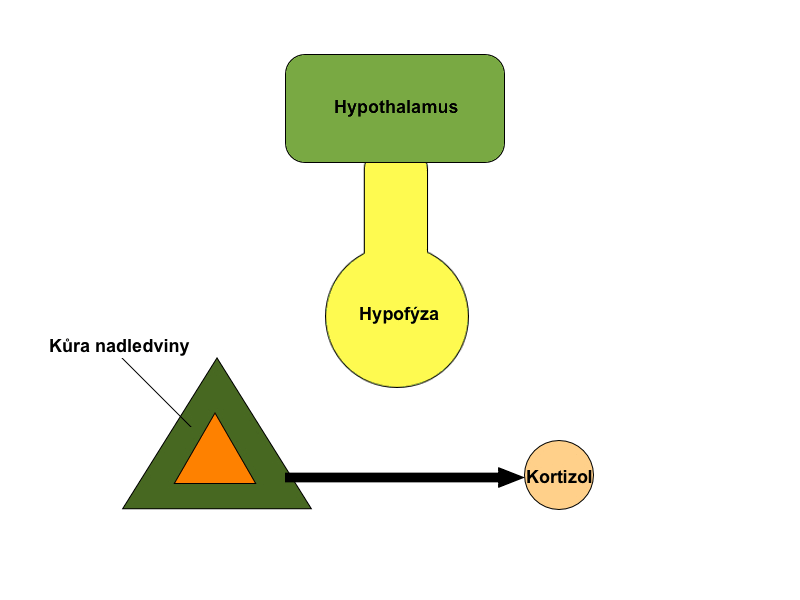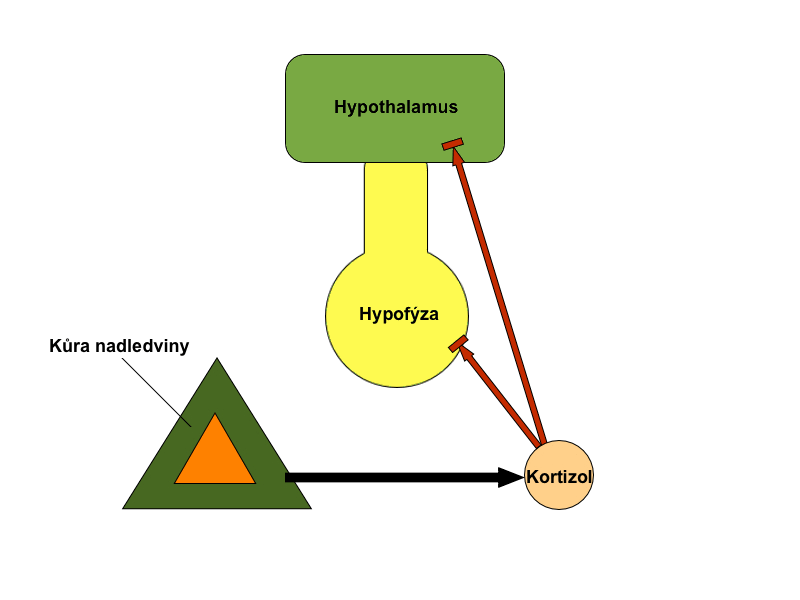
Další variantou je monitorovat nikoli samotnou regulovanou funkci, ale až důsledky její změny. Jako příklad lze uvést hypotalamické hormony – liberiny a statiny. Ty vyvolávají změny v sekreci glandotropních hypofyzárních hormonů a jsou zpětnovazebně inhibovány až produkty konečné žlázy. Vhodným příkladem je kortikoliberin (CRH), hormon, který stimuluje kortikotropy adenohypofýzy k produkci ACTH. CRH je zpětnovazebně inhibován zvýšenou hladinou kortizolu a kortikosteronu v krvi. Tento vztah je pouze podtypem jednoduché zpětné vazby.
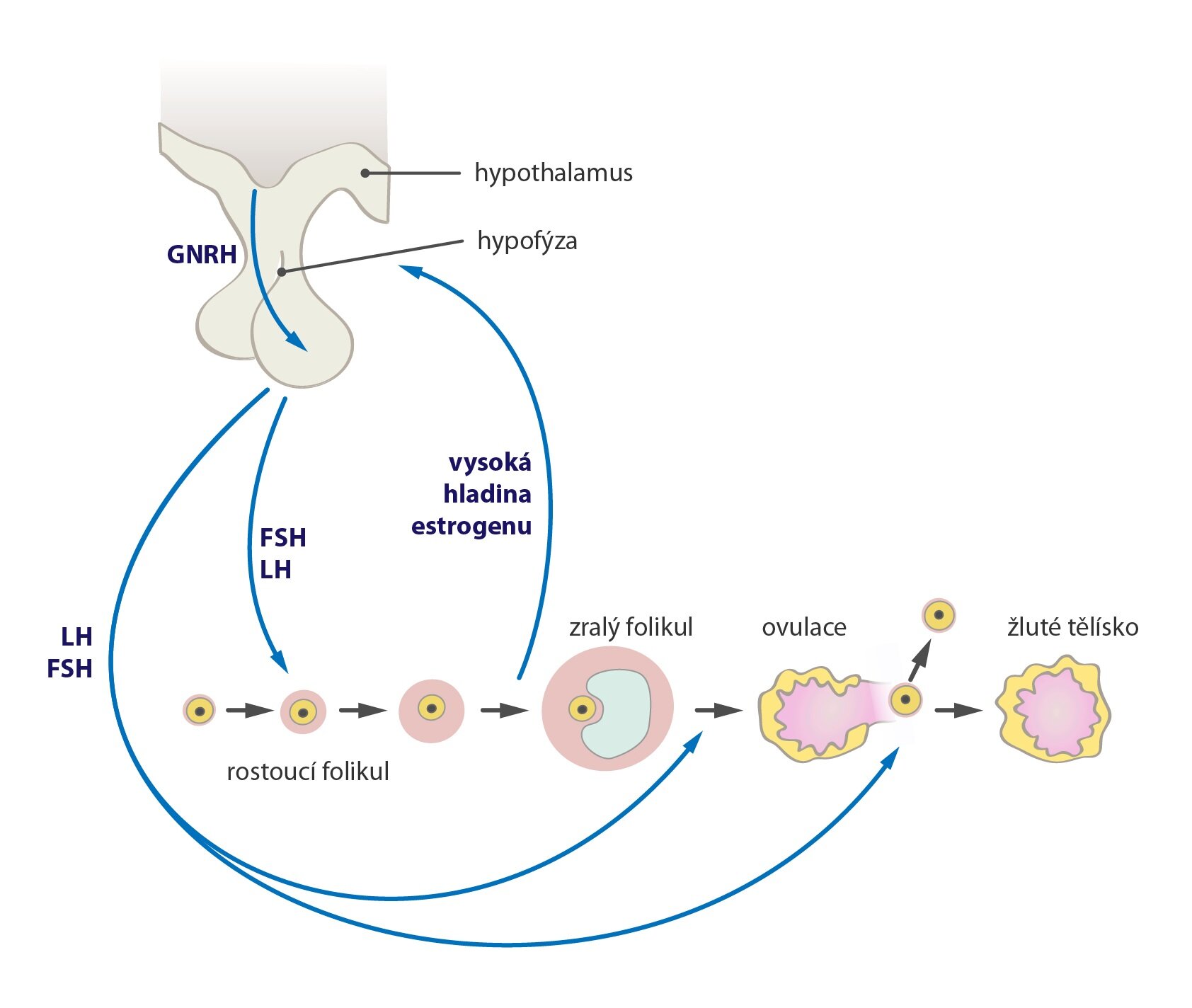
Pozitivní zpětná vazba
Je zvláštním kontrolním mechanismem, ve kterém dochází k cyklu změn, kdy každá potencuje následující, až se dosáhne úrovně vedoucí ke kvalitativní změně systému. Kontrolní proměnná zde neinhibuje produkci hormonu, ale naopak ji ještě dále potencuje.
Klasický příklad představuje ovulace, při níž luteinizační hormon gonadotropů adenohypofýzy stimuluje produkci estrogenů v ováriích. Ty opět stimulují produkci luteinizačního hormonu, než je dosaženo kritické koncentrace, která směřuje k prasknutí folikulu a uvolnění oocytu (kvalitativní změna systému).
Uvažovat lze i porod, kde podobnou vazbu vidíme mezi stahy dělohy a vyplavováním oxytocinu. Zvýšení frekvence a síly stahů dělohy na konci těhotenství stimuluje vyplavování oxytocinu a ten zase ovlivňuje frekvenci a sílu stahů. Nakonec dochází ke kvalitativní změně – narození dítěte.
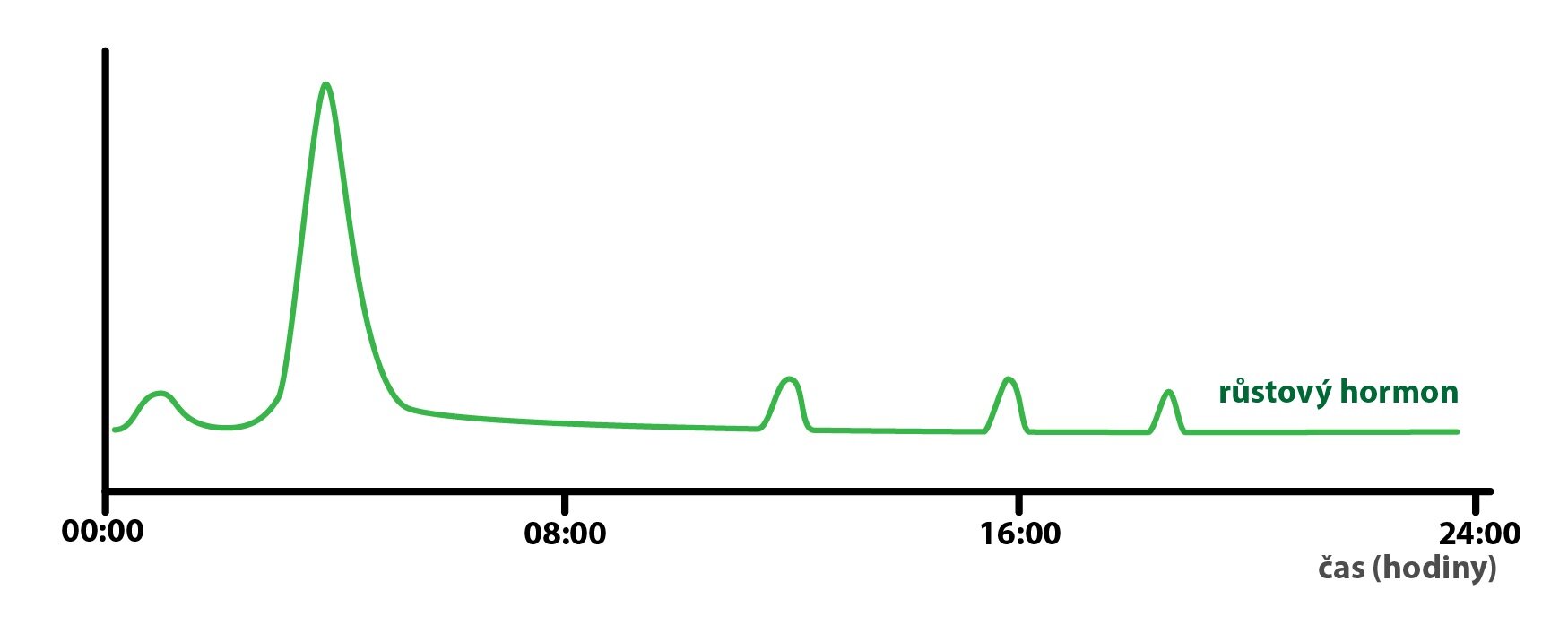
Cyklické změny
Na výše zmíněné regulace navazují i další vlivy, které lze shrnout jako tzv. „cyklické změny sekrece hormonů”. Můžeme zde zahrnout vliv spánku, střídání ročních období i náš vývoj a stárnutí. Tyto změny jsou obvykle podloženy změnami aktivity drah centrálního nervového systému, jež se mění v průběhu denní doby, cyklu spánek/bdění a během roku.
Dobrým příkladem je sekrece růstového hormonu, která dosahuje svého maxima během časných fází spánku, ale během jeho průběhu se opět vrací na udržovací hladinu.
_
Mechanismus účinku hormonů
Aby hormon dosáhl svého specifického účinku, je nutná přítomnost receptorů na buňkách cílové tkáně. Právě přítomnost nebo absence specifických receptorů odpovídají za to, že účinek hormonu je cílený. Pokud buňka neexprimuje příslušný receptor, nedokáže reagovat na přítomnost hormonu ani za nefyziologicky vysokých koncentrací. Pokud je naopak nositelem příslušného receptoru, specificky zareaguje i na velmi nízkou koncentraci.
To, kde je receptor umístěn, závisí na charakteru hormonu. Rozlišujeme tři typy receptorů:
1) Membránové receptory
2) Cytoplazmatické receptory
3) Jaderné receptory
Membránové receptory
Jsou to nejčastěji proteiny zavzaté do cytoplazmatické membrány, které nesou vazebná místa pro proteiny, peptidy nebo katecholaminy. Pokud se podíváme na povrch jakékoliv buňky, uvidíme desetitisíce receptorů pro řadu různých působků, jež díky fluidnímu charakteru membrány „plavou” ve fosfolipidové dvojvrstvě.
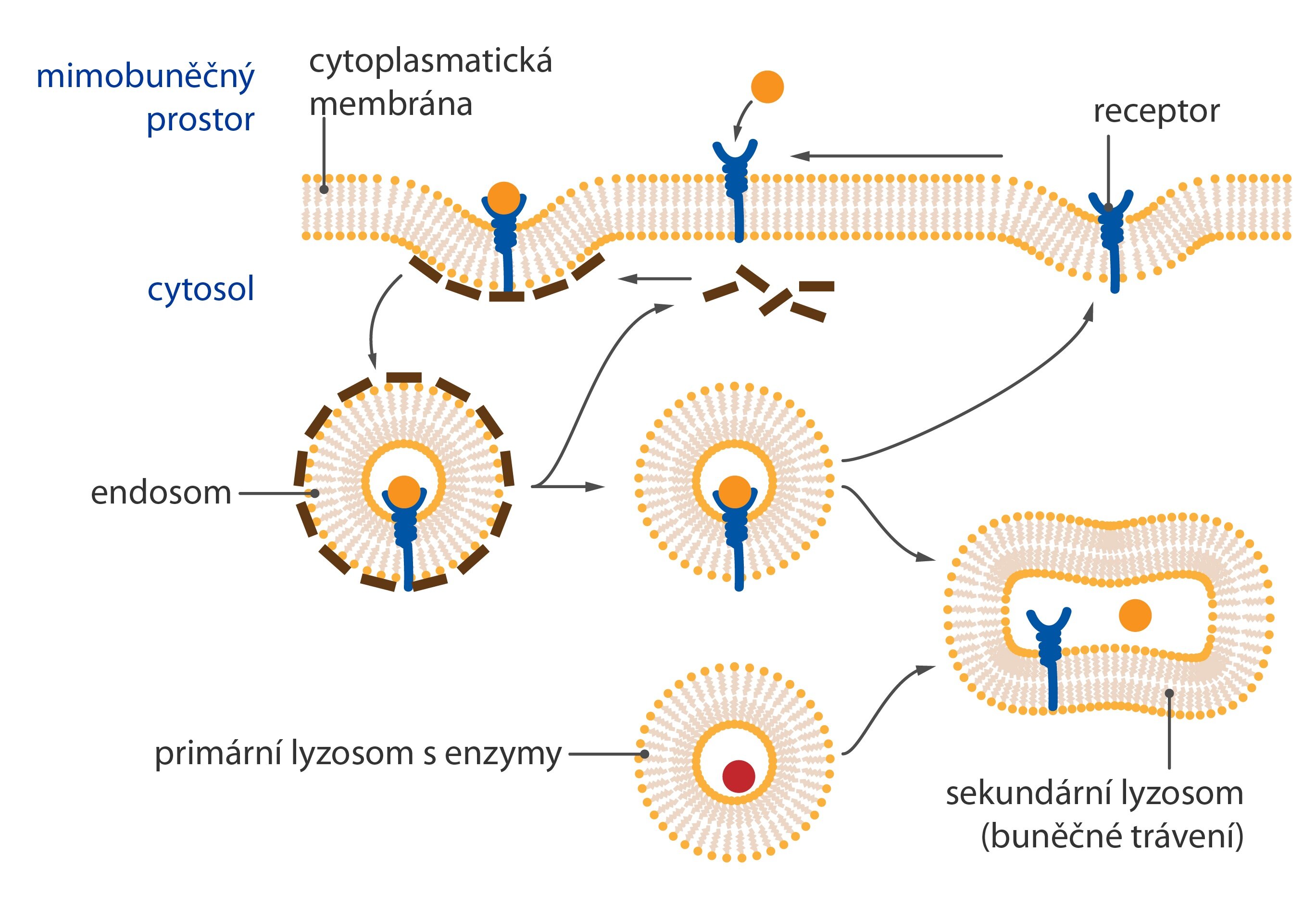
Jejich počet navíc není konstantní. Kdybychom membránu pozorovali déle, uvidíme, jak se dynamicky mění zastoupení jednotlivých typů receptorů i jejich počet doslova z minuty na minutu dle aktuálních potřeb organismu.
Jakmile totiž vznikne komplex hormon-receptor, je stažen z intersticiálního povrchu cytoplazmatické membrány do cytoplazmy ve vakuole (čili internalizován). Zde je receptor v závislosti na svém typu buď reaktivován (molekula hormonu je tedy odstraněna z aktivního místa a zničena), nebo vakuola fúzuje s lyzosomem (působením jeho enzymů je zničen celý komplex a vytvořen nový receptor).
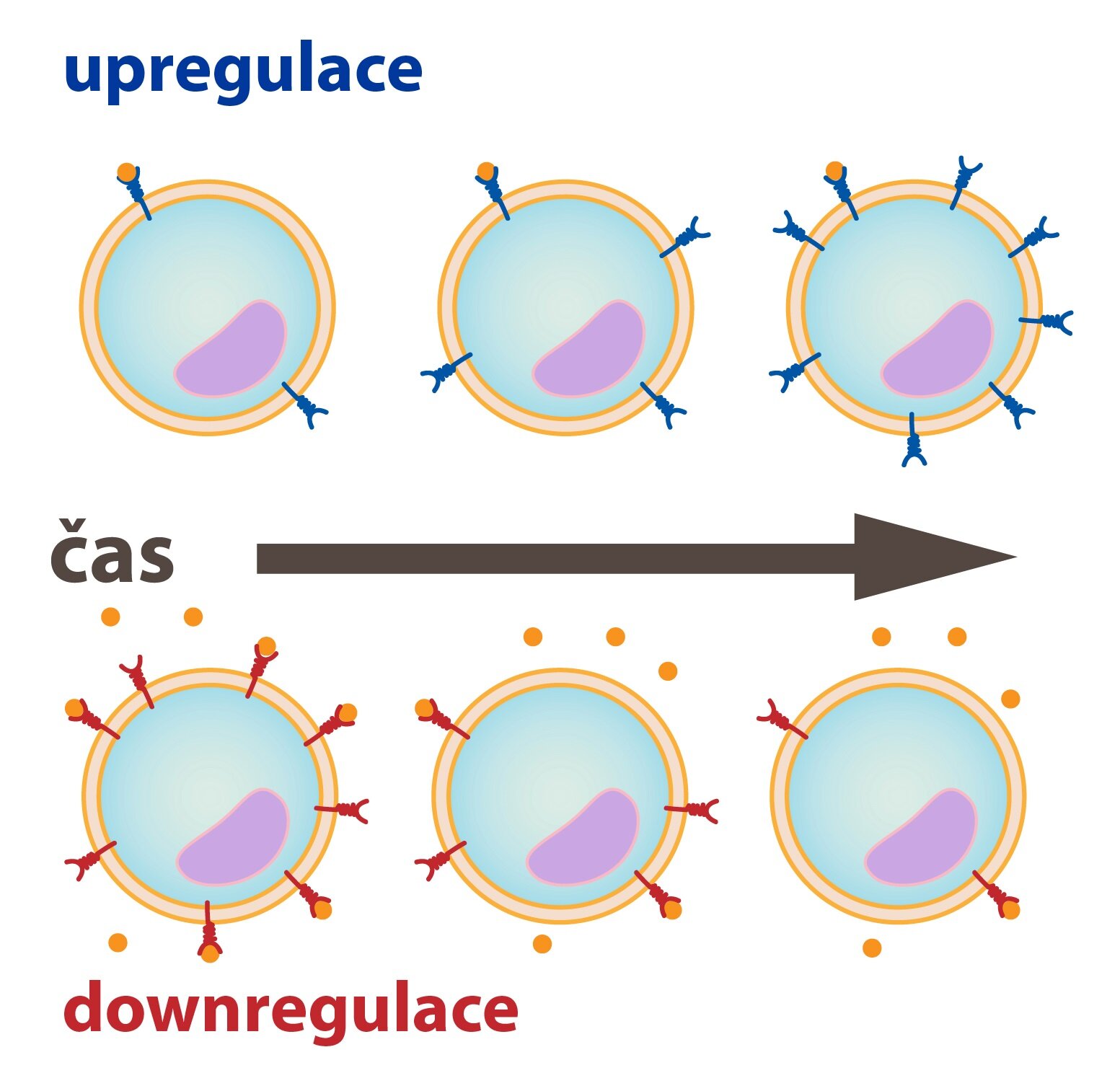
Díky vlastnímu autonomnímu dohledu nad metabolismem receptorů může buňka zasahovat do samotné endokrinní regulace, a to dvěma způsoby na základě počtu vystavených receptorů:
1) Up – regulace
2) Down – regulace
Up – regulace
Pokud se dlouhodobě sníží koncentrace hormonu v určité tkáni, která je na něj citlivá, jsou její buňky schopny syntetizovat více receptorů a vystavit je na své membráně. Dojde tak ke zvýšení denzity receptorů a tím senzitivizaci buňky. Díky většímu množství receptorů na membráně pak stačí dosažení i nižší plazmatické koncentrace hormonu pro adekvátní reakci.
Down – regulace
Jde o fenomén, který nastává při dlouhodobě zvýšené koncentraci hormonů ve tkáni. Buňky pak v závislosti na typu receptoru inaktivují buď samotné receptory (internalizace nepoužitých receptorů) nebo intracelulární kaskády, které na ně navazují. Další možností je jednoduché snížení produkce.
Intracelulární signalizace membránového receptoru
Signál z aktivovaného membránového receptoru je přepojen do intracelulární signální dráhy. Ta plní několik funkcí:
1) Amplifikuje signál, takže postupným přepojováním na více a více signálních molekul může i pouhých několik molekul hormonu vyvolat významnou změnu funkce
2) Diverguje signál na několik cílových míst, a tak jeden aktivovaný receptor může ovlivnit několik funkcí cílové buňky
3) Konverguje signály, a proto i dva nedostatečně silné signály mohou vyvolat změnu koncentrace určité signální molekuly dostatečnou pro vyvolání specifického účinku
Přepojení receptoru na intracelulární signalizační dráhu je obecně trojí:
1) Spřažení s iontovým kanálem
2) Spřažení s G-proteinem
3) Spřažení s enzymem
1) Spřažení s iontovým kanálem
Mnohem častěji se vyskytuje u neurotransmise než u endokrinní signalizace. Pokud je receptor spřažen s iontovým kanálem, je obvykle jeho aktivací docíleno změny membránového potenciálu cílové buňky. Otevřený kanál totiž umožní migraci náboje napříč membránou. Tato změna je okamžitá a vede k aktivacím dalších kanálů, které jsou otevírány napětím (tzv. voltage-gated). Aktivitou kanálů – jak těch spřažených s receptory, tak oněch otevřených následně změnou potenciálu – mění buňka permeabilitu své membrány, a především se mění iontové složení v jejím nejbližším okolí.
Iont, který hraje hlavní roli v samotné intracelulární signalizaci, je Ca2+. Samotné ionizované kalcium, respektive nárůst jeho koncentrace, totiž spouští vlastní kalcium-kalmodulinový systém.
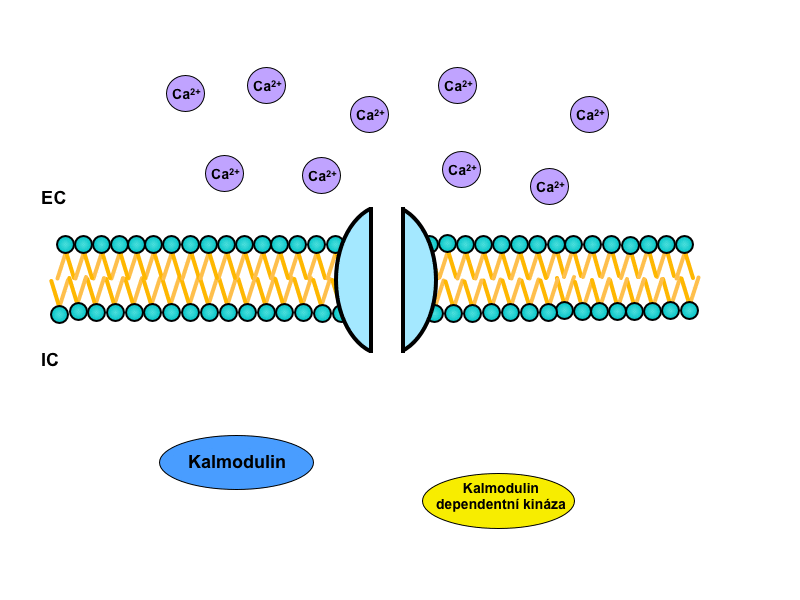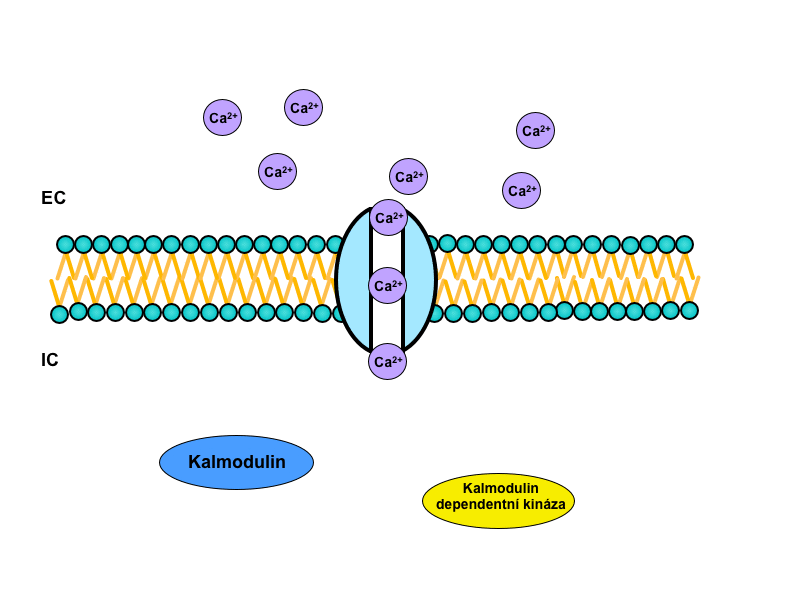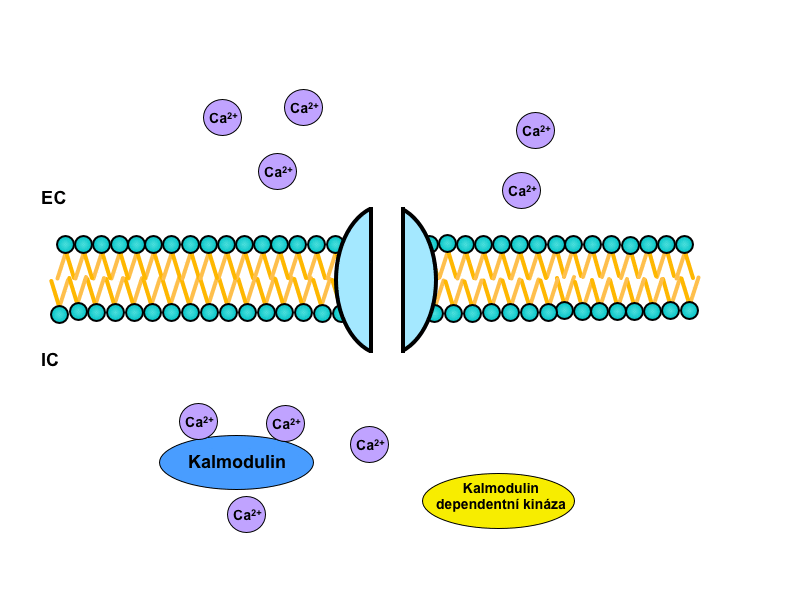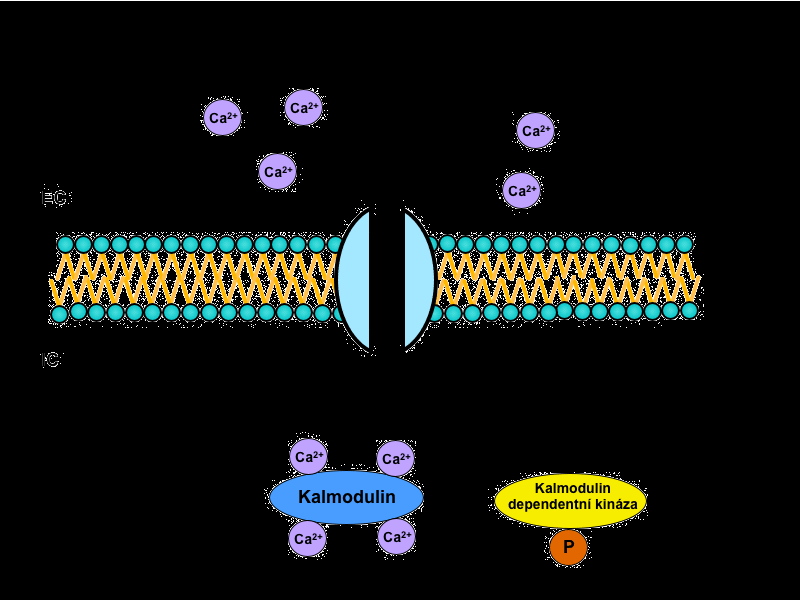
V tomto systému sehrává centrální úlohu cytoplazmatický protein kalmodulin. Ten nese čtyři vazebná místa pro Ca2+, a pokud jsou alespoň tři z nich zaplněna, změní svou konformaci a váže se na tzv. kalmodulin dependentní protein kinázy. Ty pak spouští signalizační kaskádu opakujících se fosforylací dalších a dalších kináz, kterým je tak měněna enzymatická aktivita. Nakonec – po mnoha přepojeních v intracelulární kaskádě – dojde k ovlivnění specifických funkcí cílové tkáně.
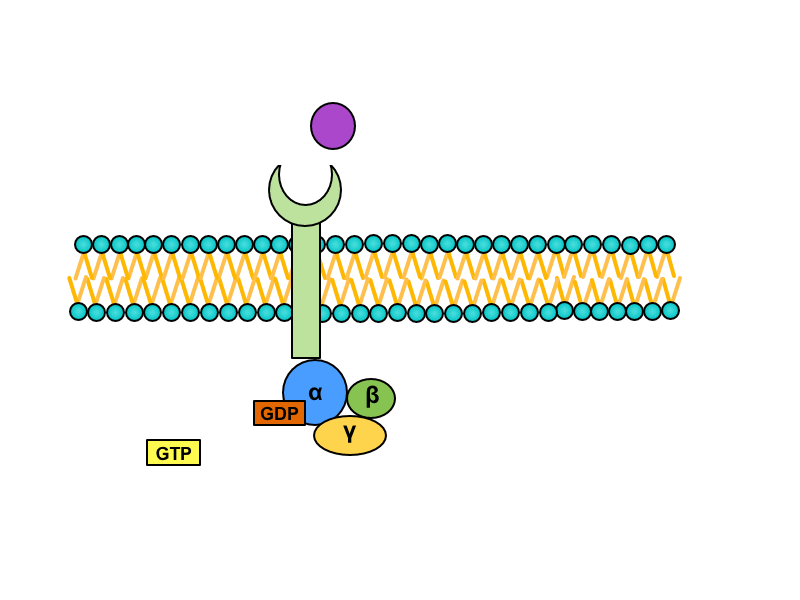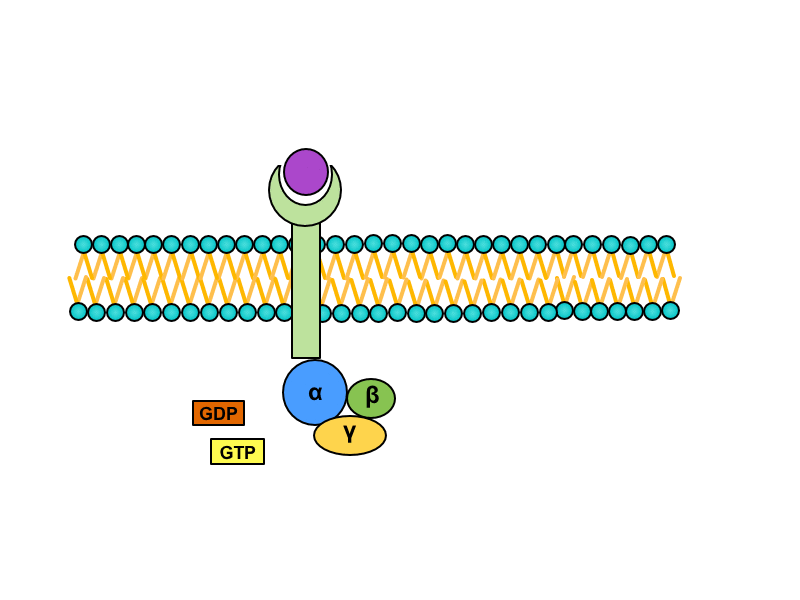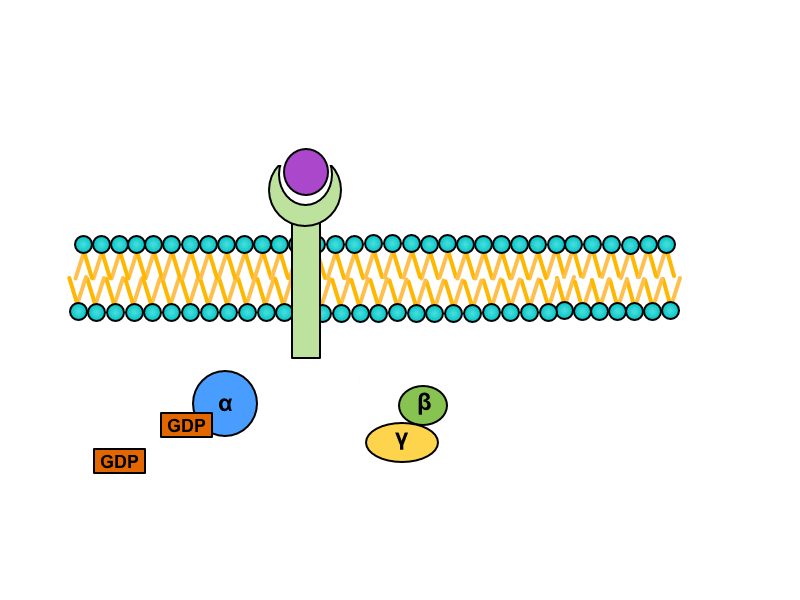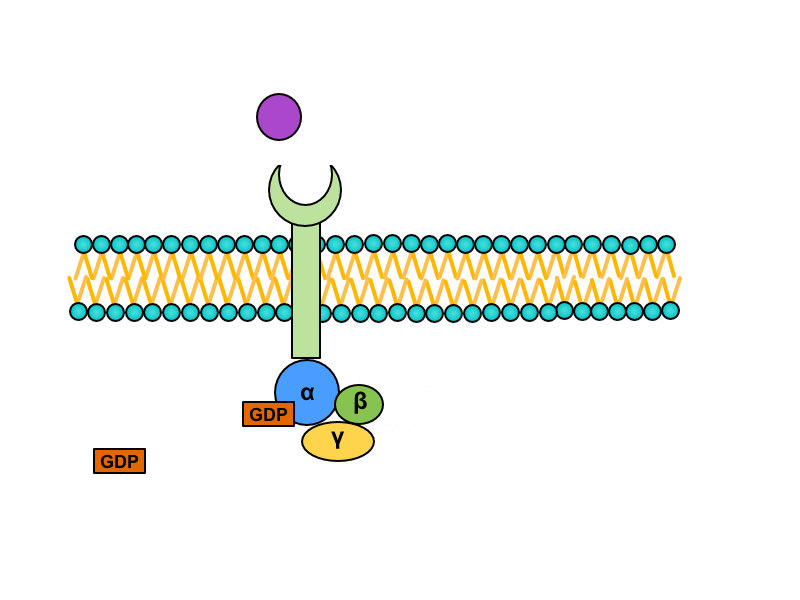
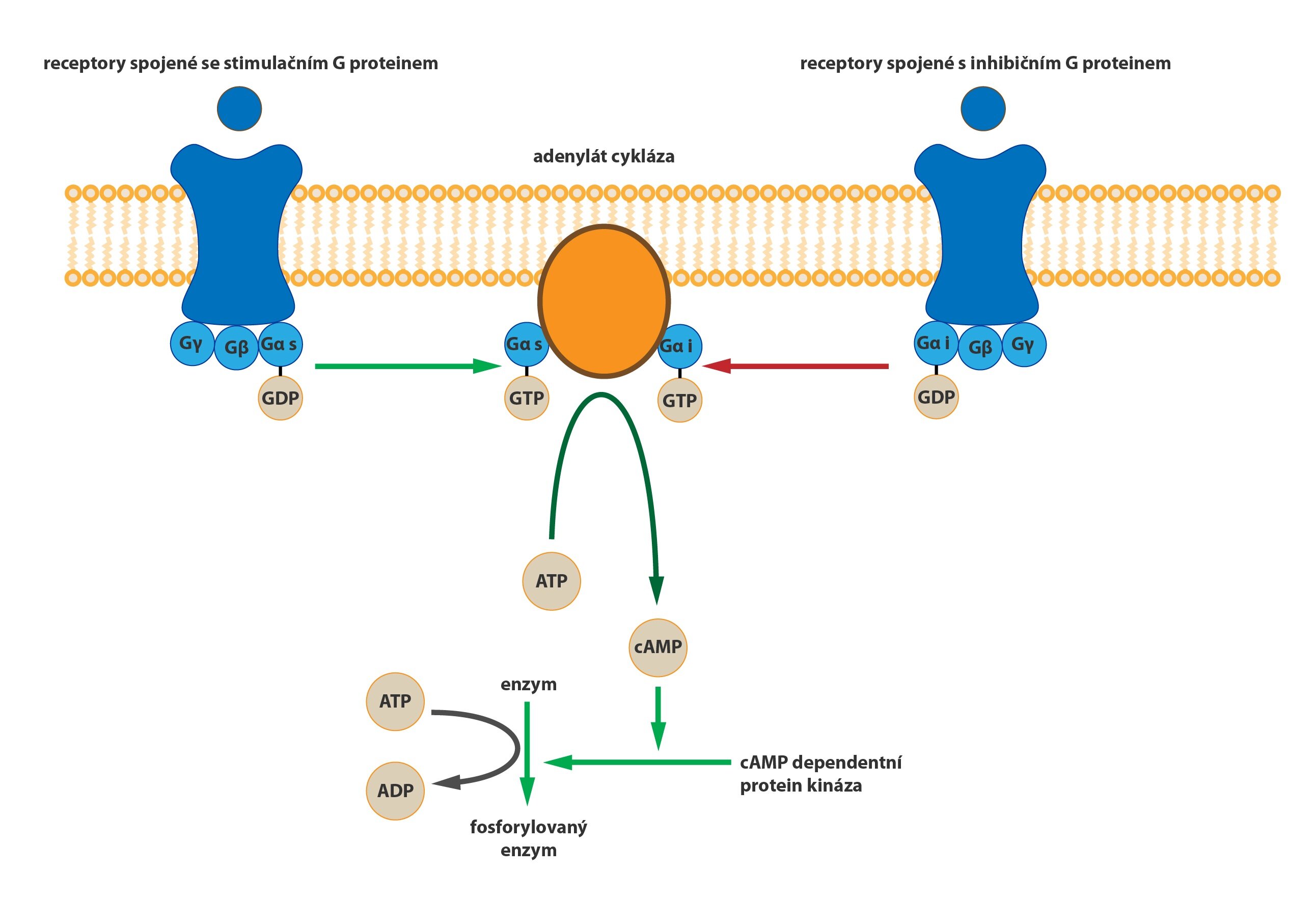
2) Spřažení s G-proteinem
Serpentinové receptory, jejichž transmembránová doména prochází sedmkrát membránou, jsou spřaženy s tzv. G-proteinem. Jedná se o heterotrimerní GTP-vázající protein, který je v inaktivním stavu asociován s receptorem a složen z podjednotek alfa, beta a gama. Na jednotce alfa je vázáno GDP. Při aktivaci serpentinového receptoru dochází ke konformační změně G-proteinu, z jednotky alfa se uvolní GDP a naváže se GTP. Tato změna vede k disociaci heterotrimeru. Výsledkem aktivace receptoru (respektive následné disociace) je monomer alfa a heterodimer beta-gama. Oba produkty difundují podél membrány a spojují se s enzymy, které pro ně nesou vazebná místa (obvykle pro alfa podjednotku).
Dle cílového místa rozeznáváme tři třídy G-proteinů:
a) Gs-protein: aktivuje adenylátcyklázu, čímž dojde k nárůstu koncentrace cAMP. Tento jev mění aktivitu cAMP-dependentních protein kináz (v závislosti na kináze ji může jak aktivovat, tak inaktivovat), a spouští tak složitou signalizační kaskádu.
b) Gi-protein: inaktivuje adenylátcyklázu, což vede k postupnému snížení koncentrace cAMP v cílové buňce.
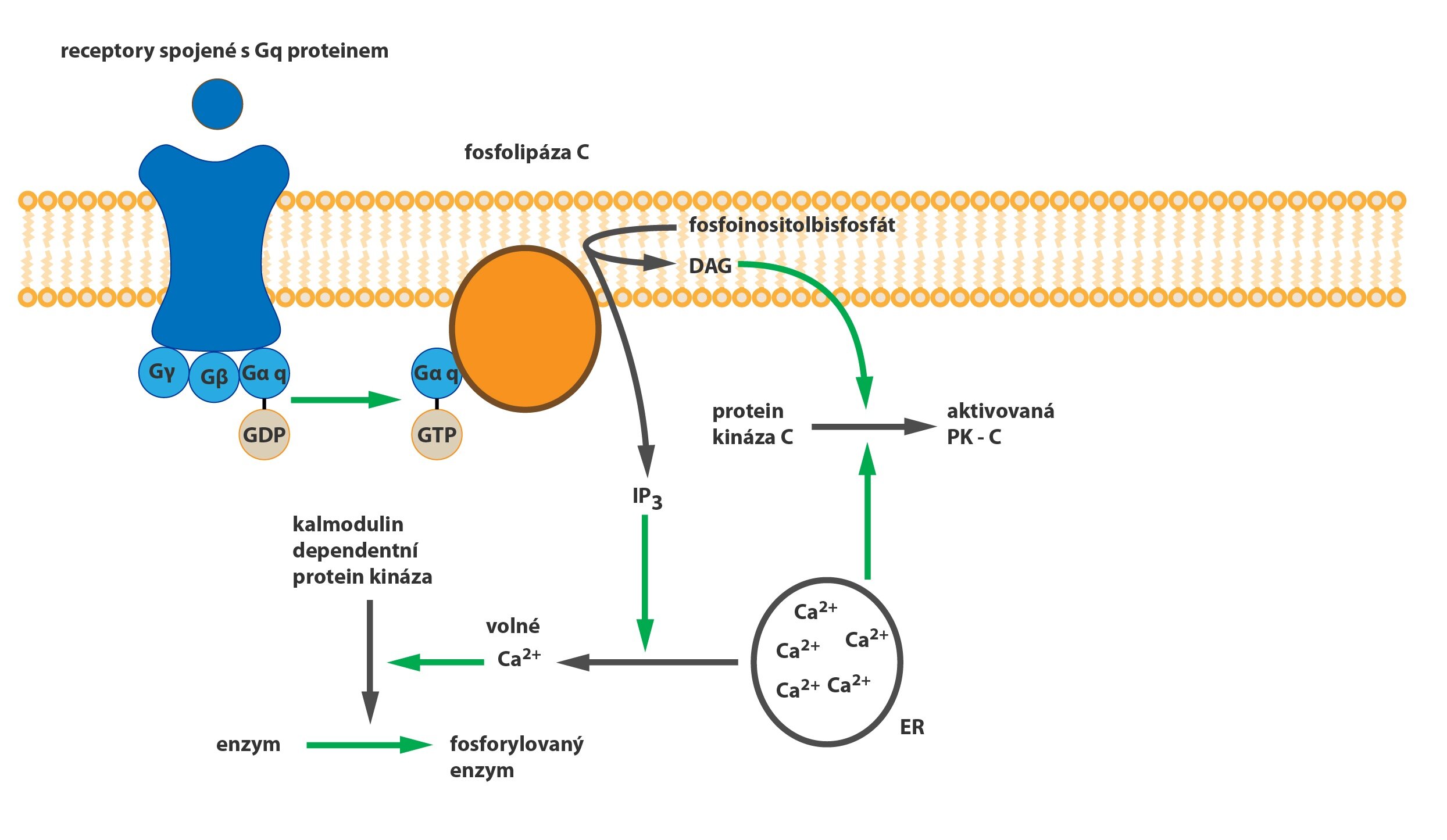
c) Gq-protein: působí na fosfolipázu C (PLC). Ta pak přeměňuje fosfatidylinositol bisfosfát (PIP2) přítomný v cytoplazmatické membráně na inositol trifosfát (IP3) a diacylglycerol (DAG). IP3 mobilizuje zásoby ionizovaného kalcia z endoplazmatického retikula (a částečně z mitochondrií), které pak spouští kalcium-kalmodulinovou kaskádu. DAG v cytoplazmě spolu s kalciem aktivuje proteinkinázu C (PKC), což vede k aktivaci další kaskády kináz.
Inaktivace G-proteinu
Podjednotka alfa má GTPázovou aktivitu, takže po určitém časovém intervalu dojde k rozštěpení GTP na GDP a anorganický fosfát. Tato změna směřuje k reasociaci monomeru alfa a heterodimeru beta-gama do původního trimeru spřaženého s receptorem.
3) Spřažení s enzymem
Některé membránové receptory jsou spřaženy s enzymem, a to buď ve formě asociované molekuly enzymu aktivované spolu s receptorem, nebo vykazují vlastní enzymatickou aktivitu.
Pokud je receptor sám enzymaticky aktivní, jedná se často o kinázu, jež fosforyluje další molekuly receptoru. Celý proces probíhá tak, že aktivované hormon-receptor komplexy homodimerizují a vzájemně si fosforylují některé aminokyseliny (nejčastěji tyrosin nebo serin). Tím vzniknou na cytoplazmatických doménách receptorů vazebná místa pro další enzymaticky aktivní proteiny a dochází ke spuštění signalizační kaskády (opět řada fosforylací a defosforylací).
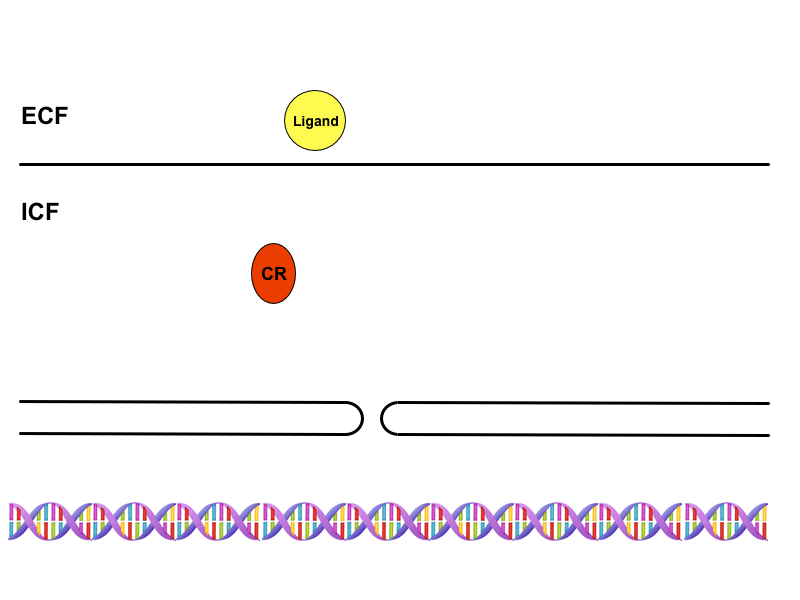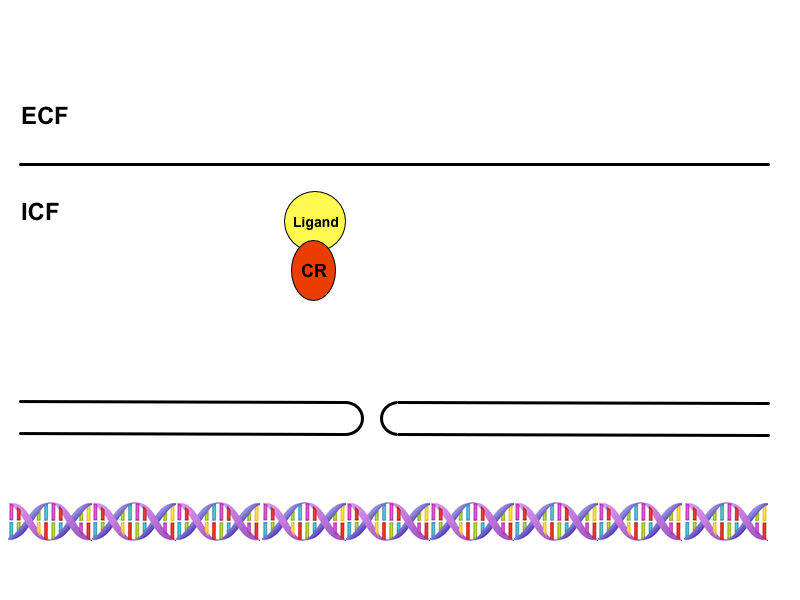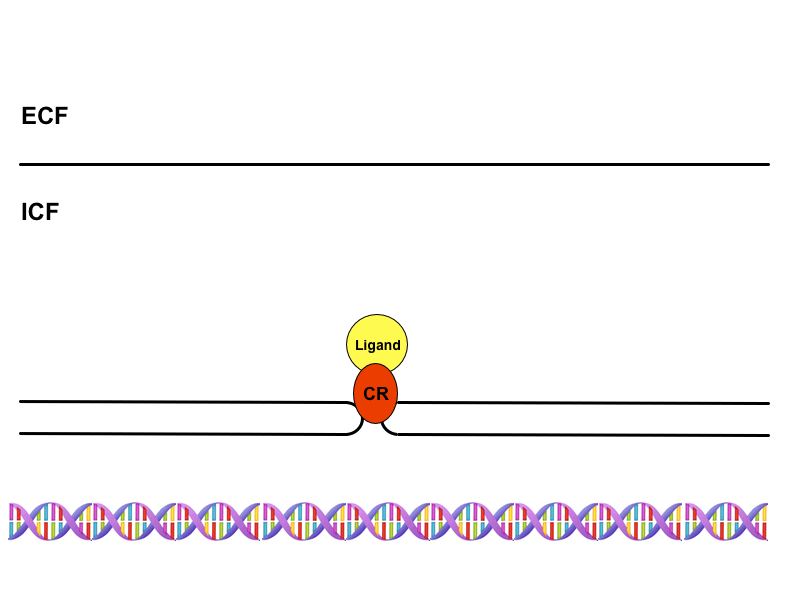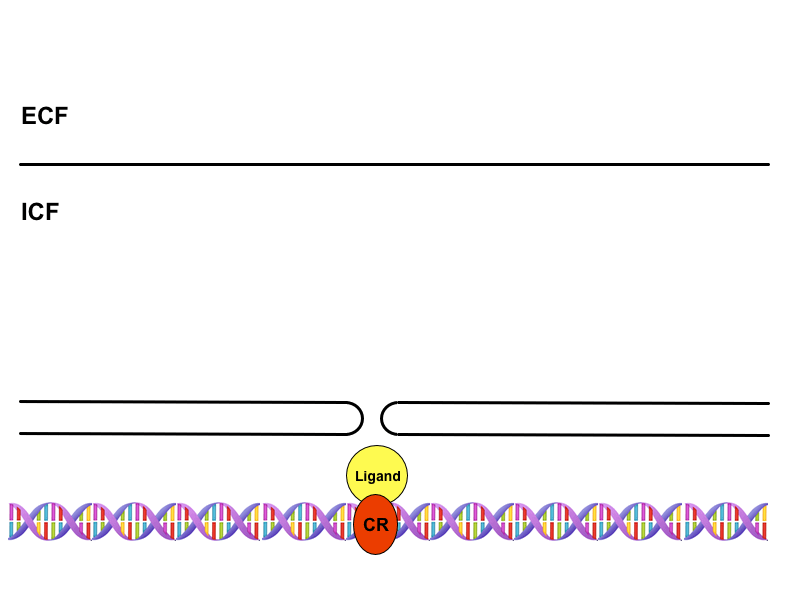
Cytoplazmatické receptory
Jde o receptory přítomné v cytoplazmě buněk citlivých na steroidní hormony, které díky své lipofilitě procházejí membránou. Hormon-receptorový komplex zde funguje jako transkripční faktor, který je rozpoznán přenašečem v pórech jaderné obálky a transportován do jádra. Na DNA se pak váže na tzv. HRE oblasti (hormon-responding element), jež nejsou ničím jiným než promotorovými sekvencemi. Tímto mechanismem dojde ke změně exprese genů, tedy k aktivaci nebo inaktivaci jejich transkripce a v konečném důsledku k alteraci buněčných funkcí nebo ke vzniku funkcí úplně nových.
Jaderné receptory
Jsou funkčně velmi podobné receptorům cytoplazmatickým. Rozdíl spočívá v tom, že se již nacházejí preformované v jádře, a není proto zapotřebí transportu aktivovaného receptoru jaderným přenašečem. Tyto receptory tvoří komplexy s thyreoidálními hormony. Navázáním na HRE oblast jaderné DNA mění expresi nejrůznějších genů.
_
Poruchy funkce žláz s vnitřní sekrecí
Poruchy funkce žláz s vnitřní sekrecí se podle množství produkovaného hormonu dělí na:
1) Hypofunkce žlázy – snížení produkce hormonu
2) Hyperfunkce žlázy – zvýšení produkce hormonu
1) Hypofunkce žlázy
Snížení produkce hormonu může mít mnoho příčin. Mezi ty nejčastější patří:
a) Zánět (často autoimunitní)
b) Poruchy vývoje žlázy
c) Poruchy prokrvení žlázy
d) Porucha enzymů syntetizujících daný hormon
2) Hyperfunkce žlázy
Mezi nejčastější příčiny hyperfunkce žlázy patří:
a) Hyperplazie či nádor produkující daný hormon (buď přímo v žláze, či mimo ni – ektopicky)
b) Zvýšená stimulace z nadřazené žlázy
c) Přítomnost stimulujících protilátek
Podle místa vzniku se dají poruchy rozdělit na:
1) Primární (periferní) poruchy – při postižení periferní žlázy
2) Sekundární (centrální) poruchy – při postižení nadřazené žlázy
Autoři podkapitoly: Patrik Maďa a Josef Fontana