Náplň podkapitoly:
1. Základní termíny energetického metabolismu
2. Energetický metabolismus
3. Postavení orgánů v energetickém metabolismu
_
Základní termíny energetického metabolismu
Metabolismus (z řeckého metabolē – změna) neboli látková výměna, je souborem všech chemických reakcí probíhajících v organismu. Dochází při nich k přeměně živin, ve většině případů enzymaticky katalyzované a regulované.
Chemické reakce metabolismu jsou často řazeny do metabolických drah, ve kterých je jedna látka sérií reakcí proměněna na látku jinou. Součástí těchto drah mohou být různé meziprodukty – intermediáty. Jedna látka může být počátečním substrátem pro různé metabolické dráhy.
Například pyruvát může být přeměněn na laktát, nebo z něj může vznikat aminokyselina alanin, může se podílet na tvorbě glukózy v procesu glukoneogeneze, anebo se přemění na acetyl-CoA a slouží jako zdroj energie.
Tato vzájemná přeměna živin s různými meziprodukty se pak označuje jako intermediární metabolismus.
Metabolické reakce můžeme obecně rozdělit na reakce anabolické a katabolické.
1) Reakce anabolické (z řec. aná – nahoru)
Jsou to reakce syntetické, skladné, při kterých vznikají z látek jednodušších látky složitější. Vyžaduje se pro ně energie, která se v jejich průběhu spotřebovává – jedná se o reakce endergonní.
Mezi zástupce anabolických metabolických drah patří glukoneogeneze, syntéza glykogenu, MK, TAG (lipogeneze), aminokyselin, proteinů, ketolátek, tvorba močoviny a jiné.
2) Reakce katabolické (z řec. katá – dolů)
Jde o reakce štěpné, degradační neboli rozkladné, při kterých se složitější látky štěpí na jednodušší. Dochází k uvolnění energie využitelné pro tvorbu makroergních sloučenin.
Katabolickými metabolickými drahami jsou například glykolýza, glykogenolýza, lipolýza, beta-oxidace, odbourávání ketolátek, degradace proteinů a aminokyselin.
Některé sledy reakcí mají současně charakter drah anabolických i katabolických, proto je označujeme jako amfibolické (řec. amfi – na obě strany).
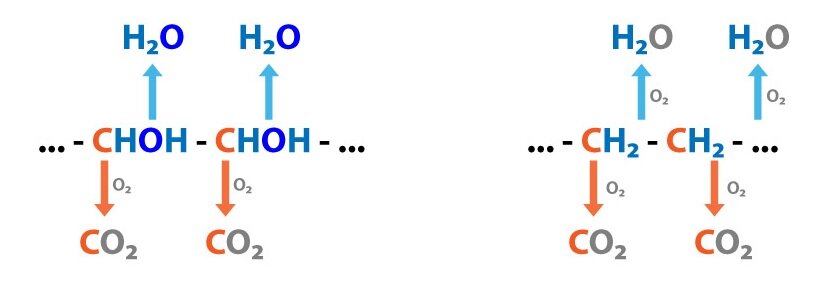
Jako příklad si můžeme uvést citrátový cyklus, ve kterém se dokončuje oxidace uhlíkaté kostry všech živin (dráha katabolická) a jehož intermediáty zároveň slouží jako substráty pro dráhy anabolické (např. z alfa-ketoglutarátu se tvoří glutamát, ze sukcinyl-CoA hem nebo z citrátu mastné kyseliny).
Reakce anaplerotické (řec. aná – nahoru a plerotikos – naplnit) slouží k doplnění meziproduktů metabolických drah.
V citrátovém cyklu tyto reakce doplňují zejména oxalacetát (z glukózy, laktátu nebo glukogenních aminokyselin) a alfa-ketoglutarát (z glutamátu).
_
Energetický metabolismus
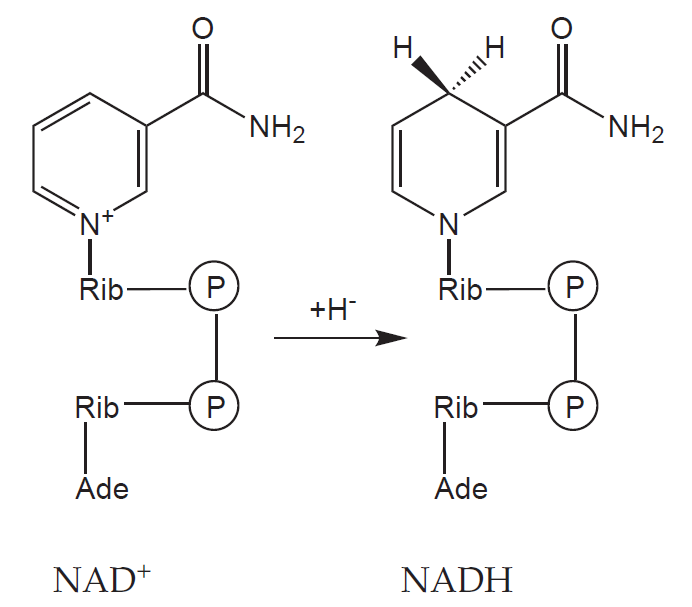
Pro život je bezpodmínečně nutná kontinuální regenerace makroergních sloučenin sloužících jako zdroj volné energie pro průběh endergonních reakcí. Jejich tvorba začíná katabolismem vysokomolekulárních látek, jejichž fragmenty jsou pak proměněny na základní meziprodukty (jako acetyl-CoA). Ty jsou dále (při aerobním metabolismu) zoxidovány v citrátovém cyklu a vzniklé redukované koenzymy (NADH + H+ a FADH2) jsou využity v dýchacím řetězci k tvorbě ATP.
ATP
ATP, hlavní a univerzální makroergní sloučenina, zajišťuje částečně uskladnění, a zejména přenos volné energie (G) v buňce. Přestože existují makroergní sloučeniny schopné štěpením uvolnit větší množství energie, využívá se ATP nejvíce. Podílí se na tom relativní stabilita anhydridové vazby, která odolává spontánní hydrolýze (na rozdíl od ostatních anhydridů) a štěpí se jen v přítomnosti enzymů.
K regeneraci ATP je pak možné využít látek s negativnějšími hodnotami G (např. fosfoenolpyruvát, kreatinfosfát, 1,3-bisfosfoglycerát,…).
ATP může v buňce vznikat dvěma způsoby:
1) Fosforylace na substrátové úrovni
2) Aerobní fosforylace a dýchací řetězec
1) Fosforylace na substrátové úrovni
Jedná se o energetické spřažení exergonní reakce se syntézou ATP z ADP a Pi (anorganický fosfát). Nejčastěji jsou popisovány tři reakce: dvě jsou součástí glykolýzy (přeměna fosfoenolpyruvátu na pyruvát a 1,3-bisfosfoglycerátu na 3-fosfoglycerát), jedna je součástí Krebsova cyklu (přeměna sukcinyl-CoA na sukcinát).
2) Aerobní fosforylace a dýchací řetězec
O tomto způsobu tvorby ATP blíže viz: Podkapitola 2/7.
Uvolnění energie z ATP (hydrolýza ATP) probíhá v několika krocích:
ATP → ADP + Pi (ΔG = – 30,5 kJ/mol)
V ADP se nachází ještě jedna makroergní vazba, která může být využita. Protože je ale použití ADP místo ATP problematické kvůli substrátové specificitě enzymů, obvykle proběhne za katalýzy adenylát kinázou reakce:
2 ADP → ATP + AMP
a využívá se vytvořené ATP.
Z ATP se účinkem některých enzymů přímo uvolňuje difosfát (pyrofosfát, PPi):
ATP → AMP + PPi (ΔG = – 45,6 kJ/mol)
PPi je možné za uvolnění energie dále štěpit enzymem difosfatázou (pyrofosfatázou).
Jiné makroergní sloučeniny
1) Ostatní nukleosidtrifofáty
Ostatní nukleosidtrifofáty jsou méně univerzální a používají se pro specifické účely. Např. UTP slouží k aktivaci sacharidů pro vstup do metabolických drah.
2) Enolfosfáty
Enolfosfáty obsahují OH-skupinu estericky vázanou na fosfát. Nejdůležitější představitel, fosfoenolpyruvát (PEP), je makroergní sloučeninou s energeticky největším potenciálem ΔG (až – 61,9 kJ/mol). Proto je také reakce přeměny PEP na pyruvát nevratnou reakcí glykolýzy.
3) Acylfosfáty
Acylfosfáty obsahují anhydridovou vazbu COOH s fosfátem. Řadí se k nim karbamoylfosfát (využívaný při syntéze močoviny) nebo 1,3-bisfosfoglycerát (meziprodukt glykolýzy).
4) Další makroergní sloučeniny
Mezi další makroergní sloučeniny patří guanidinfosfáty (kreatinfosfát) nebo thioestery a thioétery (deriváty HS-CoA, SAM).
Někdy se můžeme setkat s pojmem nízkoenergetické fosfáty. Podle klasické definice je makroergní sloučenina taková, která dokáže po zániku vazby uvolnit energii minimálně 25 kJ/mol. Nízkoenergetické fosfáty, mezi něž patří například glukóza-6-fosfát, uvolňují energie méně – mezi 9 až 20 kJ/mol.
Hlavní meziprodukty energetického metabolismu
V buňkách existují metabolické dráhy – jakési křižovatky vzájemné přeměny živin. Patří sem pyruvátdehydrogenázová reakce (PDH), Krebsův cyklus (KC) a dýchací řetězec (DŘ). Tři meziprodukty : acetyl-CoA, pyruvát a NADH mají významné postavení energetickém metabolismu.
1) Acetyl-CoA
Tvorba:
a) PHD (pyruvátdehydrogenázová reakce) – nevratnost této reakce je příčinou toho, že z naprosté většiny mastných kyselin se nedá vytvořit glukóza
b) Degradace aminokyselin – přímo na acetyl-CoA se degraduje lysin a leucin, ostatní aminokyseliny se přeměňují skrze pyruvát
c) Beta-oxidace mastných kyselin a degradace ketolátek
Využití:
a) Krebsův cyklus a navazující dýchací řetězec (a tvorba ATP)
b) Syntéza mastných kyselin a ketolátek (při nadbytku acetyl-CoA)
c) Syntéza cholesterolu
2) Pyruvát
Tvorba:
a) Aerobní glykolýza
b) Oxidace laktátu (za katalýzy laktátdehydrogenázou)
c) Degradace některých AK
Využití:
a) Syntéza acetyl-CoA (PDH)
b) Syntéza laktátu – probíhá při anaerobní glykolýze, jejím účelem je regenerace redukovaných koenzymů NADH + H+ zpět na NAD+
c) Syntéza alaninu (za katalýzy alaninaminotranferázou)
d) Syntéza oxalacetátu (za katalýzy pyruvátkarboxylázou)
e) Glukoneogeneze
3) NADH
Tvorba:
a) Aerobní glykolýza
b) Pyruvátdehydrogenázová reakce
c) Beta-oxidace mastných kyselin
d) Krebsův cyklus
e) Oxidace etanolu
Využití:
a) Dýchací řetězec a tvorba ATP
b) Přeměna pyruvátu na laktát
_
Postavení orgánů v energetickém metabolismu
Játra
Jaterní buňky (hepatocyty) mají výjimečné postavení v intermediárním metabolismu. Hrají zásadní roli při udržení homeostázy, při syntéze molekul, při vzájemné přeměně živin i při regulaci skladování a uvolňování energie. Účastní se metabolismu všech živin.
1) Játra a metabolismus sacharidů
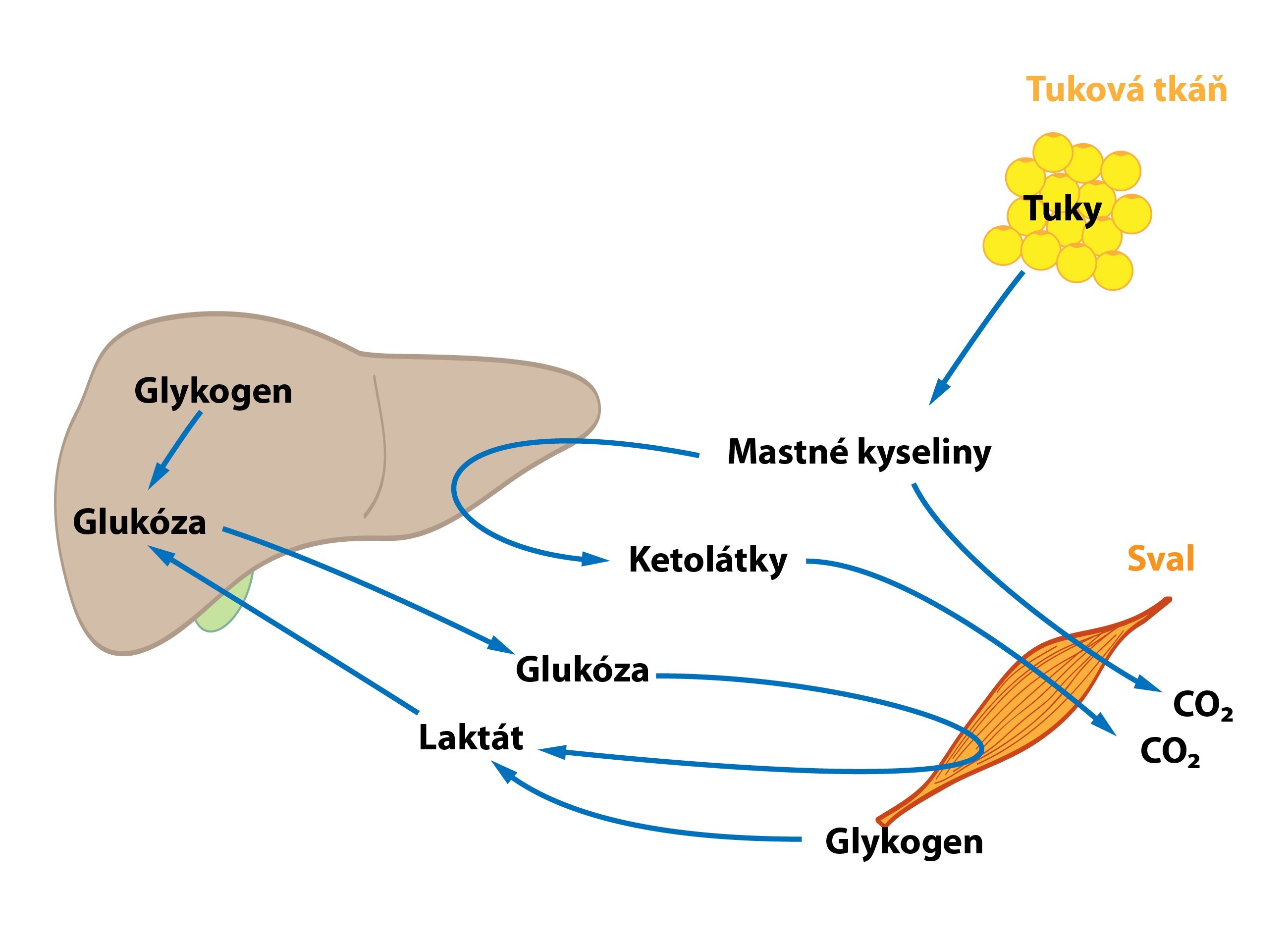
V metabolismu sacharidů je důležitá jejich funkce krátkodobé (v rozsahu hodin) i dlouhodobé (v rozsahu dnů až týdnů) regulace glykémie – glukostatická funkce jater. Při vysoké hladině glukózy ve vena portae po jídle se v játrech nastartuje syntéza glykogenu, která spotřebovává glukózu vychytanou z krve. Naopak při lačnění a poklesu glykémie se glukóza doplňuje do oběhu prostřednictvím glykogenolýzy (rozkladu zásobního glykogenu), případně (když jsou zásoby glykogenu vyčerpány) glukoneogeneze. V játrech probíhá také degradace fruktózy a galaktózy.
2) Játra a metabolismus lipidů
Některé dráhy metabolismu lipidů jsou pro játra unikátní (syntéza ketolátek). Většina drah sice probíhá i jinde, v játrech jsou ale kvantitativně nejvýznamnější. Dochází zde k oxidaci mastných kyselin. Při hladovění probíhá tato dráha v rozsahu větším, než játra potřebují k produkci energie pro vlastní spotřebu. Ze vzniklého acetyl-CoA se následně tvoří ketolátky, které játra sama zpracovat neumí, a tak je uvolňují do oběhu, kde slouží jako alternativní zdroj energie.
Klíčové je i postavení jater v metabolismu lipoproteinů. Syntetizují VLDL, část HDL, konvertují IDL na LDL a degradují chylomikronové zbytky, HDL a část LDL. Probíhá tu také syntéza cholesterolu.
3) Játra a metabolismus proteinů a aminokyselin
Z metabolismu proteinů a aminokyselin jsou opět některé reakce pro játra specifické (syntéza močoviny), naopak jiné, například deaminace a transaminace AK či syntéza neesenciálních AK, probíhají i v jiných orgánech.
Játra také syntetizují (kromě imunoglobulinů) všechny plazmatické proteiny (např. albumin nebo koagulační faktory).
Jiné tkáně
Ledviny
Koncentrování moče a transport látek v ledvinách vyžaduje velké množství energie, proto je spotřeba ATP, zejména v kůře, vysoká. ATP se získává oxidativním metabolismem glukózy, laktátu, mastných kyselin a aminokyselin.
Z metabolických drah tu probíhá také glukoneogeneze (zejména při hladovění). Jejím hlavním substrátem jsou uhlíkaté kostry aminokyselin (hlavně glutaminu). Amoniak získaný při reakcích se vylučuje přímo do moče, kde slouží jako pufr.
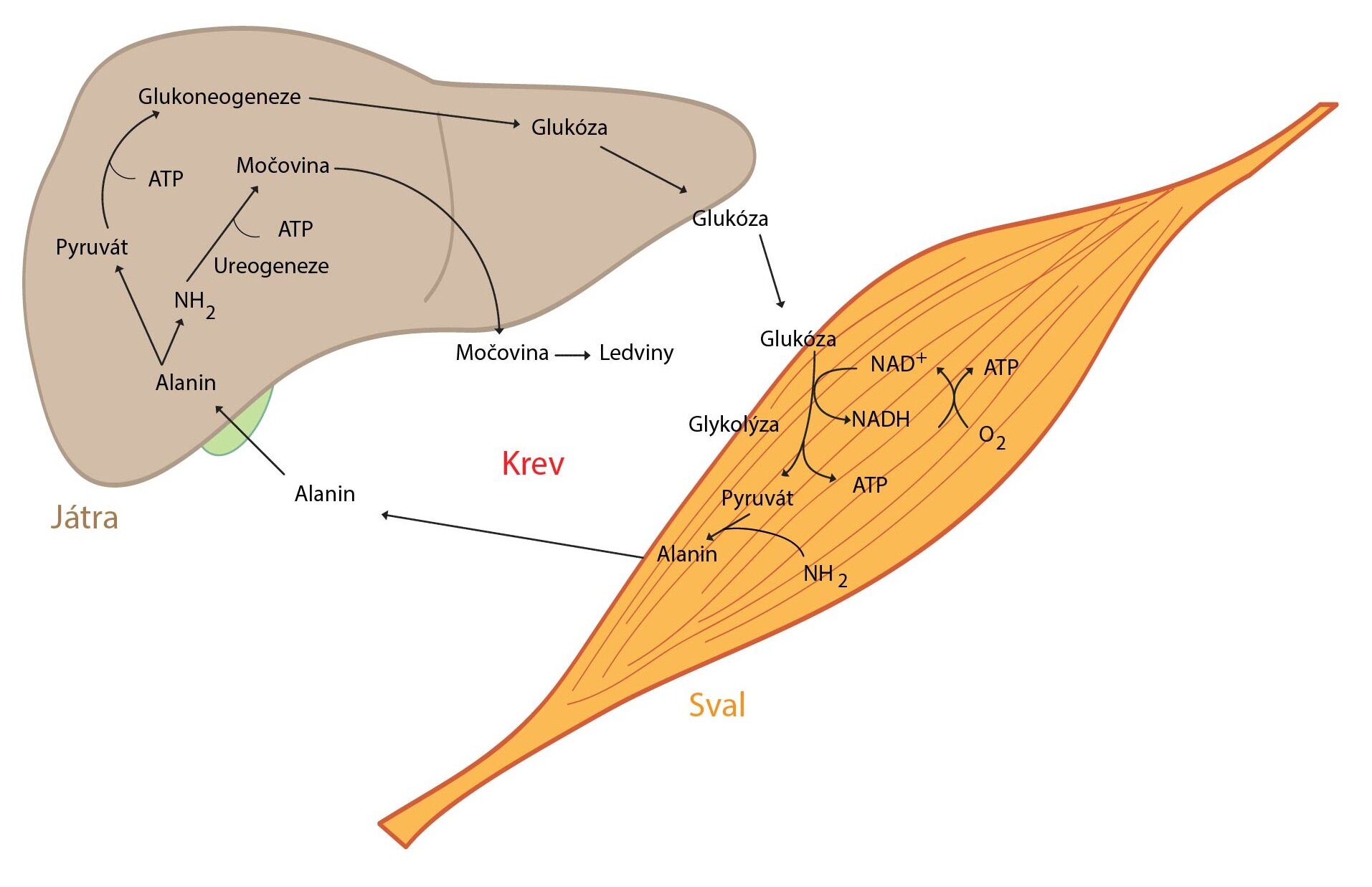
Kosterní svaly
Kosterní svaly spotřebují při své činnosti velké množství energie. Regenerace ATP probíhá cestou aerobní i anaerobní glykolýzy, degradace mastných kyselin a také z kreatinfosfátu.
Zásadní je role kosterního svalu v metabolismu aminokyselin, převážně větvených (valin, leucin a izoleucin). Jejich uhlíkaté kostry slouží k tvorbě energie a jejich aminoskupiny se využívají pro syntézu alaninu, glutaminu a glutamátu, jež uvolňuje kosterní sval ve velkém množství do oběhu. Z alaninu pak játra mohou regenerovat glukózu – tzv. alaninový cyklus.
Tuková tkáň
Tuková tkáň je postprandiálně (převaha vlivu inzulinu) využívána jako sklad TAG. Ukládá jak lipidy přijaté v potravě, tak vytvořené játry. Při lačnění (převaha účinku glukagonu) dochází naopak k lipolýze – uvolnění volných mastných kyselin a glycerolu.
Mozek
Glukóza je hlavní energetický substrát mozku, denní spotřeba činí 120 g. Při adaptovaném hladovění, které vzniká přibližně po 3 týdnech bez adekvátního přísunu energie, dokáže mozek krýt až 50 % energetické spotřeby oxidací ketolátek.
Následující obrázek ukazuje vzájemnou interakci našich orgánů během fyzické aktivity:
Autor podkapitoly: Petra Lavríková a Josef Fontana