Náplň podkapitoly:
1. Úvod do problematiky dýchacího řetězce a tvorby ATP
2. Mitochondriální elektronový transportní řetězec
_
Úvod do problematiky dýchacího řetězce a tvorby ATP
Oxidace a úloha kyslíku
Oxidace se v chemii definuje jako ztráta elektronů, případně jako zvýšení oxidačního čísla příslušného prvku. Protože odebrané elektrony musí skončit na jiném prvku, je oxidace jedné látky vždy spojena s redukcí látky jiné. Samotné slovo „oxidace“ etymologicky pochází ze slova „oxid“, které označuje sloučeninu obsahující kyslík. Pro průběh oxidace však není kyslík nevyhnutelně potřebný.
Kyslík, vynikající oxidační agens, má vysokou tendenci přijímat elektrony. Afinita prvku k elektronům je vyjádřena hodnotou jeho elektronegativity. Elektronegativita kyslíku patří mezi jednu z nejvyšších mezi prvky, vyšší má už jenom fluor. Znamená to, že přesun elektronů na kyslík, včetně tvorby vazeb s kyslíkem, je termodynamicky výhodný (tzn. uvolňuje energii). To, že se v naší atmosféře s 20 % kyslíku samovolně nevznítíme, se dá zdůvodnit jedině existencí jistých kinetických bariér (blíže viz Podkapitola 2/4).
Organismy žijící ve vysoce oxidativním prostředí (jako je to naše) rychle našly způsob, jak využít energii z přenosu elektronů z méně elektronegativních prvků na kyslík. Často užívanou metaforou oxidativního metabolismu je „spalování živin“ – naše buňky oxidují organické sloučeniny obsažené v potravě na CO2 a H2O za spotřeby kyslíku a produkce energie.
Na rozdíl od hoření je transfer elektronů z organických molekul na kyslík v našich buňkách rozdělen do mnoha kroků. Většina uvolněné energie se tak nepřemění na teplo a světlo, ale ukládá se ve formě chemického potenciálu. Z didaktických důvodů můžeme oxidativní metabolismus rozdělit do dvou fází:
1) Oxidace substrátu spojená s redukcí kofaktorů enzymů
2) Reoxidace redukovaných kofaktorů kyslíkem
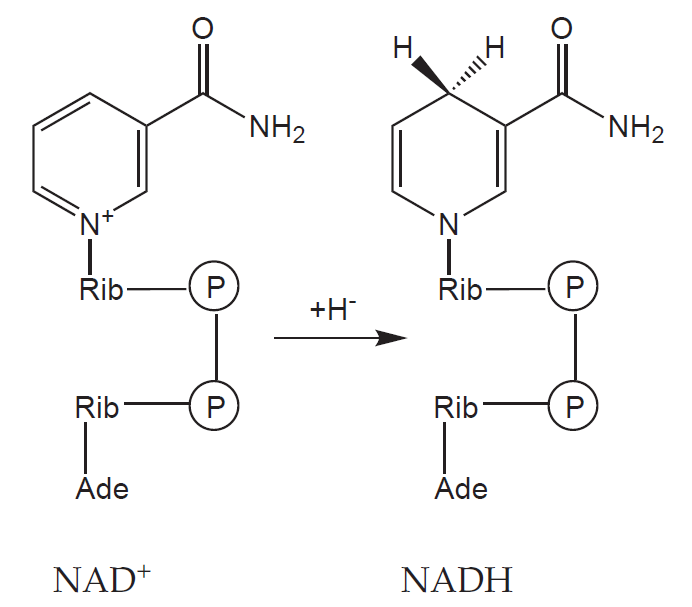
Vezměme si jako příklad glukózu. Její šestiuhlíkatá molekula (C6H12O6) je v procesu glykolýzy a pyruvátdehydrogenázové reakce postupně oxidována na dvě molekuly kyseliny octové (ve formě acetyl-koenzymu A) a dvě molekuly CO2. Během toho dochází k redukci čtyř molekul koenzymu NAD+ (nikotinamidadenindinukleotid) na NADH, přičemž každý přijme dva elektrony (často naznačeno jako přijetí hydridového aniontu H–).
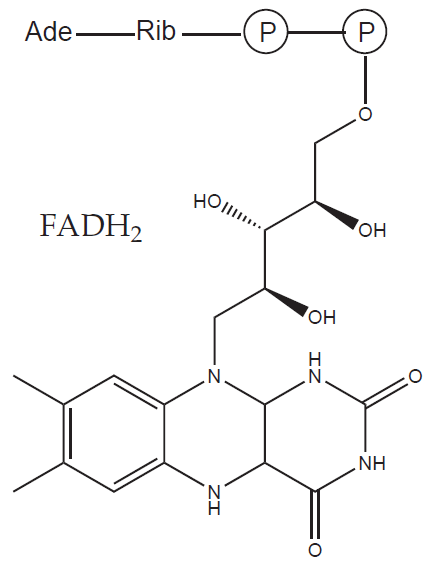
Vytvořený acetyl-CoA vstupuje do citrátového cyklu a je dále oxidován na dvě molekuly CO2 a čtyři molekuly redukovaných kofaktorů (tři NADH a jeden FADH2 – flavinadenindinukleotid).
Ve výsledku dochází při oxidaci glukózy k tvorbě 12 redukovaných kofaktorů a šesti molekul CO2. Všimněme si, že v tomto procesu nedošlo k spotřebě žádného molekulárního kyslíku (O2) – chybějící atomy kyslíku byly poskytnuty molekulami vody. V té se kyslík vyskytuje již v redukované formě (O-II), která se elektronového transferu neúčastní.
Aby mohla metabolická dráha fungovat, musí být redukované kofaktory zpětně reoxidovány. Procesu reoxidace nastává nejčastěji v mitochondriích, kde redukované kofaktory předávají získané elektrony kyslíku (redukují ho). Redukce kyslíku pak vede k uvolnění značného množství energie.
_
Mitochondriální elektronový transportní řetězec
Mitochondrie a jejich stavba
Mitochondrie představují poměrně komplexní organely, v buňce jsou vázány na cytoskelet. Podle endosymbiotické teorie Lynn Margulisové se vyvinuly ze symbiotických aerobních bakterií, které byly předtím pohlceny fagocytujícími archebakteriemi. Část jejich genomu se přesunula do jádra „hostitelské“ buňky (tím se na ní staly závislé), zbytek genomu ale zůstal v mitochondriích. Kromě vlastních genů mají také vlastní proteosyntetický aparát vykazující znaky prokaryot (70S ribozomy), proto bývají označovány jako semiautonomní organely.
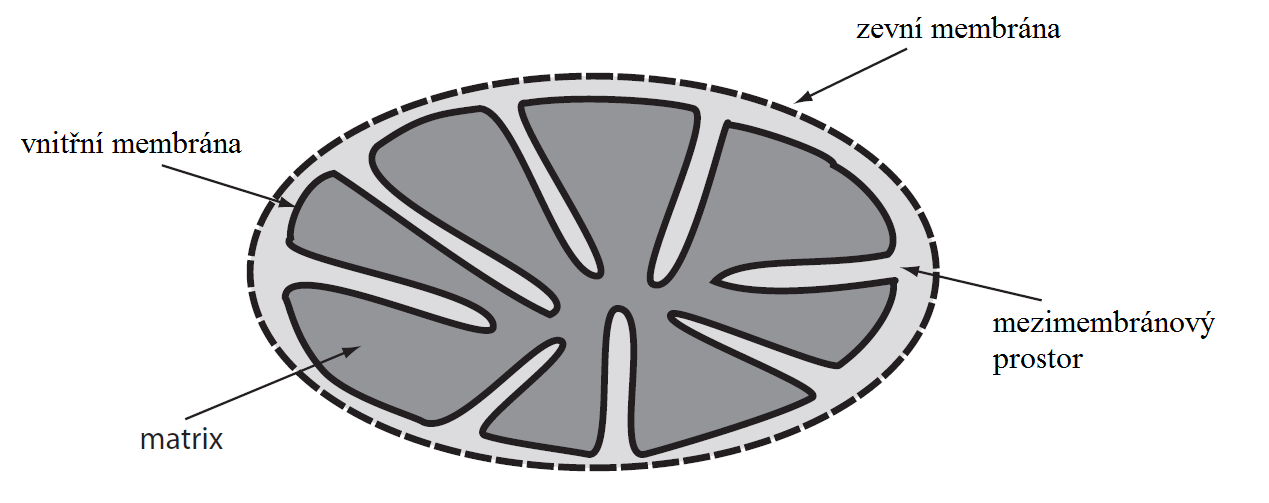
Od vnějšího prostředí je odděluje zevní mitochondriální membrána podobná membráně ER. Tato membrána je poměrně dobře propustná pro většinu menších látek (s molekulovou hmotností zamezuje vstupu bílkovin a jiných makromolekul. Současně obsahuje enzymy metabolismu mastných kyselin a fosfolipidů a tzv. TOM komplex (translocase of the outer membrane), přenášející proteiny z cytoplazmy do mezimembránového prostoru.
Mezimembránový prostor má složení podobné cytosolu (tzn. že obsah proteinů v něm je v porovnání s matrix nízký) a obsahuje například i cytochrom c a proapoptotické proteiny.
Vnitřní mitochondriální membrána je extrémně selektivní, co se přestupu látek týká. Polární molekuly přes ni téměř neprocházejí (s výjimkou několika, které mají vlastní transportéry). Vnitřní membrána obsahuje fosfolipid kardiolipin, enzymy dýchacího řetězce a tzv. TIM komplex (translocase of the inner membrane) transportující určité proteiny. Směrem do matrix vybíhá v podobě různých výběžků (nejčastější jsou kristy a tubuly, vzácně prizmata nebo sakuly).
Mitochondriální matrix má podobu hustého proteinového gelu obsahujícího enzymy mnoha metabolických drah (Krebsův cyklus, β-oxidace MK, ornitinový cyklus, …). Dále se zde nachází mDNA (a příslušné tRNA a mRNA), ribozomy či anorganické ionty (jako Ca2+).
Elektronový transportní řetězec
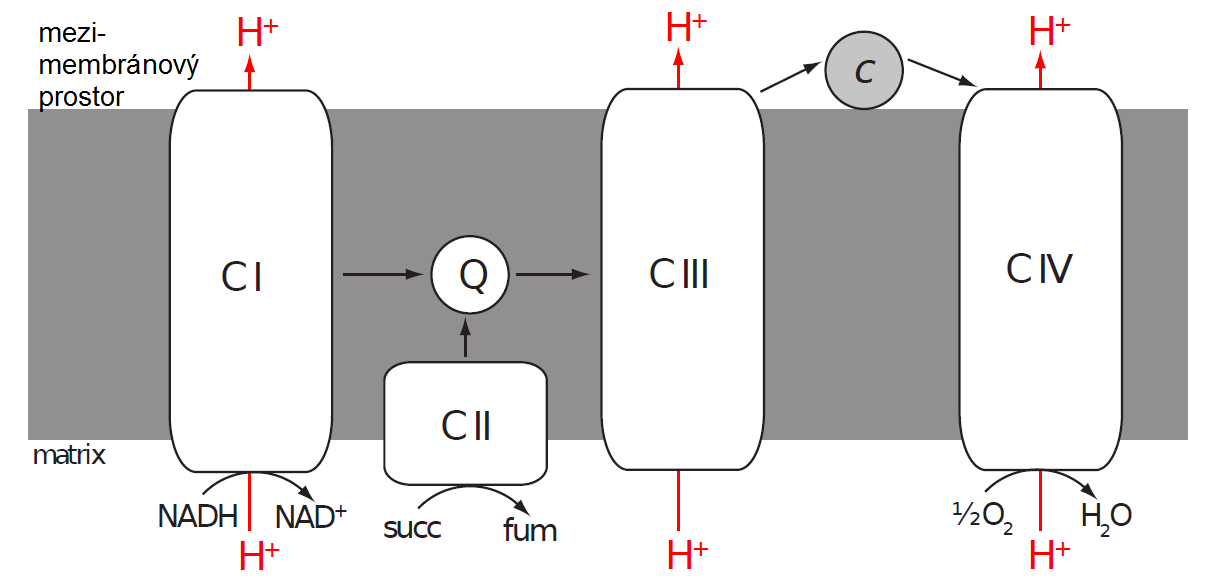
Redukované kofaktory přicházející z cytoplazmy (přes speciální transportní systém) a také z reakcí probíhajících v matrix jsou reoxidovány na vnitřní mitochondriální membráně souborem enzymů nazývaných elektronový transportní řetězec (ETC – electron transfer chain). Ten se skládá ze čtyř enzymových komplexů označovaných jako Komplex I-IV.
Komplex I (NADH dehydrogenáza nebo také NADH:ubichinon oxidoreduktáza)
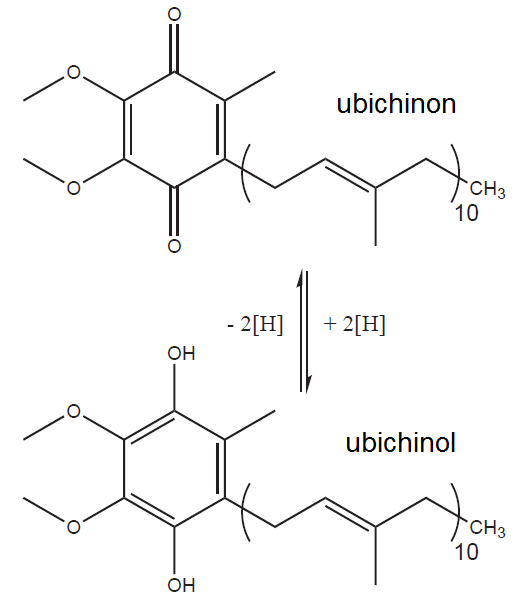
Komplex I katalyzuje oxidaci NADH na NAD+ a zároveň transfer dvou elektronů na koenzym Q (CoQ) nazývaný též ubichinon. Přesná struktura mitochondriálního Komplexu I není úplně známá, ale víme, že obsahuje přes 40 podjednotek, jednu molekulu FMN a několik atomů železa v komplexech se sírou (FeS klastry, FeS clusters). Elektrony uvolněné z NADH se navážou na FMN a následně jeden po druhém přeskakují z jednoho FeS klastru na další, dokud nedorazí k ubichinonu a neredukují ho na ubichinol.
Ubichinol (CoQH2 či UQH2) je tedy redukovaná forma ubichinonu (CoQ anebo UQ). Termín koenzym Q zastřešuje obě formy. Jedná se o extrémně hydrofobní molekulu, a to díky jeho dlouhému isoprenoidovému postrannímu řetězci (v savčím CoQ10 je deset pětiuhlíkatých isoprenylových podjednotek), kterým je připojen na nepolární jádro vnitřní mitochondriální membrány. Zde CoQ funguje jako mobilní přenašeč elektronů z Komplexu I a II (případně jiných enzymů) na Komplex III.
Komplex II
Komplex II katalyzuje oxidaci sukcinátu na fumarát a je integrální součástí citrátového cyklu (sukcinátdehydrogenáza nebo také sukcinát:ubichinon oxidoreduktáza). Elektrony získané oxidací jsou nejdříve transportovány na FAD vázané v enzymu a následně přes řetězec tří FeS klastrů a cytochrom b na ubichinon.
Komplex III (cytochrom c reduktáza nebo také ubichinol:cytochrom c oxidoreduktáza)
Komplex III přijme elektrony z redukovaného CoQ a předá je (přes dva cytochromy a FeS klaster) na další mobilní přenašeč elektronů – cytochrom c. Cytochrom c je malý hemoprotein připojený na vnější povrch vnitřní mitochondriální membrány (tzn. že se nachází v mezimembránovém prostoru). Na rozdíl od předchozích enzymů může jedna molekula cytochromu c přenášet jen jeden elektron (dochází přitom k redukci železa hemu z ferri (III) na ferro (II) formu). Elektrony z ubichinolu jsou tedy jeden po druhém přeneseny komplexním procesem nazývaným Q-cyklus.
Komplex IV (cytochrom c oxidáza či cytochrom c:dioxid oxidoreduktáza)
Komplex IV, poslední člen ETC, převezme elektrony z redukovaného cytochromu c a přes dva cytochromy a tři atomy mědi je předává konečnému příjemci (akceptoru), kterým je kyslík.
Redoxní potenciál
Aby mohl mitochondriální ETC fungovat popsaným způsobem, musí existovat síla, která „tlačí” elektrony přes řetězec z NADH až na O2. V případě hořícího dřeva jsme mluvili o elektronegativitě elementárního kyslíku. Příbuzná míra afinity pro elektrony je redoxní potenciál.
V Podkapitole 2/4 jsme popisovali elektrodový potenciál vytvořený ponořením tyčinky čistého kovu do roztoku jeho iontů (tedy jeho oxidované formy). Pokud oddělíme dvě poloreakce přítomné v každé redoxní reakci (redukci a oxidaci), můžeme pro ně za standardních podmínek definovat standardní elektrodové potenciály. V závislosti na směru průběhu těchto reakcí je nazýváme standardní oxidační a standardní redukční potenciál. Pojem, který je zastřešuje, je redoxní potenciál (obvykle popisuje reakci ve směru jejího typického průběhu).
Tok elektronů ve správném směru (z NADH na kyslík přes komplexy a mobilní přenašeče elektronů) v ETC lze zdůvodnit tím, že všechny „zastávky po cestě” mají zvyšující se redoxní (konkrétněji redukční) potenciál. To znamená, že při postupu řetězcem se jeho jednotlivé články stále snáze a snáze redukují. Kyslík, nacházející se na konci řetězce, se redukuje zdaleka nejsnadněji – proto jde o tak dobré oxidační činidlo.
Energie
Na začátku podkapitoly jsme zmínili, že výhodou použití kyslíku jako finálního akceptoru elektronů je množství energie, které se následně nabízí k dispozici. Dosud jsme ale sledovali jen transfer elektronů přes ECT až k finálnímu akceptoru, ale neuvedli jsme, jak toho mohou naše buňky využít.
Velký nárůst redukčního potenciálu mezi NADH (či FADH2) a kyslíkem a jemu odpovídající změna volné energie (ΔG) se nepromrhá. Použije se na pumpování protonů (H+) z matrix mitochondrie do mezimembránového prostoru.
Tok elektronů přes Komplexy I, III a IV je spojený s přečerpáním určitého množství protonů na jeden pár elektronů (Komplex II žádné protony nepřenáší). Protože je vnitřní mitochondriální membrána vysoce nepropustná pro protony, dochází na ní k tvorbě protonového gradientu (množství protonů je větší v mezimembránovém prostoru než v matrix). Vyšší koncentrace protonů znamená nižší pH a pozitivní elektrický potenciál. Mezimembránový prostor má proto kyselejší prostředí a je pozitivně nabitý vůči matrix. Membránový potenciál mitochondrie je obvykle vyjádřen jako napětí.
Podobně jako může být gravitační potenciální energie tun vody uložených v nádrži využita ve vodní elektrárně k produkci elektřiny, může se v mitochondrii energie protonového gradientu na vnitřní membráně použít na výrobu jiného druhu energie – chemické energie uložené v molekulách ATP.
Syntéza ATP je katalyzována enzymem F1.FO-ATP syntáza. FO podjednotka tvoří kanál přes vnitřní membránu mitochondrie, a umožňuje tak návrat protonů z mezimembránového prostoru zpět do matrix. Je to právě tento tok protonů po elektrochemickém gradientu, který se využívá k otáčení části enzymu (podobně jako voda tekoucí z přehrady otáčí turbíny). Rotace je následně přenášena na centrální osu (stopku) F1 podjednotky enzymu, která tlačí na vnější podjednotky, jež jsou drženy nehybné spojením s periferní stopkou (osou), a tím na nich pohání fosforylaci ADP na ATP. F1 podjednotka má tři místa syntézy ATP, a jedna kompletní otočka tudíž umožní tvorbu tří molekul ATP.
Specifický přenašeč (ANT – adenine nucleotide translocator) následně přenáší nově nasyntetizované molekuly ATP výměnou za ADP ven z matrix do cytoplazmy.
Stechiometrie
Všechny výše popisované procesy slouží primárně k získání energie ze substrátu, která může být následně použita ke konání užitečné práce. Je proto pochopitelné, že nás zajímá, jaké množství energie mohou mitochondrie vytěžit, například z molekul glukózy nebo kyseliny palmitové.
V předchozích částech jsme se zabývali množstvím elektronů odebraných (ve formě redukovaných kofaktorů) při metabolismu glukózy – podobně můžeme jejich počet zjistit i pro jiné substráty. Otázka mitochondriální stechiometrie tedy zní: kolik molekul ATP můžeme vyrobit v ETC na určitý počet přenesených elektronů? Tuto otázku můžeme dále rozdělit na dvě podotázky:
1) Kolik protonů je transportováno přes membránu na jeden pár elektronů?
2) Kolik protonů se musí přemístit zpět do matrix, aby bylo možné vyrobit jednu molekulu ATP?
Podle současných poznatků znějí odpovědi takto:
1) Na dva elektrony přeneseme 10 protonů. Komplexy III a IV transportují dohromady šest protonů a Komplex I přenese pravděpodobně čtyři protony na elektronový pár.
2) Tady je odpověď o něco složitější. Na základě současných teoretických modelů fungování F1.FO-ATP syntázy je poměr H+ /ATP přibližně 4,33, tzn. aby bylo možné vyrobit tři molekuly ATP, musí být přeneseno 13 protonů (10 protonů přenesených přes F1.FO-ATP syntázu a další tři jsou použity na import ADP a fosfátu a export ATP přes ANT).
Uvedená čísla ale znamenají maximálně dosažitelné hodnoty při nejlepších podmínkách, pokud všechny součásti ETC pracují bezchybně a vnitřní mitochondriální membrána je pro protony zcela nepropustná. Tyto podmínky však samozřejmě nejsou v běžném stavu dosažitelné.
Rozpojení – uncoupling
Mechanismus převodu energie mezi ETC a syntézou ATP může být rozpojený, je-li umožněn zpětný tok protonů z mezimembránového prostoru do matrix. Tato neefektivní ztráta protonového gradientu promění v něm uloženou energii na její méně užitečnou formu – teplo.
Navzdory tomu, že teplo je obecně mnohem méně užitečné než například ATP, existují situace, kdy schopnost produkovat teplo může zachránit život – například pokud je organismus vystaven nízkým teplotám. Svalový třes, dobře známý mechanismus tvorby tepla, využívají lidé i ostatní savci. Tento proces produkuje teplo prostřednictvím neefektivního převodu energie během svalové kontrakce. Novorozenci a mnoho zvířat používají jiný způsob – rozpojení mitochondriálního řetězce (uncoupling).
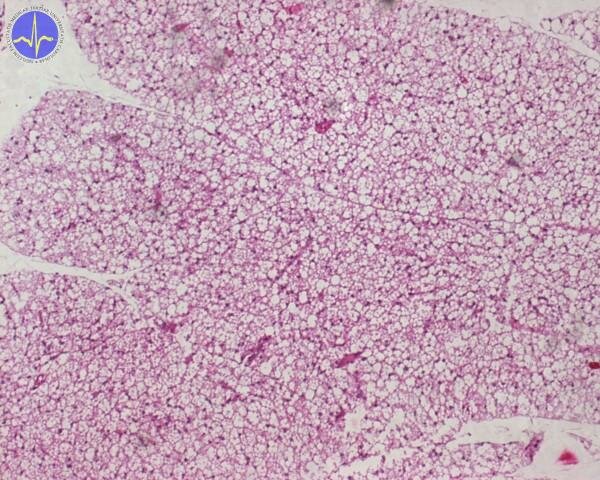
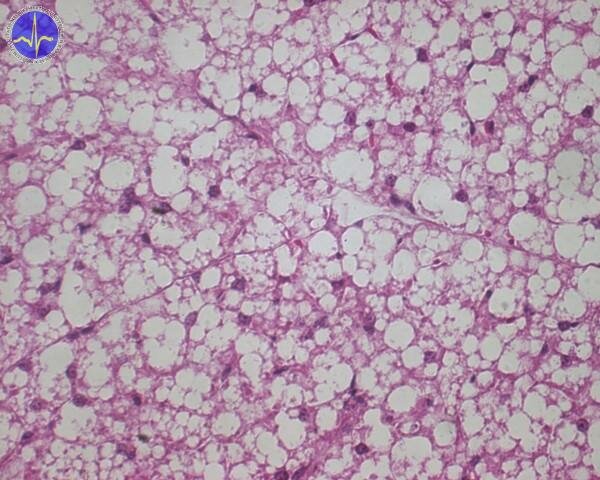
Rozpojení dýchacího řetězce k produkci tepla se odehrává převážně ve speciální tkáni zvané hnědá tuková tkáň. Hnědý tuk (na rozdíl od jeho bílého kolegy) je takto zbarvený proto, že obsahuje mnoho mitochondrií.
Hnědá tuková tkáň 2x – buňky obsahují více různě velkých tukových kapének.
Zatímco bílý tuk energii skladuje, úlohou hnědého je (zjednodušeně) jí „plýtvat”. Mitochondrie hnědé tukové tkáně obsahují speciální protein, který tvoří kanál ve vnitřní mitochondriální membráně, a umožňuje tak přesun elektronů – UCP-1 (uncoupling protein-1, thermogenin). Je-li hnědá tuková tkáň aktivována noradrenalinem (skrze β3-adrenergní receptory), hydrolyzuje své triacylglyceroly a uvolněné mastné kyseliny poskytují energii pro ETC a současně aktivují UCP-1.
Existují také jiné podtypy UCP (UCP-2 až UCP-5) exprimované v jiných tkáních, jejich funkce ale dosud není zcela objasněna.
_
Autor podkapitoly: Jan Trnka