Náplň podkapitoly:
1. Úvod do odbourávání lipidů a metabolismu ketolátek
2. Lipidy jako zdroj energie – degradace TAG v buňkách, β-oxidace mastných kyselin
3. Tvorba a využití ketolátek
_
Úvod do odbourávání lipidů a metabolismu ketolátek
Triacylglyceroly (TAG) uchovávají velké množství chemické energie. Jako uložiště energie jsou velmi výhodné, protože 1 g bezvodého TAG skladuje šestkrát více energie než 1 g hydratovaného glykogenu. Kompletní oxidací 1 g TAG se získá přibližně 38 kJ, zatímco z 1 g sacharidů či proteinů jen 17 kJ. 70 kg vážící muž shromažďuje ve svých TAG přibližně 400 000 kJ – celková hmotnost TAG se pohybuje kolem 10,5 kg. Tyto zásoby nám umožní přežít i několikatýdenní hladovění. Hlavním místem akumulace TAG je cytoplazma adipocytů.
Jednotlivé typy oxidace mastných kyselin se označují řeckými písmeny, jež určují uhlíkový atom, na kterém probíhají reakce. Majoritní význam má β-oxidace probíhající v matrix mitochondrie. Na membránách endoplazmatického retikula se vyskytují enzymy katalyzující tzv. ω- a α- oxidaci.
Živočichové nedovedou převést mastné kyseliny na glukózu. MK představují bohatý zdroj energie pro glukoneogenezi, ale z jejich uhlíkových atomů se netvoří glukóza (s výjimkou mastných kyselin s lichým počtem C). Acetyl-CoA totiž nelze převést ani na pyruvát, ani na oxalacetát – oba uhlíky se během průběhu Krebsova cyklu odštěpí jako CO2. Pyruvátdehydrogenázová reakce je nevratná. Rostliny mají další dva enzymy, které jim umožňují převést AcCoA na OAA, v tzv. glyoxylátovém cyklu.
_
Lipidy jako zdroj energie – degradace TAG v buňkách, β-oxidace mastných kyselin
Využití lipidů k produkci energie probíhá ve třech základních fázích:
1) Mobilizace lipidů – hydrolýza TAG na MK a glycerol a jejich transport krví
2) Aktivace MK v cytosolu a jejich transport do matrix mitochondrií
3) β-oxidace: odbourávání MK na acetyl~CoA, jenž vstupuje do Krebsova cyklu, či se z něj tvoří ketolátky
Mobilizace lipidů – lipolýza
Mobilizaci zásobních lipidů enzymaticky zajišťuje hormon-senzitivní lipáza (HSL). Ta katalyzuje reakci:
TAG → 3 MK + glycerol
Uvolněné mastné kyseliny se vážou na sérový albumin, který je dopraví na místo určení (např. do jater). Glycerol se přenáší volně rozpuštěný v plazmě.
Regulace lipolýzy
Jak již název napovídá, enzym se nachází pod důslednou hormonální kontrolou. Jeho aktivitu podněcuje fosforylace jeho molekuly. Inzulin jako anabolický hormon vyvolává jeho inhibici, kontraregulační hormony (glukagon, katecholaminy) či hormony štítné žlázy ho naopak aktivují.
Využití glycerolu
Glycerol získaný hydrolýzou triacylglycerolů se zapojuje do energetického metabolismu skrze meziprodukty glykolýzy/glukoneogeneze. První krok učiní jeho fosforylace na glycerol-3-P pomocí glycerolkinázy. Následuje jeho dehydrogenace na dihydroxyaceton-P katalyzovaná glyceraldehyd-3-fosfátdehydrogenázou. Ten představuje meziprodukt glykolýzy/glukoneogeneze.
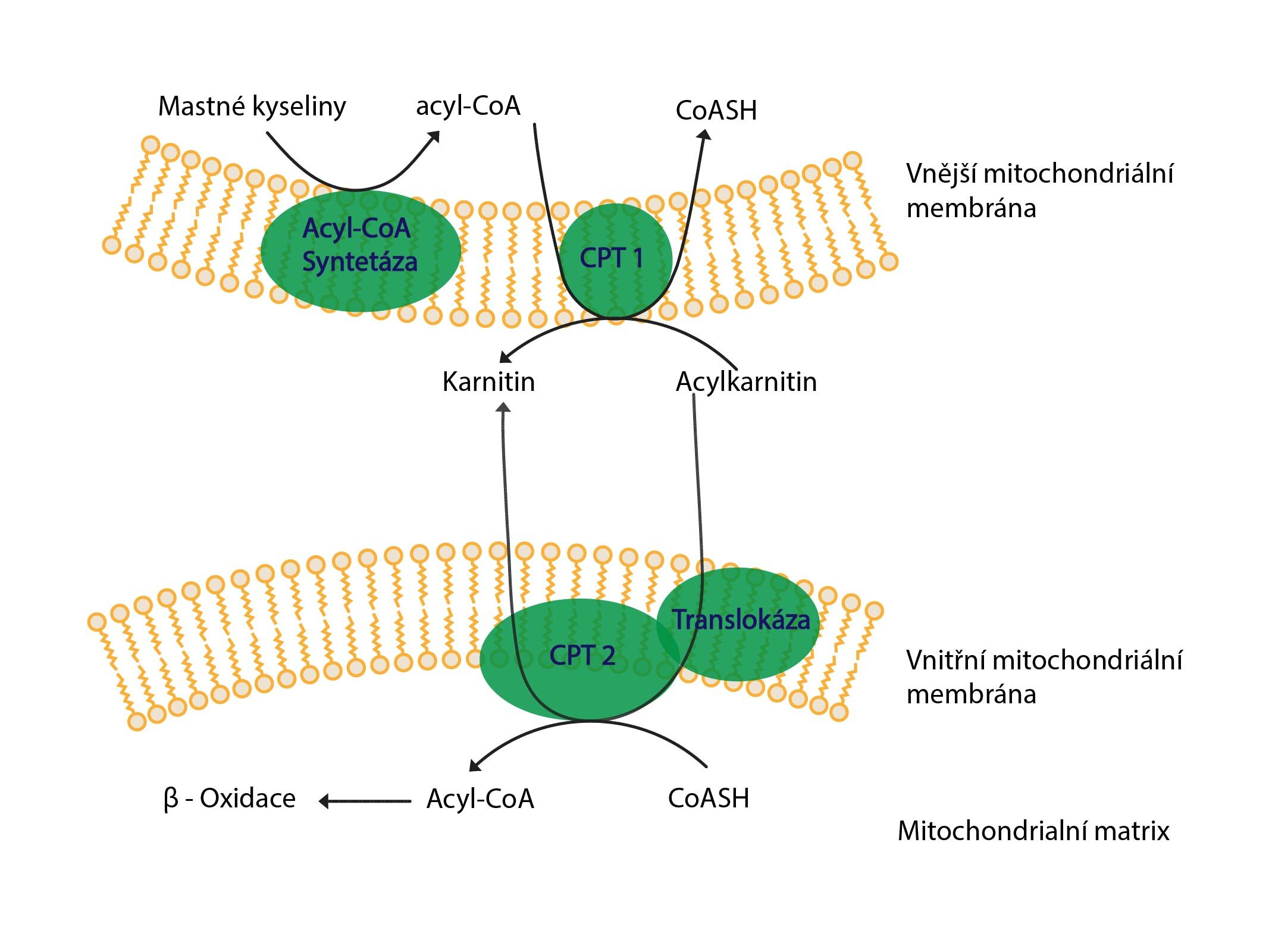
Průnik mastných kyselin do buněk
Způsob překonání buněčné membrány závisí na délce řetězce. Mastné kyseliny s krátkým řetězcem (↓12C) mohou pronikat prostou difúzí. Ty s delším řetězcem využívají v membráně různé transportní systémy umožňující jejich usnadněnou difúzi – např. FATP (fatty acid transport protein) či FAT/CD36 (fatty acid translocase).
Aktivace mastných kyselin
K aktivaci mastných kyselin dochází okamžitě po jejich vstupu do buňky v cytosolu na vnější mitochondriální membráně. Bez ní nelze uvažovat o zapojení jejich molekul do metabolismu. Současně udržuje jejich stálý koncentrační gradient (analogicky k fosforylaci glukózy – viz: Podkapitola 2/9. Jejím principem je esterové navázání molekuly mastné kyseliny na SH-skupinu koenzymu A prostřednictvím acyl-CoA-syntetázy (thiokináza mastných kyselin):
MK + ATP + HS-CoA → acyl-CoA + AMP + 2 Pi
Aktivace mastné kyseliny probíhá ve skutečnosti ve dvou fázích. Nejdříve vzniká acyladenylát (acyl-AMP) a ve druhé fázi se AMP vyměňuje za koenzym A.
Vstup mastných kyselin do matrix mitochondrie
Způsob vstupu mastných kyselin do matrix mitochondrie závisí na délce jejich řetězce:
1) Do C10 vstupují do matrix volně
2) C12-C18 vstupují pomocí karnitinového přenašeče
3) Nad C18 neprocházejí
Acyl-CoA s C12-C18 může volně procházet vnější mitochondriální membránou, ale vnitřní membrána je pro něj nepropustná. Mastná kyselina tedy musí opustit vazbu na koenzym A a navázat se na nového partnera. Tím je karnitin. Přenos mastné kyseliny mezi koenzymem A a karnitinem katalyzuje karnitinacyltransferáza I (CAT I, neboli karnitinpalmitoyltransferáza I – CPT I) nacházející se na cytosolové straně vnější mitochondriální membrány.
Karnitin-acylkarnitin translokáza ve vnitřní mitochondriální membráně umožňuje následnou výměnu karnitinu za acylkarnitin, čímž se acylkarnitin dostává do matrix mitochondrie.
Zde dojde ke zpětnému přenosu mastné kyseliny z acylkarnitinu na koenzym A prostřednictvím karnitinacyltransferázy II (CAT II). Uvolněný karnitin opouští matrix pomocí translokázy výměnou za nový acylkarnitin. Tímto jsme přenesli acyl-CoA do matrix mitochondrie, kde nic nebrání tomu, aby podlehl β-oxidaci.
Průběh β-oxidace mastných kyselin
β-oxidace probíhá pouze za aerobních podmínek – úzce totiž souvisí s dýchacím řetězcem. Jednotlivé reakce β-oxidace mastných kyselin katalyzují čtyři enzymy:
1) Acyl~CoA-dehydrogenáza – prostetickou skupinou je FAD
2) Enoyl~CoA-hydratáza
3) L-3-hydroxyacyl~CoA-dehydrogenáza – koenzymem je NAD+
4) β-ketothioláza
Reakce můžeme shrnout do sledu dehydrogenace – hydratace – dehydrogenace – thiolytické štěpení. První tři reakce jsou analogické k reakcím probíhajícím v Krebsově cyklu počínaje sukcinátem (viz: Podkapitola 2/8):
1) Oxidace sukcinátu na fumarát pomocí sukcinátdehydrogenázy – kofaktorem je FAD
2) Adice vody na dvojnou vazbu ve fumarátu, vzniká malát za katalýzy fumaráthydratázou
3) Oxidace malátu na oxalacetát pomocí enzymu malátdehydrogenázy – kofaktorem je NAD+
Acyl~CoA-dehydrogenáza – první oxidace
Tento enzym katalyzuje vznik dvojné vazby mezi 2. (α) a 3. (β) uhlíkem řetězce mastné kyseliny. Jedná se o stereospecifickou reakci, při níž vzniká trans-enoyl-CoA. Příjemcem elektronů je FAD. V buňkách se vyskytují různé druhy dehydrogenáz, jež se liší délkou řetězce MK, kterou oxidují:
1) Krátké MK (4-6 C)
2) Střední MK (6-10 C)
3) Dlouhé MK (12-18 C)
Enoyl-CoA-hydratáza
Tento enzym katalyzuje hydrataci trans- dvojné vazby vytvořené v prvním kroku. Vzniká hydroxylová skupina – L-3-hydroxyacyl-CoA
Hydroxyacyl-CoA-dehydrogenáza
Tento enzym katalyzuje oxidaci hydroxylové skupiny na třetím (β) uhlíku na ketoskupinu. Elektrony přijímá koenzym NAD+.
β-ketothioláza
Posledním krokem jedné otočky β-oxidace je thiolytické štěpení katalyzované β-ketothiolázou. Dochází při něm k ataku SH-skupiny koenzymu na β-keto uhlík řetězce mastné kyseliny. Reakce vede ke vzniku AcCoA a o dva uhlíky kratší acyl~CoA.
Jedna otočka β-oxidace
β-oxidace je cyklický proces, jehož jednu otočku dokážeme zapsat jako:
Acyl-CoA + FAD + NAD+ + HS-CoA → acyl-CoA (o 2 C kratší) + FADH2 + NADH + H+ + AcCoA
Meziprodukt (acyl-CoA o 2 C kratší) vstupuje do dalšího kola β-oxidace. Většina mastných kyselin má sudý počet C, a proto se při poslední otočce přemění butyryl-CoA na dvě molekuly AcCoA.
Výtěžek kompletní oxidace palmitátu
Pro představu o celkové výtěžnosti oxidace mastných kyselin zde uvádíme rovnici a energetickou bilanci kompletní oxidace palmitátu:
Palmitoyl~CoA + 7 FAD + 7 NAD+ + 7 HSCoA + 7 H2O → 8 AcCoA + 7 FADH2 + 7 NADH+H+
Jak jsme již připustili v Podkapitole 2/7, nedokážeme zcela přesně určit množství ATP produkované v dýchacím řetězci při oxidaci živin. Proto následující čísla vnímejte prosím pouze jako přibližné a rámcově správné množství. Uvádíme je zde proto, abyste je mohli porovnat s oxidací jiných živin, např. glukózy. V dýchacím řetězci se získá z jednoho NADH 2,5 (3) ATP a z jednoho FADH2 1,5 (2) ATP, což při součtu představuje:
1) 7 x FADH2 = 10, 5 (14) ATP
2) 7 x NADH = 17, 5 (21) ATP
3) Oxidace 8 AcCoA v Krebsově cyklu = 80 (96) ATP
Celkový zisk se zastavil na součtu 108 (131) ATP. Na aktivaci mastné kyseliny jsme ale spotřebovali 2 ATP, a proto čistý zisk činí 106 (129) ATP.
Regulace β-oxidace mastných kyselin
Regulace β-oxidace probíhá na úrovni vstupu mastných kyselin do mitochondrie – neboli na úrovni karnitinového přenašeče, přesněji na úrovni karnitinacyltransferázy I (CAT I). Tento enzym je inhibován meziproduktem tvorby mastných kyselin – malonyl~CoA. Hovoříme o tzv. cross regulaci. V čem spočívá? Syntéza mastných kyselin se odehrává v cytosolu, stejně jako reakce katalyzovaná CAT I. Malonyl~CoA vzniká jako produkt první reakce tvorby mastných kyselin. Cross regulace brání současnému průběhu syntézy i degradace MK. Inzulin β-oxidaci inhibuje, kontraregulační hormony ji naopak aktivují.
Mastné kyseliny s lichým počtem C
Oxidací mastných kyselin s lichým řetězcem se vytváří jako produkt kromě AcCoA i propionyl-CoA. Ten se nejdříve karboxyluje na methylmalonyl-CoA, který je převeden na sukcinyl-CoA – meziprodukt Krebsova cyklu. Skrze přeměnu na oxalacetát se může zapojit do glukoneogeneze – z těchto mastných kyselin se dá nasyntetizovat glukóza. Mastných kyselin s lichým počtem uhlíkových atomů se ale v těle vyskytuje velmi málo.
Odbourávání nenasycených mastných kyselin
Většina nenasycených mastných kyselin v lidském těle a v potravě má cis konfiguraci dvojných vazeb. Jejich degradace v β-oxidaci probíhá procesem popsaným výše, dokud se jejich dvojná vazba nedostane do kontaktu s enoyl-CoA-hydratázou. Ta totiž vyžaduje jen trans izomery – je tedy nutné převedení cis izomeru na trans pomocí izomerázy.
Oxidace mastných kyselin s velmi dlouhým řetězcem
Oxidace mastných kyselin s velmi dlouhým řetězcem (více než 18 C) probíhá v peroxizómech. První krok katalyzuje flavoproteinová dehydrogenáza, která přenáší elektrony na O2 – vzniká H2O2:
1) FADH2 z prvního kroku se reoxiduje nikoli v dýchacím řetězci, ale reakcí s O2:
FADH2 + O2 → FAD + H2O2
2) Peroxisomální kataláza rozkládá H2O2:
2 H2O2 → 2 H2O + O2
Oxidace končí u oktanoyl-CoA, který je z peroxizómů transportován ve vazbě na karnitin a míří do β-oxidace. Výše popsané reakce nevedou ke tvorbě ATP.
α-oxidace a ω-oxidace
Jedná se o minoritní dráhy oxidace mastných kyselin. Při ω-oxidaci dochází k reakcím na koncovém uhlíku řetězce. Při α-oxidaci nastává oxidace na α-uhlíku.
_
Tvorba a využití ketolátek
Tvorba a funkce ketolátek
Mezi ketolátky (ketone bodies) řadíme acetoacetát, β-hydroxybutyrát a aceton. Hlavním místem jejich tvorby jsou mitochondrie hepatocytů. Ketolátky představují ve vodě rozpustnou transportní formu acetylů. Tvoří se při nadbytku acetyl-CoA produkovaného jaterní beta-oxidací – játra „předžvýkají“ mastné kyseliny a poskytnou tělu ketolátky jako alternativní zdroj energie.
Vstup AcCoA do Krebsova cyklu závisí na dostupnosti oxaloacetátu. Ten vzniká karboxylací pyruvátu. Při hladovění či při diabetes mellitus se OAA spotřebovává v procesu glukoneogeneze. Nedostatek sacharidů vede ke snížení množství OAA a tím ke zpomalení Krebsova cyklu. Tuky hoří v ohni sacharidů.
Dříve než se dostaneme ke konkrétním reakcím tvorby ketolátek (ketogeneze), popíšeme si situaci v organismu, za níž probíhá. Na počátku stojí aktivace lipolýzy prostřednictvím hormon-senzitivní lipázy (HSL). Ta vyústí ve zvýšení plazmatických koncentrací MK, které ve zvýšené míře vstupují do jaterních buněk. V nich podléhají β-oxidaci, jež produkuje nadbytek AcCoA. Ten se nemůže dostatečně uplatnit v jiných drahách, a proto vstupuje do ketogeneze. Zdrojem uhlíkových atomů v ketogenezi je tedy pouze acetyl~CoA.
Průběh tvorby ketolátek můžeme popsat následujícími reakcemi:
1) Kondenzace dvou molekul AcCoA → acetoacetyl~CoA
2) Reakce s dalším AcCoA → 3-hydroxy-3- methylglutaryl~CoA (HMG~CoA)
3) Štěpení HMG-CoA → AcCoA a acetoacetát
4) Reverzibilní přeměna acetoacetátu a β-hydroxybutyrátu
5) Dekarboxylace acetoacetátu
β-Ketothioláza
β-Ketothioláza katalyzuje poslední krok β-oxidace mastných kyselin – thiolytické štěpení. Při tvorbě ketolátek se reakce obrátí a ze dvou molekul AcCoA vzniká jedna molekula acetoacetyl~CoA. Reakce probíhá v matrix mitochondrie.
3-hydroxy-3-methylglutaryl-CoA syntáza
Tento enzym katalyzuje kondenzaci acetyl~CoA s acetoacetyl~CoA. Kondenzace probíhá na třetím uhlíku acetoacetyl~CoA za vzniku 3-hydroxy-3-methylglutaryl-CoA. Tento významný intermediát se vyskytuje nejen v metabolismu ketolátek, ale vzniká i během syntézy cholesterolu.
3-hydroxy-3-methylglutaryl-CoA lyáza
Tento enzym katalyzuje štěpení HMG-CoA na acetoacetát a AcCoA. Tím vzniká první ketolátka.
β-hydroxybutyrátdehydrogenáza
Tento enzym katalyzuje vzájemnou reverzibilní přeměnu dvou ketolátek – acetoacetátu a β-hydroxybutyrátu. Kofaktorem je NAD+. Při masivní tvorbě ketolátek je β-hydroxybutyrát kvantitativně nejvýznamnější ketolátkou v krvi, tj. většina acetoacetátu se přeměňuje na něj.
Dekarboxylace acetoacetátu
Část molekul acetoacetátu spontánně (neenzymově) dekarboxyluje na aceton, který nemá v lidském těle žádné využití a je vylučován dýcháním či močí.
Aktivace a utilizace ketolátek
Ketolátky jsou polární – transportují se volně v plazmě. K jejich utilizaci dochází jen extrahepatálně, hepatocyty totiž neobsahují enzym nutný k jejich aktivaci. Nejdříve dochází k oxidaci β-hydroxybutyrátu na acetoacetát, který se následně aktivuje přenosem koenzymu A ze sukcinyl~CoA. Acetocetyl~CoA se přeměňuje na AcCoA (součást β-oxidace, katalyzuje thioláza), který vstupuje do Krebsova cyklu.
Srdeční sval, kosterní svalovina a kůra ledvin preferují oxidaci ketolátek před oxidací glukózy. Mozek se za hladovění adaptuje na spalování ketolátek – při dlouhodobém hladovění je až 50 % jeho energetických nároků kryto oxidací ketolátek.
Regulace ketogeneze
Regulace ketogeneze probíhá na čtyřech stupních:
1) Hormon-senzitivní lipáza – lipolýza v tukové tkáni
2) Karnitinacyltransferáza I – vstup mastných kyselin do mitochondrie, kde proběhne jejich β-oxidace
3) Směřování AcCoA z β-oxidace do ketogeneze a ne do Krebsova cyklu
4) Mitochondriální HMG-CoA-syntáza
Vysoká hladina ketolátek v krvi signalizuje přítomnost velkého množství AcCoA. Jejím následkem je inhibice lipolýzy.
Koncentrace ketolátek v plazmě a ketoacidóza
Zde uvádíme přehled plazmatických koncentrací 3-hydroxybutyrátu (3-HB) za různých situací:
1) Po jídle: 3-HB ~ 0,05 mmol/l, FFA < 0,2 mmol/l
2) 12 hod lačnění: 3-HB < 0,2 mmol/l, FFA ~ 0,4 mmol/l
3) 21 dní hladovění: 3-HB ~ 5 mmol/l, FFA ~ 1,5 mmol/l
4) T1DM, rozvinutá ketoacidóza s pH = 7,0: 3-HB ~ 20 mmol/l, FFA ~ 5 mmol/l
Maximální rychlosti tvorby ketolátek se dosáhne při plazmatické koncentraci ~ 12 mmol/l.
Ketoacidóza
Ketoacidóza je stav, kdy rostou plazmatické koncentrace ketolátek, a protože se jedná o poměrně silné kyseliny, vede jejich nárůst k rozvoji acidemie (pokles pH krve). Tento stav může vést až k ohrožení života. Diabetická ketoacidóza (DKA) je způsobena nedostatkem inzulinu. Mírná ketoacidóza se podílí na poklesu pH při hladovění. Mezi další stavy provázené ketoacidózou patří:
1) Alkoholická ketoacidóza
2) Těhotenská ketóza
3) Otravy: isopropylalkohol, salicyláty
4) Vrozené metabolické vady
Diabetická ketoacidóza (DKA)
Patofyziologickým podkladem diabetické ketoacidózy je nedostatek inzulinu a relativní nadbytek kontraregulačních hormonů. Toto vyústí v excesivní lipolýzu v tukové tkáni, což vede k nárůstu koncentrace mastných kyselin v plazmě. V hepatocytech poklesne koncentrace malonyl-CoA, čímž dojde k dezinhibici transportu acyl-CoA do mitochondrie – spustí se proces β-oxidace. Aktivuje se HMG-CoA-syntáza a dýchací řetězec je sycen redukovanými kofaktory z oxidace mastných kyselin – nastává zpomalení Krebsova cyklu. Souběžně stoupá produkce i utilizace ketolátek, ketolátky se vylučují močí – ketonurie. Utilizace ketolátek dosahuje maxima při koncentraci ~12 mmol/l, dochází ale k jejich další kumulaci a prohloubení acidemie. V dechu těchto osob můžeme cítit nasládlý zápach acetonu.
_
Autoři podkapitoly: Josef Fontana a Petra Lavríková