Náplň podkapitoly:
1. Morfologie, tvorba a metabolismus formovaných krevních elementů
2. Krevní skupiny
_
Morfologie, tvorba a metabolismus formovaných krevních elementů
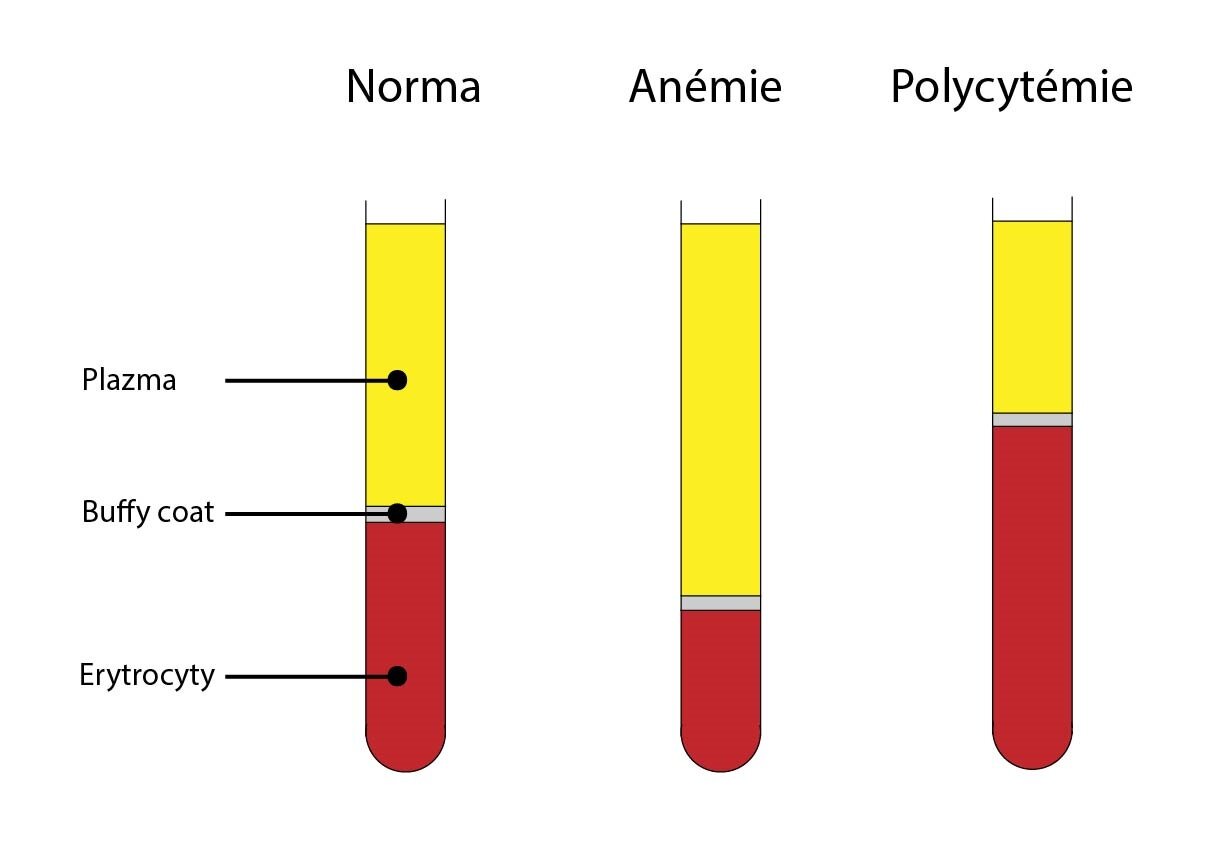
Mezi formované krevní elementy patří erytrocyty, leukocyty a trombocyty. Prostřednictvím centrifugace je můžeme oddělit od krevní plazmy. Jak ukazuje obrázek, nejníže klesnou během centrifugace erytrocyty – podíl erytrocytů na celkovém objemu krve se nazývá hematokrit, jehož hodnoty se liší u mužů a u žen – muži: 44 ± 5 % a ženy: 39 ± 4 %. V prostoru mezi plazmou a erytrocyty se nalézají leukocyty a trombocyty tvořící bílou, neprůhlednou vrstvičku – tzv. buffy coat (tvoří asi 1 % z celkového objemu krve).
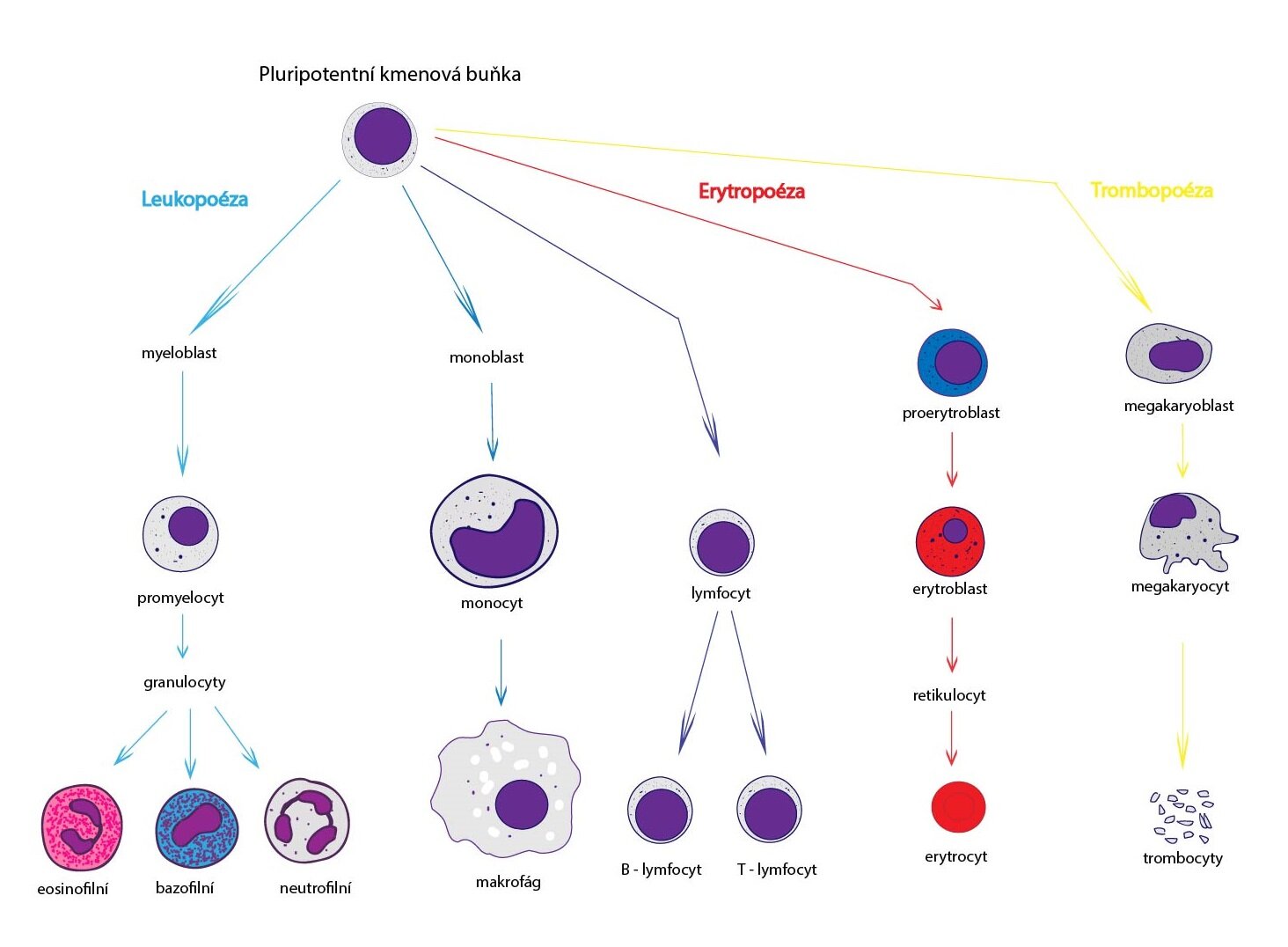
Stručný vývoj formovaných elementů, tedy hemopoéza
Všechny krevní elementy jsou odvozené od společné pluripotentní kmenové buňky. Polovina buněk zůstává v kostní dřeni a využívá se pro nové dělení. Druhá polovina se diferencuje v příslušné krevní buňky.
Erytropoéza – vývoj erytrocytů
Erytropoéza je děj, ve kterém probíhá vývoj erytrocytů přes několik stádií: proerytroblast – erytroblast – retikulocyt – erytrocyt. Cílem erytropoézy je vytvořit bezjaderné buňky s co největším povrchem pro výměnu krevních plynů a s dostatečným obsahem hemoglobinu. Posledním stádiem před samotným vznikem erytrocytu je retikulocyt, který oproti erytrocytu obsahuje navíc polyribozomy, které dotvářejí ještě zhruba 20 % z celkového množství hemoglobinu erytrocytu. V retikulocytech ještě také částečně probíhá aerobní fosforylace.
Trombopoéza – vývoj trombocytů
Trombocyty vznikají jako odštěpky cytoplazmy zralých megakaryocytů. Megakaryocyt je buňka dosahující rozměrů 35-150 μm, obsahující granulární endoplazmatické retikulum. Na buněčné membráně megakaryocytů dochází k početným invaginacím a oddělování trombocytů.
Krevní elementy
Erytrocyty (červené krvinky) – muži: 4,5-5,5 x 1012/l, ženy: 3,8-4,8 x 1012/l
Erytrocyty jsou bezjaderné krevní buňky bikonkávního tvaru, v průměru mají 7,2 μm (7,0-7,5 μm). Jejich tloušťka se pohybuje od 0,8 μm v nejtenčím místě (ve středu) do 2,1 μm v nejtlustším místě buňky (na okrajích), což podmiňuje jejich typické centrální projasnění. Objem erytrocytu (MCV) je 84-96 fl. Pokud mají erytrocyty průměr větší než 8 μm a MCV větší než 96 fl, mluvíme o makrocytech. Jestliže je průměr menší než 6 μm a MCV menší než 84 fl jedná se o mikrocyty.
Jedinečný bikonkávní tvar erytrocytu a jeho vysokou flexibilitu zajišťují fibrilární proteiny spektrin a ankyrin, které oba patří do skupiny periferních proteinů erytrocytární membrány (napojují se na intracelulární stranu membrány). α- a β-řetězce spektrinu nejdříve vytvářejí dimery, které dávají následně vznik tetramerům. Ty se váží na molekuly aktinu. Celkově vzniká na intracelulárním povrchu membrány erytrocytu jakési “lešení”.
Klinická korelace:
Poruchy struktury výše zmíněných proteinů erytrocytární membrány vedou ke vzniku několika onemocnění – tzv. dědičná sférocytóza (erytrocyt získá kulovitý tvar) či eliptocytóza (eliptický tvar). Obě onemocnění jsou spojena se sníženou rezistencí erytrocytů vedoucí k rozvoji hemolytické anémie.
Pro funkci erytrocytů jsou také důležité integrální bílkoviny jejich membrány. Za všechny jmenujme Na+/K+-ATPázu, GLUT-1 či HCO3–/Cl– antiport (výměna HCO3– za ionty Cl– , o jeho významu v přenosu krevních plynů pojednává Podkapitola 6/4)
Zralé erytrocyty neobsahují žádné organely nutné pro syntézu hemoglobinu. Adultní typ hemoglobinu (Hb A1) je protein složený ze dvou α- a dvou β-polypeptidových řetězců a molekul hemu, které obsahují ionty železa (Fe2+). Vazbou kyslíku vzniká oxyhemoglobin. Pokud se na Hb váže oxid uhličitý, vzniká karbaminohemoglobin. Dalece nejochotněji se však na Hb váže oxid uhelnatý – vzniká karboxyhemoglobin. Bližší informace o metabolismu hemoglobinu viz Podkapitola 6/4.
Hlavním zdrojem molekul ATP pro erytrocyty je glukóza. Její vstup do buňky probíhá usnadněnou difuzí nezávislou na hladině inzulinu v krvi. Glukóza je metabolizována procesem anaerobní glykolýzy, kde na jednu molekulu glukózy vznikají 2 molekuly ATP. Většina ATP se v erytrocytech spotřebuje na přenos iontů – např. během činnosti Na+/K+-ATPázy. Kromě zisku energie může být glukóza využita ke tvorbě 2,3-bisfosfoglycerátu (2,3-BPG), jenž vzniká v odbočce glykolýzy nazývané 2,3-BPG shunt/bypass (obchází se reakce katalyzovaná fosfoglycerátkinázou). Protože se obejde reakce, při níž vzniká ATP a v průběhu bypassu žádné ATP nevzniká, je výsledkem ztráta jednoho ATP na molekulu triózy.
2,3-BPG se váže na β-řetězce hemoglobinu, což vyvolá konformační změnu molekuly. Výsledkem je snížení afinity hemoglobinu ke kyslíku (blíže viz Podkapitola 6/4).
7-12 % molekul glukózy se nemetabolizuje v glykolýze, ale vstupuje do pentózového cyklu. Touto cestou získává erytrocyt redukované kofaktory NADPH. Ty využívá jednak v ochraně před reaktivními formami kyslíku, jednak pro udržení železa hemoglobinu v oxidačním stavu Fe2+. Jako příklad můžeme uvést enzym glutathionperoxidázu (GPx), jež redukuje za spotřeby redukovaného glutathionu H2O2 na vodu:
2 GSH + H2O2 → GS-SG + 2 H2O
2 GSH + R-O-OH → GS-SG + H2O + ROH
Regeneraci GS-SG na GSH zajišťuje glutathionreduktáza vyžadující NADPH:
GS-SG + NADPH + H+ → 2 GSH + NADP+
Rezistenci erytrocytů vůči reaktivním formám kyslíku podmiňuje více enzymů – např. i superoxiddismutáza či kataláza.
Superoxiddismutáza (SOD): O2• + O2• + 2 H+ → H2O2 + O2
Kataláza (CAT): H2O2 + H2O2 → 2 H2O + O2
Klinická korelace:
Některé enzymatické defekty vedou ke vzniku hemolytických anémií. Jako příklad můžeme uvést deficit glukóza-6-fosfátdehydrogenázy (neboli favismus) či deficit pyruvátkinázy. Deficit glukóza-6-fosfátdehydrogenázy je považován za celosvětově nejrozšířenější enzymatický defekt – počet postižených se odhaduje na 400 miliónů osob (převážně v Africe, Středomoří, Středním Východě a v Asii).
Erytrocyty přežívají v cirkulaci přibližně 120 dní. Postupně se stávají méně pružnými, deformují se a k jejich destrukci dochází ve slezině pomocí tamních makrofágů.
Leukocyty (bílé krvinky) – 4-11 x 109/l
Dle tvaru jádra a typu granul se dělí na granulocyty (tvoří kolem 70 % všech leukocytů) a agranulocyty. Granulocyty obsahují segmentované jádro a granula v cytoplazmě, která váží různá barviva. Podle barvitelnosti granul můžeme rozlišit granulocyty neutrofilní, eozinofilní a bazofilní. Agranulocyty naopak granula neobsahují a dělíme je na lymfocyty a monocyty.
Neutrofilní granulocyty (neutrofily, polymorfonukleáry)
Neutrofily tvoří 60-70 % cirkulujících leukocytů. V krevním oběhu se vyskytují 6-12 hodin, ve tkáních 4-5 dní. Jejich přestup z krve do tkání zprostředkovávají povrchové adhezivní proteiny – tzv. integriny, které napomáhají adhezi neutofilů na cévní stěnu (endotelie). Základní funkcí neutrofilů je fagocytóza – nazýváme je jako tzv. mikrofágy. Fagozóm s fagocytovanými částicemi splývá s lyzosomem a vytváří fagolyzosom.
Neutrofily mají segmentované jádro spojené chromatinem – zralé neutrofily mají 2-5 segmentů, proto také název polymorfonukleáry. Nejmladší formy neutrofilů nemají segmentované jádro, a proto se o nich mluví jako o tyčích. Jestliže má jádro více než 5 segmentů, jedná se o hypersegmentované jádro, které se vyskytuje u starých buněk. Pokud převládají buňky s málo segmentovaným jádrem (jedná se o nezralé neutrofily), hovoříme o tzv. posunu doleva. Posun doprava by se vyskytoval při nadměrném zastoupení právě výše zmíněných hypersegmentovaných neutrofilů.
Neutrofily obsahují v cytoplazmě dva druhy granul – specifická a azurofilní (liší se barvitelností). Specifická granula obsahují alkalickou fosfatázu, kolagenázy, lysozym a bazické proteiny. Azurofilní granula jsou primární lyzosomy obsahující mnoho hydrolytických enzymů. Pro správnou funkci neutrofilů je tedy nutný vysoký obsah enzymů nezbytných pro degradaci jimi fagocytovaných částic. Z proteolytických enzymů můžeme jmenovat elastázu, kolagenázu či katepsin G. Protože jejich excesivní aktivita by mohla vést k poškození organismu, vytváří naše tělo tzv. inhibitory proteáz, které jsou schopny činnost proteáz inhibovat. Některé plazmatické proteiny patří mezi významné inhibitory proteáz – jako příklad můžeme uvést a1-antitrypsin, a1-antichymotrypsin či a2-makroglobulin.
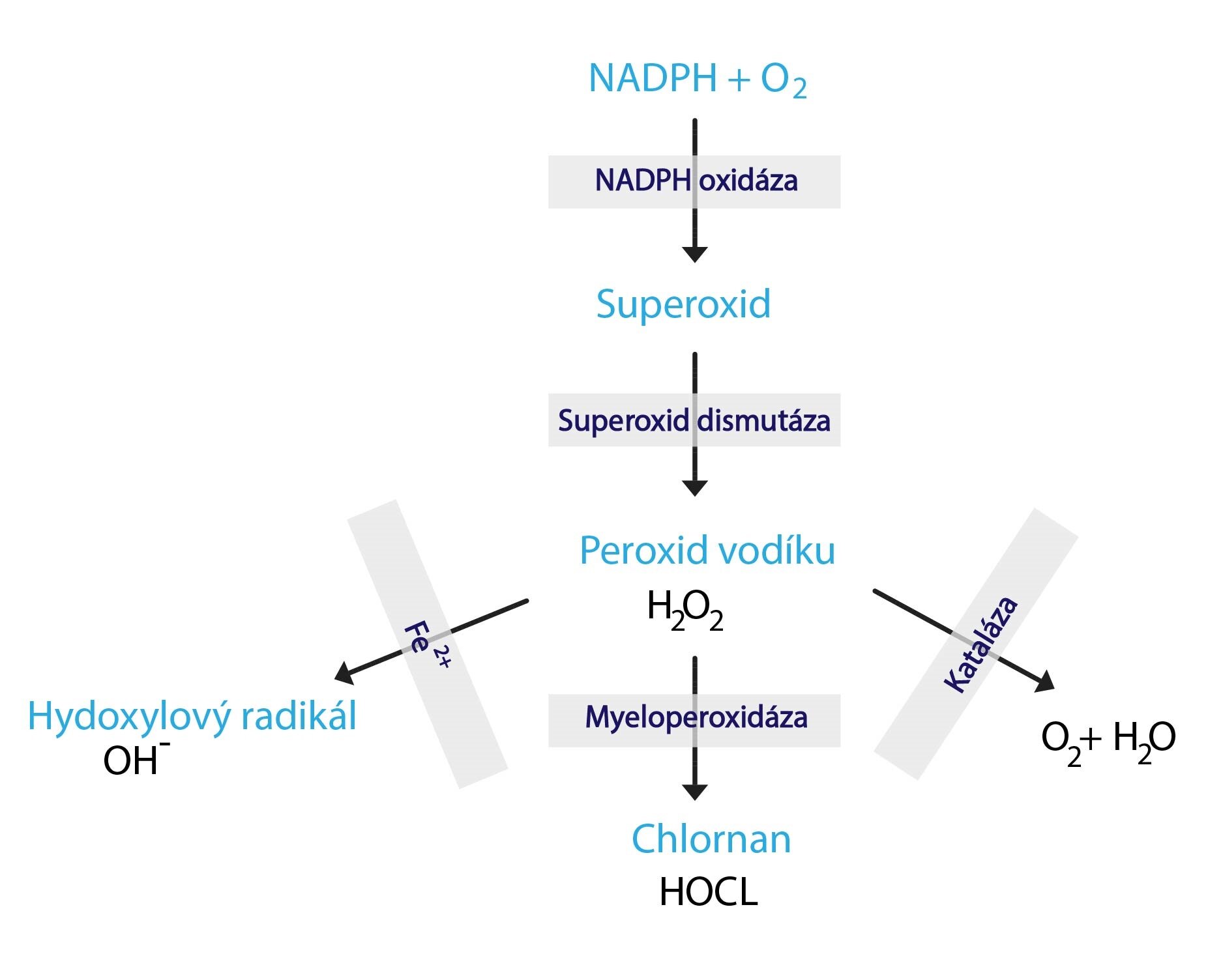
Metabolismus neutrofilních granulocytů je podobně jako v případě erytrocytů závislý na glukóze. Tu jednak využívají k zisku energie (glykolýza atd.), jednak slouží jako zdroj NADPH (pentózový cyklus). Efektivní funkce neutrofilů vyžaduje jejich tzv. aktivaci, při níž narůstá spotřeba kyslíku a glukózy (hovoříme o respiračním vzplanutí). Enzymatický aparát neutrofilů (NADPH-oxidáza, superoxiddismutáza atd.) přitom zajišťuje tvorbu kyslíkových radikálů (např. superoxid či hydroxylový radikál). Za zmínku stojí i enzym myeloperoxidáza, jež katalyzuje reakci H2O2 s Cl– za vzniku reaktivních chlornanů – ClO–. Ty vykazují významné oxidační účinky, čímž napomáhají zabíjení fagocytovaných bakterií.
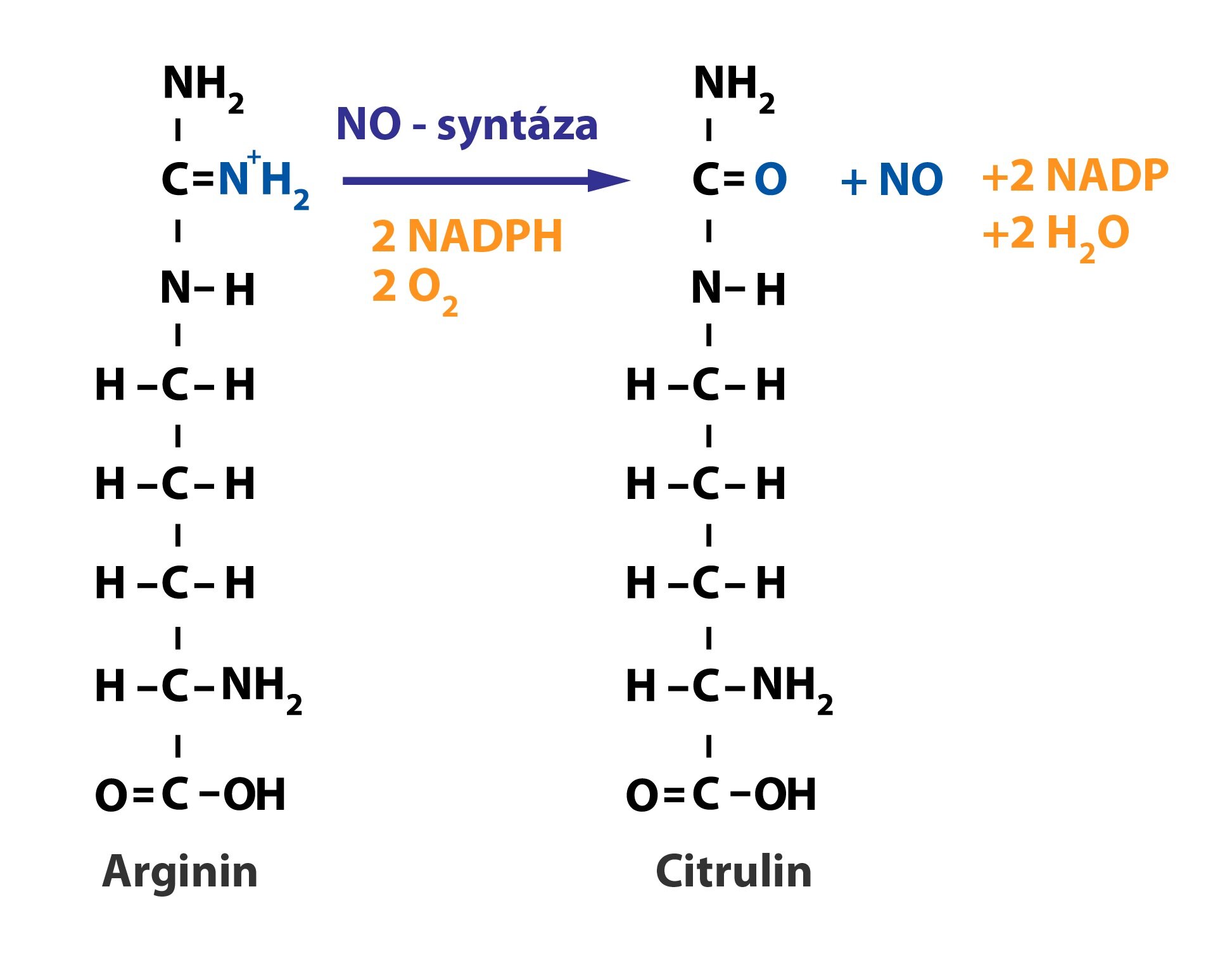
Kromě reaktivních forem kyslíku vznikají v neutrofilech i reaktivní formy dusíku – např. oxid dusnatý, jehož tvorbu z argininu katalyzuje NO-syntáza (NOS).
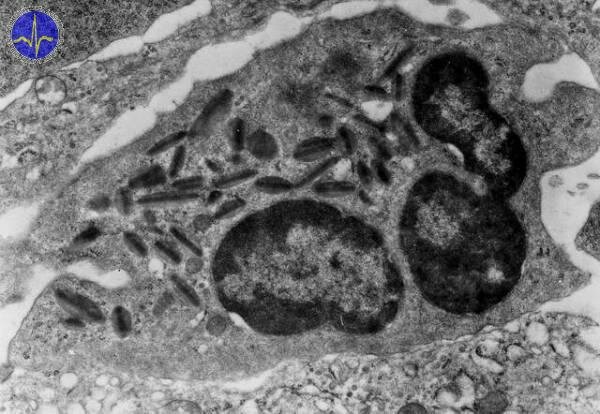
Eosinofilní granulocyty (eosinofily)
Eosinofily tvoří 2-4 %. Jejich počet v periferní krvi přes den kolísá. Obsahují segmentované jádro se dvěma segmenty (tzv. brýlovité jádro) a specifická granula. Jsou schopny fagocytózy ovšem méně než neutrofily. Jejich množství se zvyšuje při parazitárních a alergických onemocněních.
Eosinofil
Bazofilní granulocyty (bazofily)
Bazofily tvoří asi 1 % všech leukocytů. V cytoplazmě obsahují specifická granula a jádro, které je rozděleno do nepravidelných laloků. Jejich granula obsahují histamin a heparin. Histamin vzniká dekarboxylací histidinu (je to tedy biogenní amin). Prudké uvolnění granul, neboli degranulace, může vést až k rozvoji anafylaktického šoku.
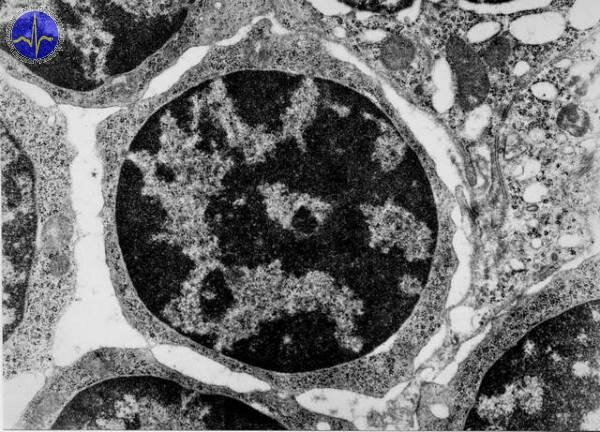
Lymfocyty
Lymfocyty tvoří u dospělého 25-30 % z celkového počtu leukocytů. Rozdělují se na B-lymfocyty (diferenciace v kostní dřeni) a T-lymfocyty (diferenciace v thymu) a NK-buňky („natural killers cells“).
Lymfocyt
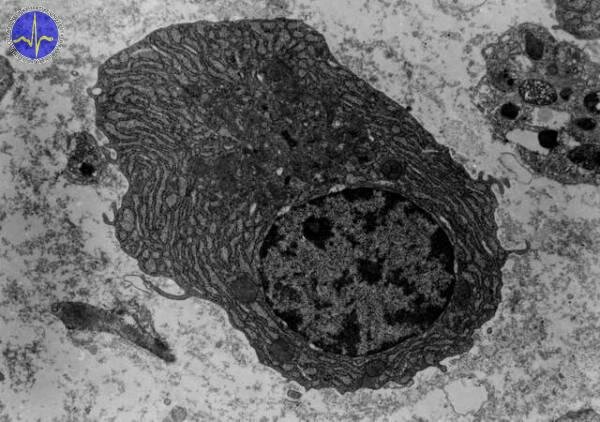
B-lymfocyty mají vztah k humorální (protilátkové) imunitě a T-lymfocyty k buněčné (celulární) imunitě. Rozlišujeme dvě skupiny T-lymfocytů dle povrchových CD molekul: Th-lymfocyty (pomocné) a Tc-lymfocyty (cytotoxické). Efektorovými buňkami B-lymfocytů jsou plazmatické buňky, které produkují imunoglobuliny.
Plazmatická buňka
NK-buňky likvidují nádorové buňky a buňky napadené viry.
Monocyty
Monocyty představují 3-8 % celkového počtu leukocytů. Cirkulující monocyty jsou prekurzory buněk, které patří do monocyto-makrofágového systému. Ve vazivové tkáni se diferencují na makrofágy. Podobně jako neutrofilní granulocyty patří i monocyty mezi profesionální fagocyty.
Trombocyty (krevní destičky) – 150-300 x 109/l
Jedná se o fragmenty megakaryocytů z kostní dřeně. Pokles počtu destiček pod fyziologickou mez se označuje jako trombocytopenie, vzestup jako trombocytóza. 2/3 kolují v krvi a zbylá 1/3 se nachází ve slezině. Destičky obsahují alfa granula důležitá pro krevní srážlivost, dále denzní granula a lyzosomy s enzymy. Hrají nezastupitelnou roli v procesu krevního srážení. Bližší informace viz Podkapitola 5/4.
_
Krevní skupiny
Na lidských erytrocytech bylo objeveno více než 30 antigenně významných molekul a další stovky molekul, jejichž jednotlivý význam není tak velký. Karl Landsteiner se na počátku 20. století zaměřil na častá úmrtí pacientů po krevních transfuzích a na základě svých experimentů popsal tři krevní skupiny A, B a C, za což později dostal Nobelovu cenu. Stanovil, že pacient může dostat pouze krev stejné skupiny jako je ta jeho, jinak umírá. Dnes víme, že se jedná o reakci imunitního systému příjemce, který napadá erytrocyty s neznámými antigeny, jelikož je považuje za potencionální patogenní hrozbu. Americká lékařská komise ve 20. letech 20. století dala jako objeviteli krevních skupin přednost českému psychiatrovi Janu Jánskému, který sice objev učinil až později, ale nezávisle na Landsteinerovi popsal všechny čtyři krevní skupiny, které označil jako I, II, III a IV.
AB0 systém
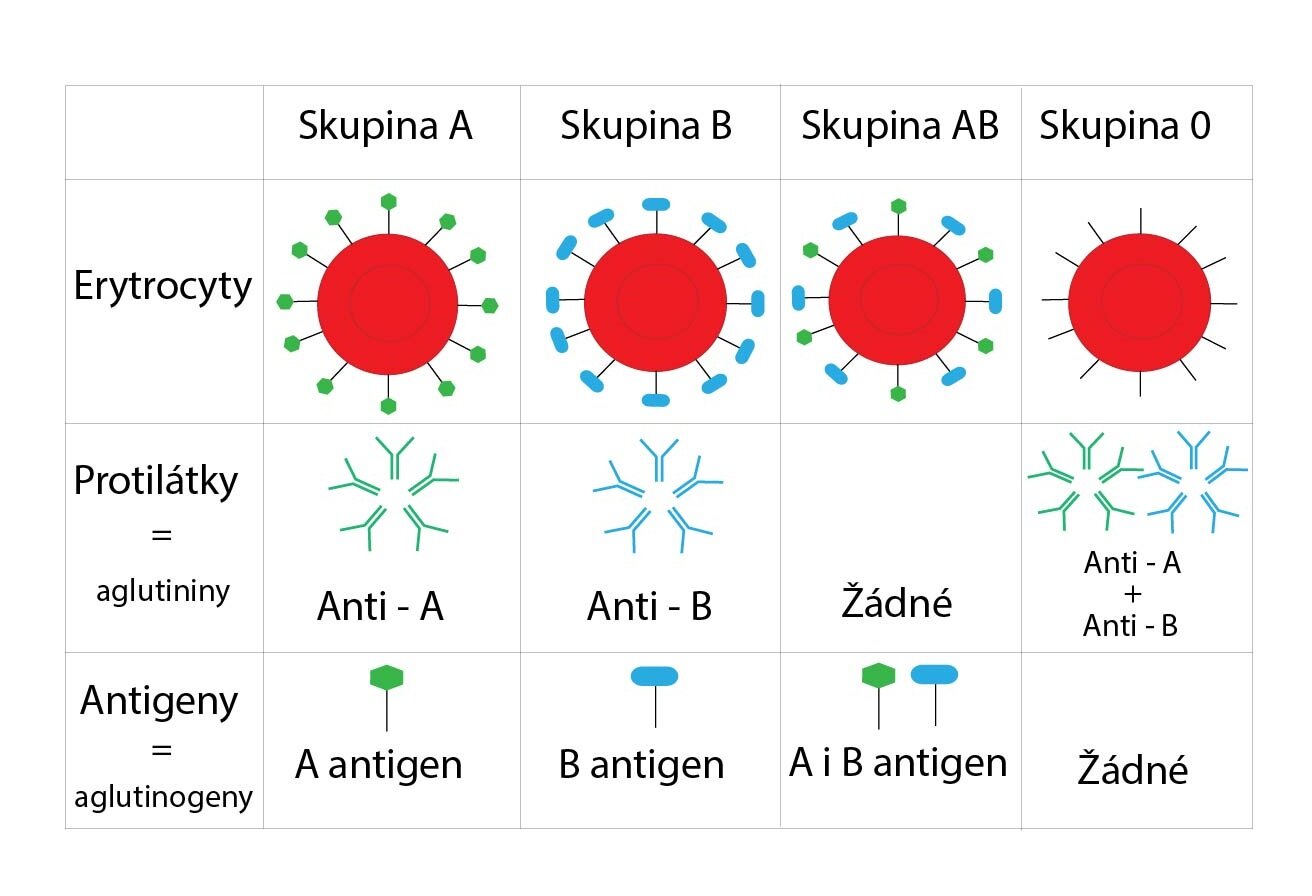
AB0 systém je nejdéle známý a zároveň antigenně nejvýznamnější systém. Jedná se o systém dvou antigenů A a B, které erytrocyty vystavují na svém povrchu. Tyto antigeny se také nazývají aglutinogeny, díky své schopnosti shlukovat erytrocyty za přítomnosti příslušné protilátky. Chemicky se jedná o glykolipidy. Jejich sacharidová část určuje antigenní typ.
Geneticky se od sebe jedinci liší genem na 9. chromosomu, který kóduje enzym, jenž katalyzuje syntézu terminální sacharidové části glykolipidu. Alely genu pro enzym skupin A a B (tzv. transferáza A respektive B) jsou kodominantní. Dále existuje recesivní alela H, která kóduje nefunkční enzym. Mohou tedy nastat celkem čtyři možnosti:
1) Jedinec má krevní skupinu A – jeho genotyp pak tvoří kombinace alel AA nebo AH
2) Jedinec má krevní skupinu B – jeho genotyp je tvořen kombinací alel BB nebo BH
3) Jedinec má krevní skupinu AB – jeho genotyp je tvořen kombinací AB
4) Jedinec má krevní skupinu 0 – má tedy dvě recesivní alely HH
Zastoupení jednotlivých krevních skupin je v Evropě následující:
Krevní skupina A – 45 % populace
Krevní skupina B – 16 % populace
Krevní skupina AB – 6 % populace
Krevní skupina 0 – 33 % populace
Kromě přítomnosti aglutinogenů na povrchu mají všichni jedinci (vyjma 6 % populace se skupinou AB) v krevní plazmě přítomny protilátky proti aglutinogenům – aglutininy. Aglutininy se tvoří právě proti tomu aglutinogenu, který daný jedinec na povrchu svého erytrocytu nevystavuje, neboli není mu vlastní. Aglutininy značíme dle toho, ke kterému aglutinogenu mají nejvyšší afinitu. Tak například aglutinogen A je napadán Anti-A aglutininem.
Proto platí, že:
1) Jedinec s krevní skupinou A má Anti-B aglutinin
2) Jedinec s krevní skupinou B má Anti-A aglutinin
3) Jedinec s krevní skupinou AB nemá v plazmě žádné protilátky proti aglutinogenům
4) Jedinec s krevní skupinou 0 má jak aglutinin Anti-A tak Anti-B
Kvůli těmto vlastnostem byla skupina AB považována z univerzálního příjemce, neboť imunitní systém příjemce neměl aglutininy a neútočil na erytrocyty dárce. Skupina 0 byla považována za univerzálního dárce, neboť na erytrocytech nevystavuje aglutinogeny, které by mohly být rozeznány aglutininy příjemce. Od této praxe se ale upustilo, neboť existuje celá řada dalších systémů krevních skupin a konstrukt univerzálního dárce nebo příjemce se často ukázal jako velmi nebezpečný. V dnešní době je zcela nepřípustný.
Rh systém
Rh systém je pojmenován podle Makaka rhesus (Macaca mulatta), u kterého byl objeven a poprvé popsán. Podobně jako u AB0 systému se jedná o antigenní molekuly vystavené na povrchu erytrocytu, suspektní k napadení imunitním systémem. Na rozdíl od AB0 jsou geny pro Rh systém uloženy na krátkém raménku 1. chromozomu a jejich alely jsou vysoce polymorfní. K dnešnímu dni je známo více než 40 různých alel. Nejvýznamnějšími antigeny, které patří do Rh systému, je následujících 6 molekul značených písmeny: C, D, E, c, d, e. Jak již značení napovídá těchto 6 molekul je kódováno třemi páry alel, které jsou vzájemně dominantní. Tzn. jedinec s antigenem C nebude vystavovat antigen c a vice versa.
Za antigenně nejsilnější je považován antigen D. Dle něj se také určuje Rh pozitivita (Rh+), či negativita (Rh-). 85 % populace je Rh+. Do této kategorie patří jak dominantní homozygoti (DD), tak heterozygoti (Dd). 15 % populace je Rh-. Jedná se pouze o recesivní homozygoty (dd).
Dalším rozdílem mezi systémem AB0 a Rh je existence protilátek. Tam, kde u AB0 existují tzv. přirozené protilátky, které se vytvoří během novorozeneckého období, jsou u Rh systému reaktivní protilátky. To znamená, že v plazmě Rh- jedinců najdeme protilátky anti-D pouze pokud přišli do kontaktu s krví Rh+ jedinců.
Tato situace je problematická zejména u matek multipar, které jsou Rh-. Pokud je plod Rh+ (zdědil dominantní D alelu od otce), tak během prvního porodu dojde k senzibilizaci matky a ke tvorbě anti-D protilátek. Při porodu totiž určitému množství fetální krve proniká do oběhu matky. K senzibilizaci může dojít i při potratech Rh+ plodu či při transfuzi Rh+ krve (k čemuž by nemělo dojít). Během dalších těhotenství jsou následně napadány erytrocyty Rh+ plodu, neboť anti-D protilátky (třídy IgG) mají tu vlastnost, že procházejí přes placentu do fetálního oběhu. Erytrocyty napadené anti-D protilátkami zanikají a uvolňují do plazmy velké množství hemoglobinu. Uvolněný hemoglobin je v retikuloendoteliálním systému přeměňován na bilirubin, který způsobuje žloutenku novorozenců. Při překročení určité koncentrace poškozuje bilirubin CNS – precipituje v některých strukturách mozku, které jsou tím nevratně poškozeny. Hovoříme pak o tzv. kernikteru. Většina Rh+ novorozenců, jejichž Rh- matky nebyly pod dohledem gynekologa, případně nebyly adekvátně léčeny, umírá následkem anemie. V těžkých případech umírá plod již in utero. Všechny tyto stavy jsou různé varianty tzv. hemolytické nemoci novorozenců. Senzibilizaci matky a tedy i riziku poškození plodu se předchází včasným (do 72 hodin) podáním anti-D protilátek matce, které zabrání tvorbě vlastních protilátek v těle matky.
Autoři podkapitoly: Martina Šajdíková a Josef Fontana