Náplň podkapitoly:
1. Úvod do hemostázy
2. Role destiček v hemostáze
3. Hemokoagulace
4. Vyšetření hemostázy
_
Úvod do hemostázy
Naše cirkulace vykazuje za fyziologických podmínek dvě charakteristiky. Jedná se jednak o nesmáčivost endotelií cévní stěny, jednak o tekutost (fluiditu) krve. Při procesu hemostázy, neboli zástavě krvácení, dochází ke změně obou těchto charakteristik. Hemostáza je ochranný mechanismus zacelující poškození vznikající v cirkulaci a její bezchybný průběh je zcela nezbytný pro naše přežití. V každém okamžiku totiž dochází v naší cirkulaci k méně či více závažným poškozením, jež si vyžadují zacelení a následnou reparaci. Samostatnou kapitolu tvoří rozsáhlá krvácení vznikající během traumat či lékařských zákroků. Kromě tohoto příznivého efektu, má ale hemostáza i svoji odvrácenou tvář. Některá onemocnění, či jejich komplikace totiž vznikají v důsledku dysbalance hemostázy. Na tomto místě můžeme zmínit například dysbalanci hemostázy u závažných infekcí (sepse), nádorů či na povrchu ateromových plátů (tady často vede ke vzniku krevní sraženiny – trombu, který může vyústit až v zástavu krevního průtoku – infarkt).
Dále v textu budeme užívat dva podobné pojmy – hemostáza a hemokoagulace, jež ale nejsou synonyma. Hemostáza zahrnuje všechny fáze zástavy krvácení, zatímco hemokoagulace představuje jen jednu z těchto fází. Souhrnně můžeme rozlišit čtyři fáze zástavy krvácení:
1) Reflexní vazokonstrikce
2) Adheze, aktivace a agregace destiček
3) Hemokoagulace
4) Trombolýza a reparace poškození
Hemokoagulace, neboli srážení krve, je proces, kdy se z tekuté krve stává sraženina. Za touto přeměnou stojí kaskáda koagulačních faktorů, které vytvářejí poměrně složitý systém vzájemných vztahů. Za vyvrcholení tohoto procesu můžeme považovat přeměnu rozpustné plazmatické bílkoviny fibrinogenu na nerozpustný fibrin katalyzovanou enzymem trombinem. Fibrin následně vytváří odolnou fibrinovou síť.
Reflexní vasokonstrikce
Zjednodušeně se dá říci, že poranění cévní stěny vyvolá podráždění její hladké svaloviny, které vede k reflexní vasokonstrikci. Kromě tohoto prostého, ale současně velmi významného mechanismu, se na vasokonstrikci podílí celá řada látek. Za všechny můžeme jmenovat například tromboxan A2 (TXA2) či serotonin, jež oba jsou tvořeny trombocyty, které skrze ně posilují reflexní vasokonstrikci.
_
Role destiček v hemostáze
Destičky, neboli trombocyty, vznikají jako bezjaderné fragmenty megakaryocytů. Jejich fyziologická hladina v krvi činí 150-400 x 103 / μl. V jejich struktuře můžeme rozlišit jednak centrální zónu s granuly – tzv. granulomera, jednak a periferní světlejší hyalomeru. Tato je podmíněna invaginacemi membrány tvořící systém kanálků, jež hrají roli v sekreci (obsahuje například enzymy pro tvorbu eikosanoidů). Granulomera obsahuje tři typy granul:
1) δ-granula (densní tělíska): ATP, ADP, Ca2+ a serotonin
2) α-granula: fibrinogen, PDGF (Platelet Derived Growth Factor), FGF, vWF (von Willebrandův faktor), destičkový faktor 4 (fosfolipidy)
3) λ-granula – lyzosomy
Látky obsažené v granulech se uplatní při vazokonstrikci v místě poranění, hemokoagulaci i následné reparaci poškození.
Protože jsou trombocyty bezjaderné, nemůže v nich probíhat žádná proteosyntéza. Jejich některé organely naopak vykazují velmi intenzivní metabolismus (MIT, GA). Hlavním zdrojem energie trombocytů je glukóza využívaná v procesu aerobní glykolýzy. Cytoplazma trombocytů obsahuje mnoho molekul, které podmiňují kontraktilitu destiček – např. mikrotubuly, aktin či myosin. Kontrakcí jednak dochází k retrakci trombu, jednak k uvolnění obsahu destičkových granul.
Na procesech krevního srážení se uplatňují i destičkové fosfolipidy (např. tzv. PF 3 – platelet factor 3). Destičky je vystavují během své aktivace pomocí flip/flop mechanismu. Fosfolipidy umožňují komplementaci a kooperaci koagulačních faktorů, na vazbě se podílejí i Ca2+ ionty a γ-karboxyglutamát vyskytující se v molekulách daných koagulačních faktorů. Výsledkem je vznik enzymových komplexů na povrchu aktivovaných trombocytů, jenž podmiňuje přesné zacílení hemostázy.
Trombocyty a hemostáza
Trombocyty se účastní celého průbehu hemostázy. Pokud bychom ale měli zdůraznit jednu fázi, tak hrají zcela klíčovou roli v primární hemostáze. Nyní si postupně probereme zapojení destiček.
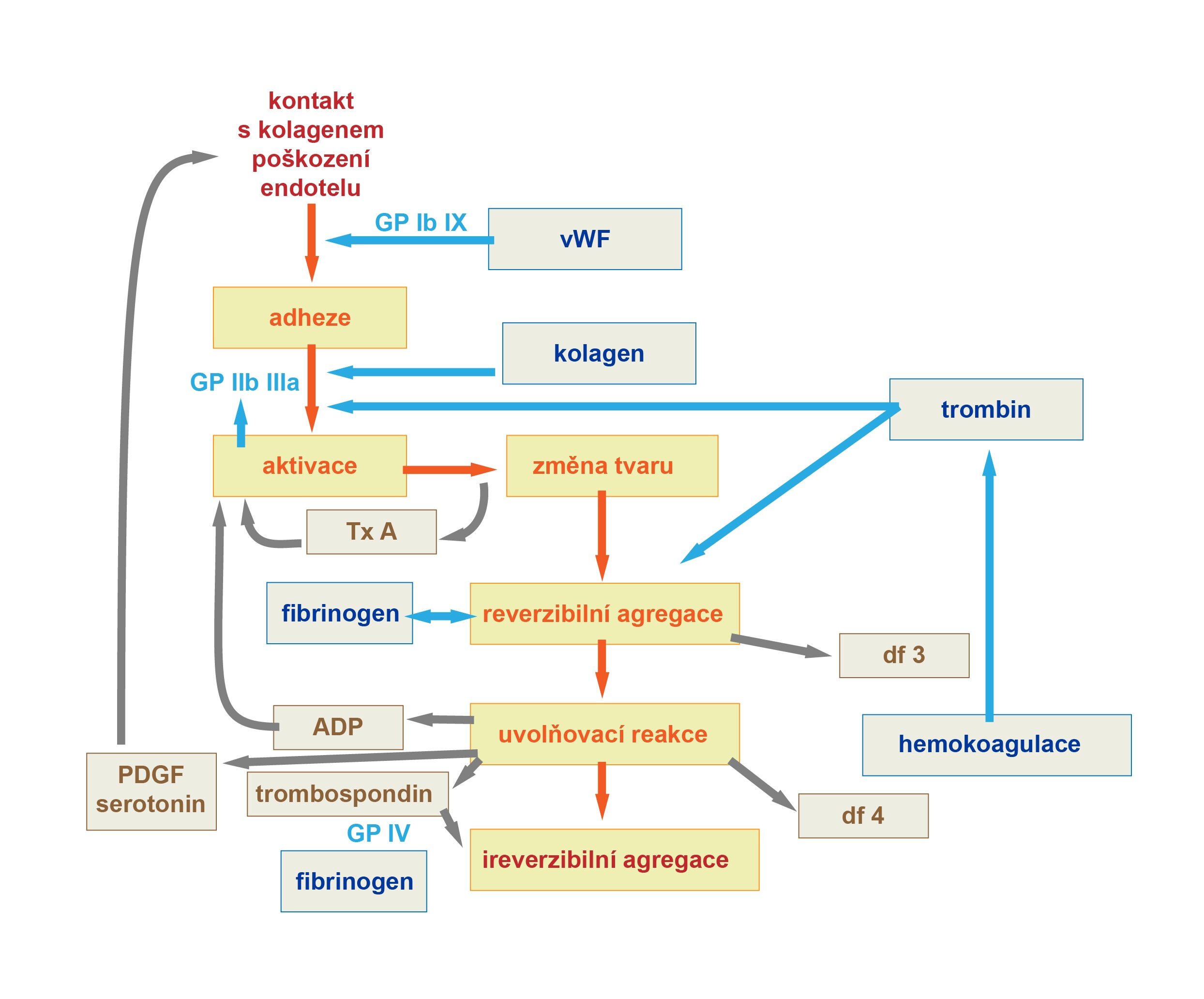
1) Adheze destiček
Adheze je podmíněna vazbou na poraněním obnažený sudoteliální kolagen. Tuto vazbu zprostředkovává von Willebrandův faktor (vWF), jež propojuje kolagen a destičkový glykoprotein Ib (GP Ib). Adheze je jedním z faktorů vedoucí k aktivaci destiček.
2) Aktivace destiček
Trombocyty jsou aktivovány prostřednictvím mnoha faktorů. Za všechny jmenujme obnažený kolagen, trombin, ADP, PAF či TXA2. Aktivace destiček vede k nekolika významným důsledkům:
a) Exprese receptorů GP IIb/IIIa (až 100 000 na jednom trombocytu)
b) Sekrece aktivních látek – např. TXA2
c) Změna tvaru (kontraktilní bílkoviny a cytoskelet) – tvar trombocytu se mění z diskovitého na ameboidní
Procesy nastartované aktivací destiček umožní agregaci destiček.
Klinická korelace:
Velký klinický význam má skutečnost, že tvorba tromboxan A2 je velmi efektivně inhibována kyselinou acetylsalicylovou (KAS), která se vyskytuje v mnoha lécích – např. Acylpyrin a Aspirin (k tlumení horečky a bolesti) či Anopyrin. Anopyrin obsahující nízkou dávku KAS (75-150 mg, nejčastěji 100 mg) patří mezi nejčastěji předepisovaná léčiva – užívá ho většina osob, kteří prodělali některé závažné kardiovaskulární onemocnění. Snižuje totiž riziko vzniku trombů, čímž současně snižuje riziko vzniku infarktu myokardu či cévní mozkové příhody.
3) Agregace destiček a degranulace
Agregaci trombocytů podporuje mnoho faktorů (ADP, TXA2 či trombin z koagulační kaskády). Destičky se vzájemně propojují prostřednictvím molekul fibrinogenu a von Willebrandova faktoru, jejichž receptory jsou destičkové GP IIb/IIIa (jejich exprese se zvyšuje během aktivace trombocytů).
Agregaci destiček můžeme dělit na primární (reverzibilní) a sekundární (irreverzibilní) agregaci. Primární agregace slouží k zacelování stále se tvořících skulinek v endotelu a zacelování malých defektů v cirkulaci. Sekundární agregace je spojena s uvolňovací reakcí, neboli degranulací, a startuje se při zacelování významnějších defektů. Degranulací se uvolňuje obsah destičkových granul (přehled granul viz výše v textu), což posiluje všechny fáze zástavy krvácení.
Agregace destiček vede k tvorbě tzv. bílého (destičkového) trombu, neboli provizorní hemostatické zátce. Dochází při tom k rozpadu a splynutí destiček (viskózní metamorfóza).
4) Propojení s koagulací
Činnost destiček a koagulační kaskády je propojena na mnoho místech a má vysoký funkční význam. Během aktivace a degranulace vylučují či exprimují destičky látky, které posilují proces koagulace. Můžeme například uvést expresi destičkových fosfolipidů (DF 3) na jejich povrchu.
5) Hojení poranění
Trombocyty také zasahují do procesu reparace poranení cévní stěny. Sekretují totiž látky s proliferativními účinky – např. PDGF (Platelet Derived Growth Factor).
Faktory ovlivňující aktivaci a agregaci destiček
V lidském těle se vyskytuje mnoho látek, které dokáží modulovat funkce destiček. Zde se omezíme jen na ty nejvýznamnější z nich. Zdravé a nestresované endotelové buňky brání adhezi trombocytů tím, že produkují inhibitory funkce destiček a vazodilatátory – řadíme mezi ně například prostacyklin (PGI2) či oxid dusnatý – NO (EDRF). Na opačné straně stojí tzv. PAF (Platelet Activating Factor, faktor aktivující destičky), jenž je uvolňován při infekčních a zánětlivých procesech z buněk imunitního systému (neutrofilů, bazofilů a makrofágů), endotelu i trombocytů. Významnou roli hrají i pozitivní zpětnovazebné smyčky samotných destiček, které umožňují rychlou a efektivní agregaci – TXA2 a ADP.
_
Hemokoagulace
Jak jsme již uvedli výše, hemokoagulace (srážení krve) slouží k tomu, aby z tekuté krve na přesně lokalizovaném místě stala sraženina, jež zacelí místo defektu. K tomu účelu se v krvi (a některých buňkách) vyskytují koagulační faktory, které souhrnně vytvářejí tzv. koagulační kaskádu. Většina koagulačních faktorů jsou proteiny produkované játry. Poměrně velká skupina faktorů patří do skupiny serinových proteáz – svou činností (tzv. parciální proteolýza) dokáží štěpit a zároveň aktivovat další koagulační faktory. Za jeden z hlavních cílů koagulační kaskády můžeme považovat přeměnu rozpustného plazmatického proteinu fibrinogenu na nerozpustný fibrin (katalyzuje trombin), který následně vytváří vysoce odolnou fibrinovou síť.
V současné době se můžete v knihách setkat se dvěma modely koagulace – tzv. starý a nový (revidovaný) model koagulace. Každý z modelů má určitá pro a proti, které se zde v krátkosti pokusíme předestřít.
Za hlavní benefit starého modelu můžeme považovat usnadnění porozumění in vitro měření parametrů hemokoagulace (jsou podrobně probrány na konci této podkapitoly). Jeho nevýhodu je bohužel fakt, že jím popsaný průběh hemokoagulace neodpovídá zcela přesně jejímu průběhu v lidském těle a současně že nedokáže objasnit některé patologické stavy, které ji postihují. Starý model je založen na popisu kaskádovité aktivace koagulačních faktorů, která je rozdělena na tzv. vnitřní a vnější cestu (systém) a společnou část. Starý model současně zdůrazňuje význam vnitřního systému v koagulaci.
Nový (revidovaný) model vychází ze starého modelu hemokoagulace. Jeho hlavní výhodou je, že dokáže poměrně přesně objasnit procesy probíhající in vivo a to včetně většiny patologických stavů. Nový model je založen na popisu tří fází koagulace – tzv. iniciace, amplifikace a propagace. Současně přiznává klíčovou roli vnějšímu systému a trombinu.
Koagulační faktory
Koagulační faktory představují velkou skupinu látek, kde každý její člen má poměrně specifické místo v procesu hemokoagulace. Většina z nich jsou proteiny. Jednotlivé faktory mají jednak své jméno, jednak nesou označení pomocí římských číslic. Toto se často používá ve schématech i v klinické praxi, a proto je nutné aby se studenti naučili obojí. Podobně jako v případě většiny ostatních plazmatických bílkovin je i většina koagulačních faktorů produkována v játrech. Proto nepřekvapí, že onemocnění jater jsou často komplikována poruchami srážení krve. Zdrojem von Willebrandova faktoru jsou trombocyty, endoteliální buňky a subendoteliální vazivová tkáň. Poločasy většiny koagulačních faktorů v plazmě jsou poměrně krátké.
Tabulka č.x – Přehled koagulačních faktorů
| I | Fibrinogen | VIII | Antihemofilický |
| II | Protrombin*1) | IX | Christmasův*1) |
| III | Tkáňový tromboplastin | X | Stuart-Prowerové*1) |
| IV | Vápenaté ionty | XI | PTA (plasma thrombin antecedent)1) |
| V | Proakcelerin | XII | Hagemanův1) |
| VII | Prokonvertin*1) | XIII | Fibrin stabilizující |
* vitamin K dependentní faktory
1) proteázový zymogen
Podle jejich rozdílné funkce v procesu krevního srážení můžeme koagulační faktory rozdělit do pěti základních skupin:
1) Serinové proteázy – katalyzují parciální proteolýzu koagulačních faktorů
2) Bílkoviny sloužící jako kofaktory enzymů
3) Ca2+– napomáhá vazbě některých koagulačních faktorů na membránové fosfolipidy
4) Fibrinogen – prekurzor fibrinové sítě
5) Transglutamináza – f. XIII – stabilizuje fibrinovou síť
Vitamin K dependentní faktory
Několik koagulačních faktorů vyžaduje pro svoji plnohodnotnou syntézu spoluúčast vitaminu K – hovoříme proto o vitamin K dependentních faktorech. Jedná se jednak o faktory II, VII, IX a X, jednak o antikoagulační faktory protein C a S. Tyto faktory patří převážně do skupiny serinových proteáz (protein S je kofaktorem proteinu C). Role vitaminu K spočívá v umožnění posttranslační γ-karboxylace (probíhá na γ-uhlíku) několika zbytků glutamátu v molekule za vzniku γ-karboxyglutamátů (Gla). Ty mohou vázat Ca2+, což napomáhá vazbě výše uvedených faktorů k membránovým fosfolipidům.
Klinická korelace:
Při nedostatku vitaminu K je γ-karboxylace koagulačních faktorů defektní a jejich vazba k membránovým fosfolipidům je oslabena – výsledkem je porucha koagulace.
V klinické praxi se využívají analoga vitaminu K (např. warfarin), která blokují jeho účinek. Podávají se při léčbě onemocnění, kdy je žádoucí oslabit koagulační kaskádu.
von Willebrandův faktor (vWF)
Von Willebrandův faktor představuje komplex glykoproteinů, který v plazmě vytváří multimery různých velikostí (větší multimery jsou efektivnější). Je skladován v destičkách a endotelových buňkách. Von Willebrandův faktor tvoří spolu s faktorem VIII v plazmě komplex – vWF tedy slouží jako nosič a ochrana f. VIII. Kromě tohoto, slouží vWF jako “lepidlo” mezi trombocyty a poškozenou cévou (interakce kolagenu a GP Ib na destičkách) i mezi trombocyty navzájem (interakce destičkových GP IIb/IIIa).
Starý model koagulace
Ačkoliv je starý model koagulace již překonán, budeme mu zde věnovat poměrně velký prostor. To jednak proto, že nový model z něj vychází, jednak proto, že vysvětluje interpretaci nejčastěji užívaných laboratorních vyšetření, se kterými se většina z vás v praxi setká. Nejdříve si ale v krátkosti připomeňme předešlé fáze hemostázy.
Poranění cévní stěny vyvolá podráždění její hladké svaloviny, které vyvolá k reflexní vasokonstrikci. Defekt obnaží hlouběji uložený kolagen, na který prostřednictvím vWF a GP Ib adherují destičky. Působením mnoha faktorů se trombocyty aktivují, což podmíní jejich významné změny – expresi receptorů GP IIb/IIIa, sekreci aktivních látek a změnu jejich tvaru. Důsledkem je jednak posílení vasokonstrikce (TXA2, serotonin atd), jednak agregace trombocytů (GP IIb/IIIa) – vzniká bílý (destičkový) trombus (primární hemostatická zátka). V mnoha případech jsou uvedené procesy dostatečně účinné a vedou k zacelení defektu v cirkulaci. Pokud je ale poškození příliš rozsáhlé, či výše uvedené mechanismy z jakéhokoliv důvodu neefektivní, dochází k nastartování hemokoagulace, jež vyústí v tvorbu odolné fibrinové sítě.
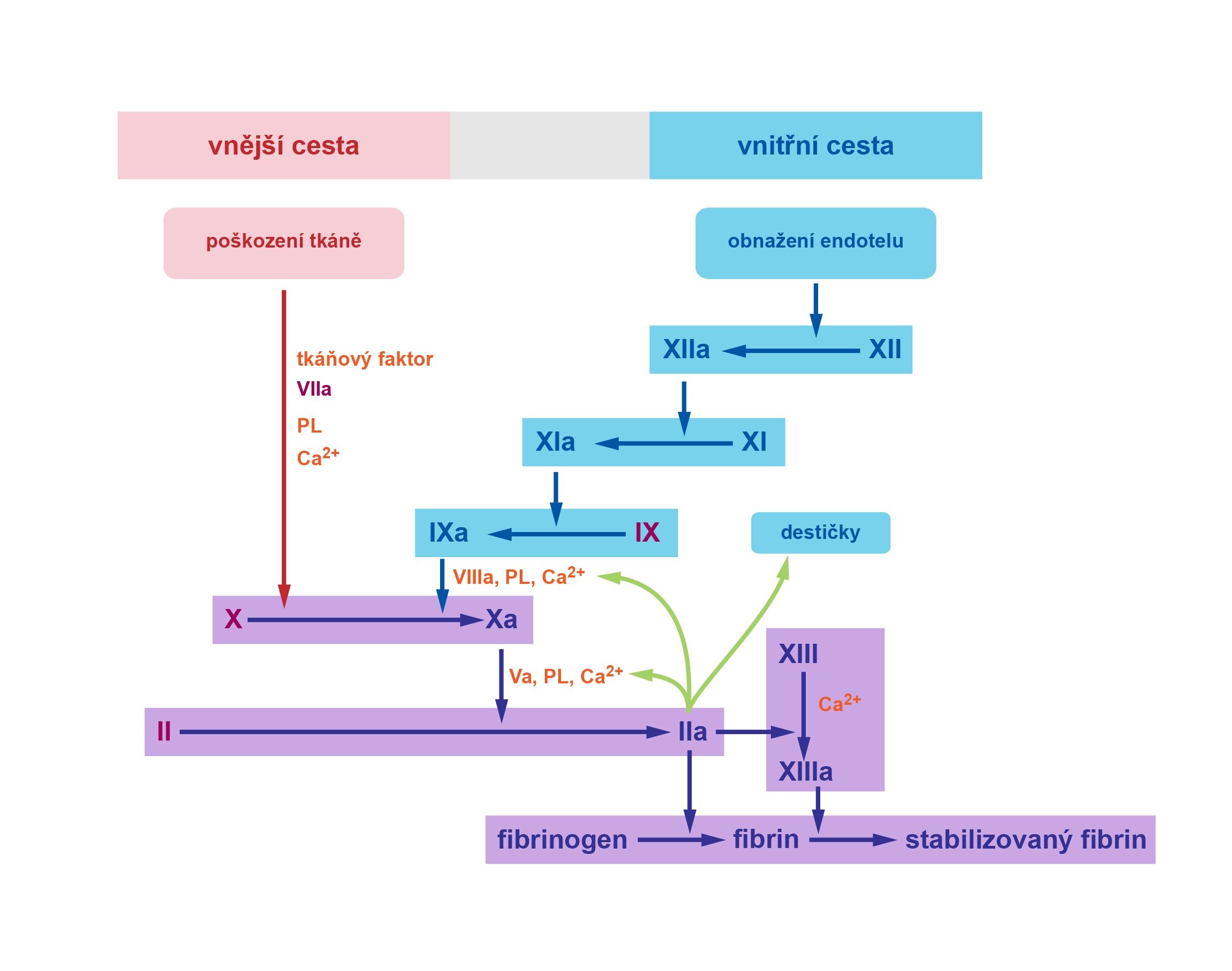
Schématicky můžeme v procesu hemokoagulace definovat dvě fáze:
1) Aktivace faktoru II (protrombinu) na trombin – může probíhat vnitřní či zevní cestou, obě cesty se spojují v místě faktoru X
2) Společná část – tvorba nerozpustného fibrinu z fibrinogenu a stabilizace fibrinové sítě
Zevní cesta koagulace (extrinsic pathway)
Zevní cesty se účastní koagulační faktory III (tkáňový tromboplastin), IV (Ca2+) a VII (prokonvertin). Na jejím počátku stojí uvolnění faktoru III, který aktivuje f. VII na f. VIIa (aktivovaný faktor VII). Komplex f. VIIa s fosfolipidy a Ca2+ vytváří tzv. vnější tenázu, jež, jak název napovídá, dokáže aktivovat f. X na f. Xa. Tím jsme poměrně rychle (oproti cestě vnitřní) dosáhli společné části koagulace. Faktor VIIa současně propojuje vnější a vnitřní cestu, neboť dokáže aktivovat f. IX. Jak si ukážeme při popisu nového modelu, je zevní cesta významná převážně pro iniciaci (nastartování) koagulace.
Jaký je původ tkáňového tromboplastinu? Faktor III představuje směs fosfolipidů a proteinů, které se uvolňují při poškození buněk, popř. ho exprimují aktivované endotelie a leukocyty.
Vnitřní cesta koagulace (intrinsic pathway)
Vnitřní cesty se účastní koagulační faktory VIII (antihemofilický f.), IX (Christmasův f.), XI (PTA) a XII (Hagemanův f.). Na jejím počátku stojí tzv. kontaktní fáze. Ta se vysvětluje vazbou faktoru XII na obnažený subendoteliální kolagen či destičkové membrány. Dochází k přeměně f. XII na f. XIIa. Faktor XIIa následně aktivuje f. XI na f. XIa, který přeměňuje f. IX (ten je aktivován i zevní cestou prostřednictvím f. VIIa) na f. IXa. Ten, podobně jako f. VIIa zevní cesty, dovede štěpit f. X na aktivní f. Xa – hovoříme o tzv. vnitřním tenázovém komplexu. Tento komplex se kromě f. IXa skládá z f. VIIIa (aktivován trombinem), fosfolipidů a Ca2+. Faktor Xa stojí na začátku společné cesty koagulace.
Na tomto místě je ještě třeba zmínit, že systém vnitřní cesty koagulace je úzce propojen se systémem kalikrein-kinin. Faktor XIIa totiž katalyzuje přeměnu prekalikreinu na kalikrein (přeměně napomáhá HMWK – vysokomolekulární kininogen). Kalikrein zpětně posiluje přeměnu f. XII na XIIa, čímž vzniká klička pozitivní zpětné vazby. Kalikrein současně odštěpuje z HMWK nonapeptid bradykinin.
Pokud jsme si výše uvedli, že zevní cesta koagulace je významná pro její iniciaci, pak vnitřní cesta, je dle současných znalostí důležitá pro její amplifikaci.
Společná část koagulace
Zevní i vnitřní cesty vedly skrze své tenázové komplexy k aktivaci f. X na f. Xa, který následně štěpí plazmatickou bílkovinu protrombin (f. II) na trombin (f. IIa). K tomuto slouží tzv. protrombinázový komplex, který se kromě f. Xa skládá z f. Va (aktivován trombinem), fosfolipidů a Ca2+.
Trombin je v současné době považován za klíčovou molekulu nejen hemokoagulace, ale i celé hemostázy. Trombin totiž aktivuje:
1) Destičky a endotelie
2) Neutrofily a monocyty – exprese TF
3) Faktor XIII – stabilizace fibrinové sítě
4) Faktory V, VIII a XI – amplifikace koagulace
5) Protein C (předtím nutná vazba trombin – trombomodulin) – antikoagulace
6) TAFI (thrombin activatable fibrinolysis inhibitor) (předtím nutná vazba trombin – trombomodulin) – inhibice fibrinolýzy
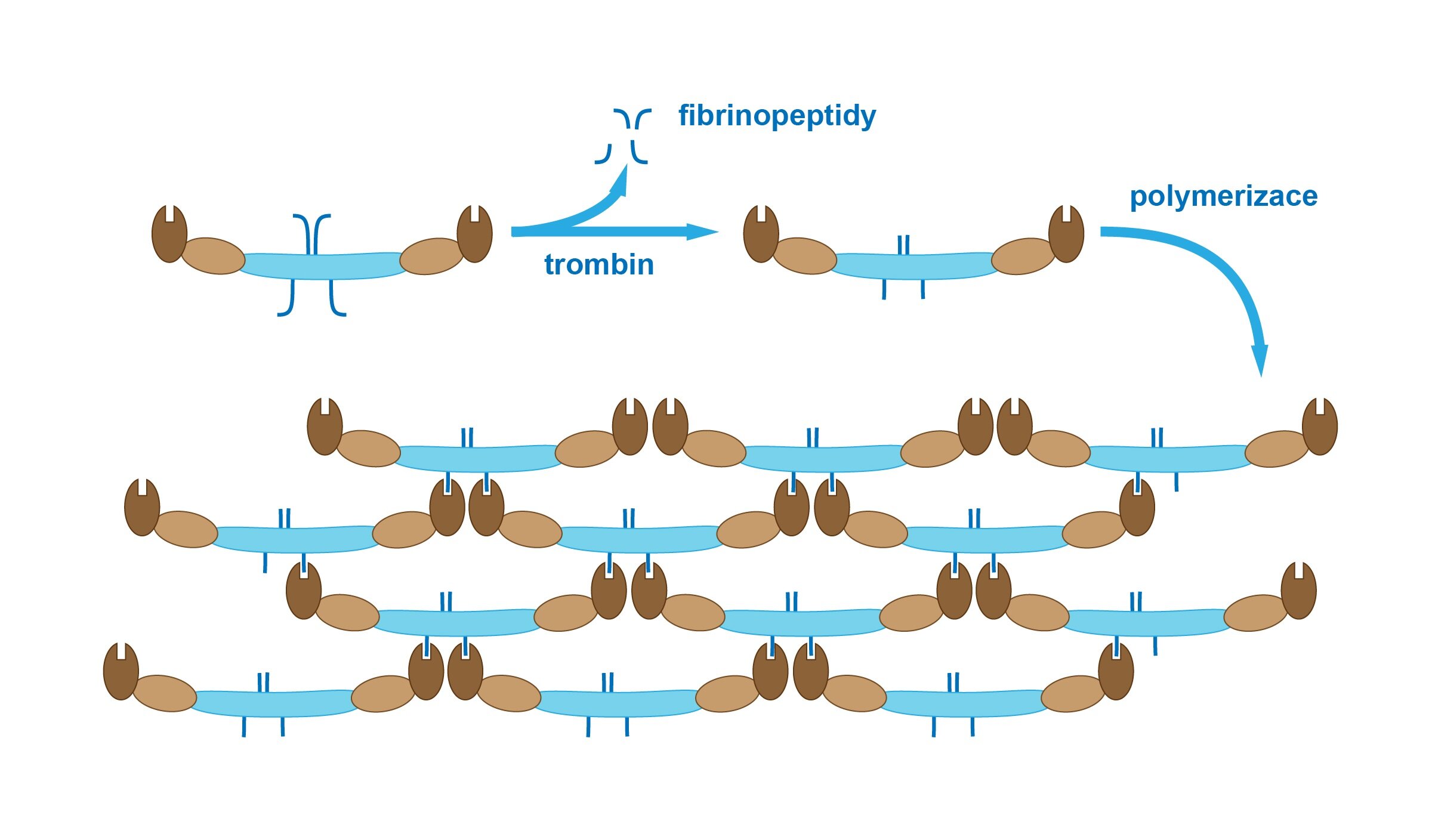
Nyní se ale vraťmě k roli trombinu jako enzymu katalyzujícího štěpení fibrinogen na fibrin (trombin funguje jako serinová proteáza). Fibrinogen je plazmatická bílkovina tvořená v játrech. Je řazen mezi proteiny akutní fáze – jeho hladiny tedy rostou při zánětlivých stavech. Molekula fibrinogenu se skládá ze tří globulárních domén (dvě periferní – D a jedna centrální – E). Na centrální doméně se dále vyskytují dva fibrinopeptidy. Funkcí trombinu je odštěpení obou těchto fibrinopeptidů, čímž vznikne monomer fibrinu. Ten spontánně polymeruje za vzniku fibrin-polymeru.
Vzniklá fibrinová síť ale nevykazuje dostatečnou odolnost a nevydržela by odolat toku krve (drží ji pouze nekovalentní vazby – riziko depolymerace). Proto musí nastoupit proces zpevnění fibrinové sítě, který ji umožní odolat toku krve. Proces spočívá ve tvorbě kovalentních můstků mezi α- a γ-řetězcem fibrinu (tzv. γ-glutamyl-ε-lysylový můstek vznikající reakcí glutaminu a lysinu) katalyzované faktorem XIII (sám je aktivován trombinem a Ca2+).
Nový (revidovaný) model koagulace
Jak jsme si již uvedli výše, tak nový model koagulace vychází z modelu starého, ale liší se v popisu jednotlivých fází koagulace. Tento model je třífázový – fáze iniciace, amplifikace a propagace, přičemž připisuje klíčovou roli vnějšímu systému a trombinu.
Iniciace
Proces koagulace startuje tkáňový faktor (TF) a f. VIIa. Malé množství f. VIIa je stále přítomno v krvi a vyčkává na setkání s TF, jenž je uvolněn při poranění, zánětu atd. Faktor VIIa autoaktivuje další molekuly f. VII na f. VIIa. Komplex TF-VIIa následně aktivuje faktory IX a X. Faktor Xa jednak aktivuje další molekuly f. VII, jednak generuje vznik malého množství trombinu. Toto množství není sice dostatečné pro tvorbu fibrinového koagula, ale je schopno převzít otěže vedení koagulace, čímž nastupuje fáze amplifikace.
Amplifikace
Ve fázi amplifikace dochází působením trombinu k aktivaci f. V, VIII a XI. Faktor XIa aktivuje molekuly f. IX na f. IXa, jenž se stává součástí tzv. vnitřního tenázového komplexu. Trombinem souběžně vyvolaná aktivace trombocytů a leukocytů vyústí v expresi negativně nabitých fosfolipidů na povrchu, což umožní vazbu koagulačních faktorů IXa, VIIIa a Va. Trombin aktivuje i endotelie, které tím přecházejí do prokoagulačního stavu (intaktní endotel produkuje řadu látek působících proti hemostáze – např. prostacyklin, NO a trombomodulin).
Výsledkem fáze amplifikace je jednak vznik většího množství trombinu, jednak vytvoření reakčních povrchů s navázanými molekulami aktivovaných faktorů pro komplementaci komplexů vnitřní tenázy a protrombinázy.
Propagace
Ve fázi propagace dochází k vazbě f. X na komplex vnitřní tenázy (tvoří faktory IXa a VIIIa) a k jeho aktivaci na f. Xa. Faktor Xa následně vytvoří s f. Va komplex protrombinázy, které katalyzuje mohutnou produkci trombinu – hovoříme o tzv. trombin burst. Toto množství je již dostatečné k efektivní přeměně fibrinogenu na fibrin. Nestabilní fibrin-polymer je stabilizován působením f. XIIIa (viz výše v textu).
Destičkové fosfolipidy
Jak jsme si již uvedli v části popisující roli destiček, destičkové fosfolipidy se významnou měrou podílejí na průbehu hemokoagulace. Dochází na nich ke komplementaci koagulačních faktorů, čímž vznikají enzymové komplexy (např. vnitřní a zevní tenáza, protrombináza, či komplex proteinu C a proteinu S).
Regulace koagulace
Proces srážení krve je složitě regulován, aby byla neustále udržena rovnováha prokoagulačních a antikoagulačních reakcí. Na tomto místě si zmíníme hlavní antikoagulační faktory, při jejichž postižení se rozvíjí trombofilní stav:
1) Systém proteinu C a proteinu S
2) Antitrombin III
3) Nesmáčivé endotelové buňky produkující NO, prostacyklin, trombomodulin atd.
4) Plynulý tok krve
Systém proteinu C a proteinu S
Systém proteinu C a proteinu S dovede zpomalit proces krevního srážení tím, že vyřadí neenzymatické koagulační faktory Va a VIIIa. Jak toto učiní?
Protein C i protein S jsou produkovány jaterními buňkami, přičemž jejich produkce je závislá na dostatečné přítomnosti vitaminu K (viz výše v textu). Protein S slouží jako kofaktor proteinu C. Ten současně vyžaduje aktivaci prostřednictvím komplexu endoteliálního trombomodulinu a v koagulaci vzniklého trombinu. Získáme tzv. aktivní protein C, neboli APC, který po vazbě na destičkové fosfolipidy štěpí výše zmíněné neenzymatické faktory f. Va a f. VIIIa. Tím se zpomalí vnitřní a společná část koagulace.
Klinická korelace:
K velmi závažným zdravotním důsledkům může vést tzv. Leidenská mutace faktoru V. Touto mutací mizí jedno z důležitých štěpných míst na molekule f. V, kde za normálních okolností účinkuje APC. Výsledkem je významné prodloužení poločasu f. Va. Jedná se o nejčastější vrozený trombofilní stav. Obzvláštní opatrnost je třeba dbát při kombinaci tohoto stavu s dalšími prokoagulačními faktory, mezi něž například řadíme užívání hormonální antikoncepce či kouření.
Antithrombin III (AT III)
Antithrombin III je považován za nejdůležitější inhibitor koagulačních reakcí. Funguje jako inhibitor serinových proteáz (serpin). AT III váže a inaktivuje trombin a faktory IXa, Xa, XIa a XIIa, čímž je vyřazuje z procesu hemokoagulace. Sám o sobě ale není antitrombin III dostatečně efektivní. Jeho schopnost vázat výše zmíněné koagulační faktory zvyšuje heparin řadící se mezi glykosaminoglykany.
Vrozené defekty koagulace
Během dalších let studia se seznámíte s mnoha defekty koagulace. Na tomto místě se omezíme na nejčastější vrozené defekty koagulace. Mezi ně patří: různé druhy hemofilií (A, B a C) a von Willebrandova nemoc.
Hemofilie A je na X-chomozom recesivně vázané onemocnění. Většinu nemocných tedy představují muži, ženy jsou přenašečkami. Nemocný otec předává svým synů Y chromozóm, který nenese příslušný gen, a proto jsou jeho synové zdraví. Dcerám naopak předává X chromozóm s defektním genem, proto jsou všechny jeho dcery přenašečkami. Hemofilie A představuje nejčastější typ hemofilie – v ČR trpí hemofilií celkově asi 1000 osob, 80-85 % z nich má hemofilii A. Toto onemocnění je zapříčiněno defektní syntézou nebo sníženou funkční aktivitou antihemofilického faktoru (f. VIII).
Hemofilie B je děděna stejně jako hemofílie A. Dochází při ní ale k postižení syntézy nebo aktivity Christmasova (f. IX).
Hemofilie C je autozomálně recesivní onemocnění zapříčiněné defektem faktoru PTA (f. XI).
Klinický obraz hemofilie je odvislý od závažnosti defektu, přičemž nejtěžší postižení se vyskytuje při poklesu plazmatické koncentrace koagulačních faktorů pod 1 % – těžká forma hemofilie. Střední forma hemofilie se vyskytuje při poklesu koagulačních faktorů na 1-5 % normálních hodnot. Pacienti s těžkou formou jsou ohroženi spontánním krvácením do kloubů, centrální nervové soustavy, svalů a měkkých tkání a dále pak život ohrožujícími krváceními po úrazech či lékařských zákrocích. Pacienti se střední hemofilií trpí podobnými projevy, většinou se ale u nich nevyskytují spontánní krvácení.
Kauzální léčba tohoto onemocnění neexistuje. Terapie spočívá v pravidelném podávání příslušných chybějících faktorů.
Historická korelace:
O hemofilii se mluví jako o královském onemocnění. Tento název vznikl proto, že potomci královny Spojeného království Velké Británie a Irska Viktorie trpěli hemofilií a skrze ně se toto onemocnění rozšířilo do mnoha evropských panovnických rodů (Romanovci, dynastie Bourbon-Anjou). Předpokládá se, že se jednalo o hemofilii B.
Von Willebrandova nemoc je nejčastější (trpí jí asi 1 % populace) vrozené krvácivé onemocnění podmíněné kvantitativním či kvalitativním defektem von Willebrandova faktoru. Toto vyústí v poruchu adheze a agregace trombocytů a funkce f. VIII (vysvětlení viz výše v textu). Von Willebrandova nemoc se dědí převážné autozomálně dominantně (někdy autozomálně recesivně). Můžeme rozlišit celkem tři typy tohoto onemocnění, přičemž většina případů je jen velmi lehká a tudíž nevede k výraznému ovlivnění života pacientů. Při těžším postižení jsou pacienti ohroženi zvýšením krvácením po úrazech či při lékařských zákrocích. Ani v případě tohoto onemocnění neexistuje kauzální léčba. Pacientů se jednak podávají podpůrné léky (např. antifibrinolytika – viz dále v textu), jednak koncentráty obsahující vWF/f. VIII.
Uplatnění antikoagulačních látek v klinické praxi
1) Heparin – posiluje účinek AT III, který váže a inaktivuje trombin a faktory IXa, Xa, XIa a XIIa. Tzv. nefrakcionovaný heparin (UFH) vykazuje krátký poločas a musí se podávat kontinuální infuzí. Nověji vyvinuté nízkomolekulární hepariny (LMWH, vzniklé depolymerizací heparinu) se mohou podávat s.c. a vykazují delší dobu působení (aplikace 1-2x denně). Využívají se například k prevenci a léčbě trombóz či akutních koronárních syndromů
2) Analoga vitaminu K – kumarinové preparáty (warfarin) – blokují účinek vitaminu K na syntézu některých koagulačních faktorů – faktory II, VII, IX a X a antikoagulační faktory protein C a S. Vzniklé faktory nejsou plně funkční (nedostatečná γ-karboxylace zbytků glutamátu vedoucí k oslabení schopnosti vázat se na membránové fosfolipidy). Analoga vitaminu K našly široké uplatnění v prevenci vzniku straženin například u pacientů s fibrilací síní či s chlopenními náhradami
3) Odstranění volných iontů Ca2+ prostřednitvím citrátu, EDTA (kyselina ethylendiaminotetraoctová) či oxalátu. Tento princip se užívá například při odběrech nesrážlivé krve k laboratornímu zpracování
Fibrinolýza (trombolýza)
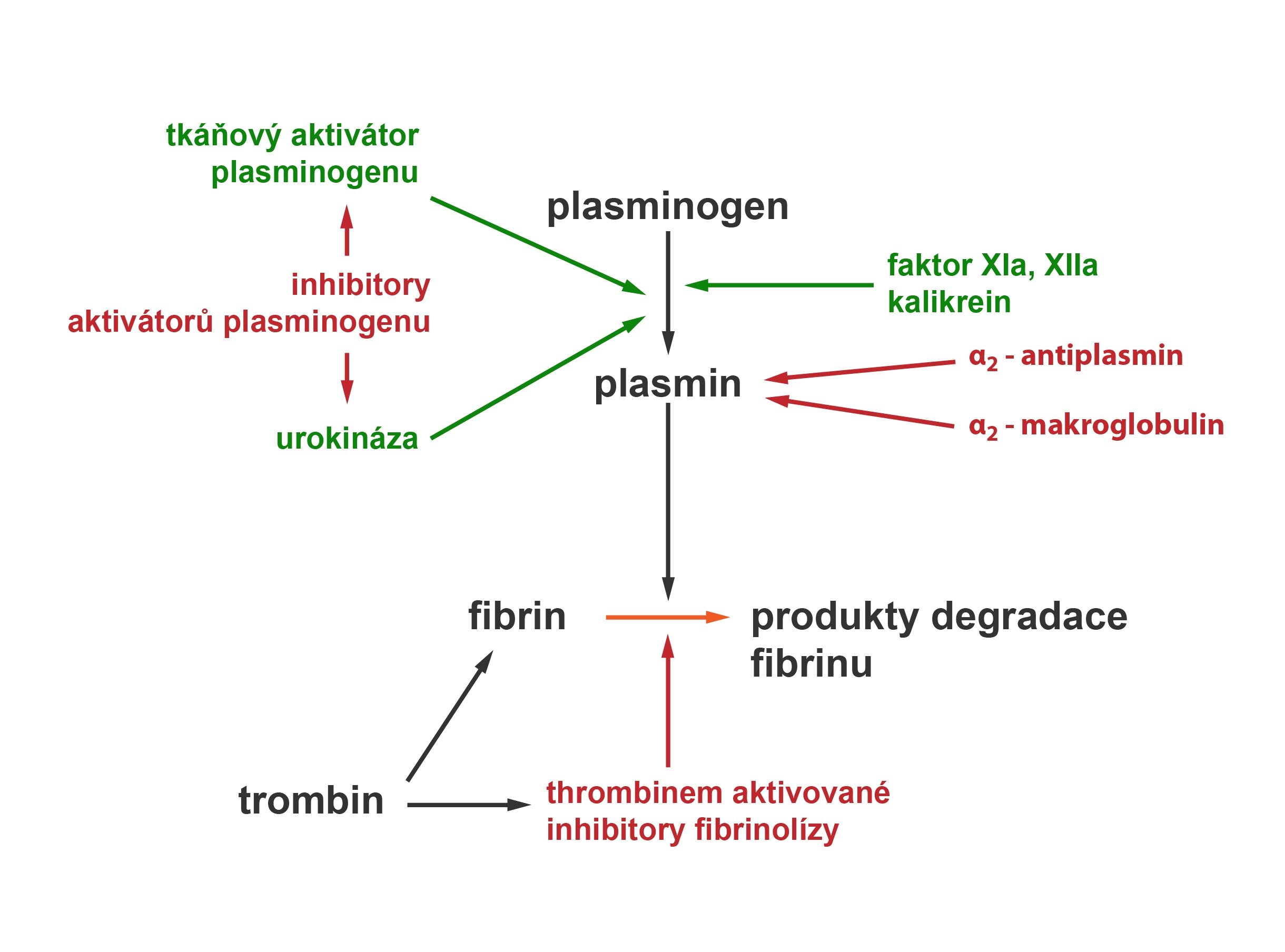
Poté, co krevní koagulum splní svoji protektivní funkci, musí mít organismus efektivní mechanismy, jak ho odstranit – hovoříme o tzv. fibrinolýze. K tomuto procesu ale nesmí dojít dříve, než je poškození vedoucí k nastartování hemostázy reparováno. Principem fibrinolýzy je štěpení nerozpustné fibrinové sítě na rozpustné fibrin degradační produkty (FDP) působením enzymu plasminu. Ten se v plazmě vyskytuje v neaktivní formě plasminogenu a po své aktivaci účinkuje jako serinová proteáza specifická pro molekuly fibrinu a fibrinogenu.
Aktivaci plasminogenu na plasmin provádí serinové proteázy:
1) Tkáňový aktivátor plazminogenu (tissue plasminogen activator, tPA) působící v cévním řečišti – z aktivovaných endotelií
2) Urokináza (urokinase-type plasminogen activator, uPA) působící extravaskulárně
3) Vnitřní cesta koagulace (faktory XIa, XIIa a kalikrein)
Proces fibrinolýzy naopak inhibují:
1) PAI-1 (plasminogen activator inhibitor) pocházející z destiček – nejsilnější inhibitor řadící se mezi serpiny – váže tPA a uPA
2) α2-antiplasmin – plazmatický protein, váže a tím i inaktivuje plasmin
3) Inhibitory proteáz – α1-antitrypsin a α2-makroglobulin
4) Antifibrinolytika – kyselina ε-aminokapronová
_
Vyšetření hemostázy
K hodnocení stavu hemokoagulace se může využít mnoho parametrů. Zde si uvedeme jen ty nejčastěji používané: aPPT, Quick test a INR.
aPTT (aktivovaný parciální tromboplastinový čas) se využívá k hodnocení vnitřní cesty hemokoagulace. Jeho normální hodnota činí 26-50 s.
K hodnocení vnější cesty koagulace můžeme využít dva parametry. Jednak tzv. Quick test jehož normální hodnota se pohybuje kolem 14 s (což představuje 100 % pro následující parametr), jednak tzv. INR (International normalized ratio), jehož fyziologické rozmezí činí 80-120 %.
Autoři podkapitoly: Josef Fontana a Petra Lavríková