Náplň podkapitoly:
1. Základní informace o krevní plazmě a její užití k laboratornímu vyšetření
2. Voda a osmolarita krevní plazmy
3. Nízkomolekulární látky
4. Vysokomolekulární látky
_
Základní informace o krevní plazmě a její užití k laboratornímu vyšetření
Krevní plazma, tvořící tekutou složku krve, je koloidní roztok organických a anorganických látek (elektrolytů, živin, proteinů, hormonů, …) s příměsí rozpuštěných krevních plynů. Má bleděžlutou barvu způsobenou přítomností barviv vznikajících při rozpadu erytrocytů a je mírně opaleskující.
Objem krevní plazmy je přibližně 2,8-3,5 l (40-45 ml/kg hmotnosti). Spolu s lymfou tvoří až 25 % extracelulární tekutiny (ECT).
Pro přehled zde uvádíme několik informací o rozložení celkové tělesné vody, více informací viz Podkapitola 7/6.
Celková tělesná voda (CTV) tvoří 55-60 % hmotnosti lidského těla. Ženy, z důvodu vyššího množství tukové tkáně (s nízkým obsahem vody), mají procentuální obsah vody nižší. K poklesu dochází také ve stáří. Děti a těhotné ženy mají naopak CTV vyšší. 2/3 CTV tvoří intracelulární tekutina (ICT) a zbytek (tj. 1/3) extracelulární tekutina (ECT). Extracelulární tekutinu můžeme dále dělit na:
1) Intravazální tekutinu (IVT) – nachází se v cévách (plazma a lymfa), tvoří 1/4 ECT
2) Intersticiální tekutinu (tkáňový mok), tvoří 3/4 ECT
Vyšetření
Při získávání krevní plazmy je důležité přidání protisrážlivých látek do odebrané „plné“ krve, jinak má krev kvůli přítomnosti srážecích faktorů v krevní plazmě tendenci se rychle srážet. Následně se centrifugací oddělí od plazmy krevní elementy. Je třeba mít na paměti, že látky zabraňující srážení často obsahují různé ionty, které pak ovlivní měření jejich koncentrace v plazmě. Protože nedochází k odstranění srážecích faktorů je možné na ní provádět testy krevní srážlivosti. Vyšetření plazmy je často užíváno v urgentní medicíně.
Pokud do „plné“ krve protisrážlivé faktory nepřidáme, vzniká sraženina a nad ní vzniká tekutina nazývaná krevní sérum, které je vhodné pro většinu běžných laboratorních vyšetření. Jeho složení je podobné krevní plazmě, ale neobsahuje faktory srážení krve, zato se v něm navíc nacházejí jejich degradační produkty.
Koncovka -emie značí koncentraci určité látky v plazmě – např. glykemie, kalcemie, natremie.
Složení krevní plazmy
Krevní plazma se skládá z:
1) Vody
2) Nízkomolekulárních látek
a) iontů (minerálů)
b) energetických substrátů
c) metabolitů
3) Vysokomolekulárních látek
a) proteinů
b) lipoproteinů
_
Voda a osmolarita krevní plazmy
Voda je hlavní složkou krevní plazmy a tvoří 90-92 % jejího objemu. Kromě vody volné, je zde přítomna i voda hydratační, vázaná například na proteiny.
Osmolarita krevní plazmy udává počet osmoticky aktivních částic na litr a měří se v osmolech na litr ([osm/l]). Její hodnota se u zdravého jedince pohybuje mezi 280-295 mosm/l, přičemž závisí zejména na koncentraci nízkomolekulárních látek (iontů, živin a metabolitů). Pro představu osmolarita moči se pohybuje v rozmezí 50-1200 mosm/l.
Klinická relevance těchto hodnot spočívá v tom, že v důsledku dobré propustnosti buněčné membrány pro vodu osmolarita ECT dobře koreluje s osmolaritou ICT a může nám tak napovědět o stavu, ve kterém se nacházejí buňky (i když s určitým opožděním). Změny osmolarity také vedou k přestupu vody, elektrolytů a některých dalších látek mezi intravazálním, intersticiálním a intracelulárním prostředím. Je třeba při tom myslet na to, že některé látky prostupují volně až do ICT, některé neprostupují buněčnou membránou a pro jiné je zase nepropustná cévní stěna.
Rychlá změna osmolarity vede k rychlému přesunu molekul vody vyvolávající změnu objemu buněk, což ohrožuje zejména buňky mozku. Pokles osmolarity ECT způsobí přestup vody do buněk (které jsou vůči ECT hypertonické), což vede k jejich edému, následkem je tzv. edém mozku. Naopak rychlý vzestup osmolarity způsobí pokles objemu buněk (typický je výskyt demyelinizace v oblasti pontu mozku).
Osmolarita je velmi striktně regulovaná veličina. Změny osmolarity zaznamenávají osmoreceptory v hypotalamu, který podle nich moduluje sekreci antidiuretického hormonu (ADH), což je klíčový hormon regulace osmolarity. ADH zvyšuje zpětnou resorpci vody v distálním tubulu a sběracím kanálku ledvin. Změna osmolarity o pouhé 1 % vede ke změně plazmatické koncentrace ADH o 100 %. Více informací viz Podkapitola 11/3 a Podkapitola 7/6.
Při podávaní infuzních roztoků je proto třeba respektovat tonicitu plazmy. Z tohoto důvodu se v klinické praxi nejčastěji používají izotonické roztoky, jež mají podobnou osmolaritu jako plazma. Hypotonické roztoky (nižší osmolarita než plazma) mohou způsobit hemolýzu, hypertonické (vyšší osmolarita než plazma) mohou dráždit stěnu cév. Mezi izotonické roztoky patří: fyziologický roztok (0,9% NaCl – 154 mmol/l Na+ a Cl–), 5% Glukóza (po zmetabolizování glukózy ale zůstává jen volná voda → hypotonický roztok), Ringerův či Hartmanův roztok (jejich iontové složení se podobá plazmě) a jiné.
Hodnotu osmolarity plazmy nemusíme získat jen jejím změřením (osmometrem), ale můžeme ji i přibližně vypočítat. Tuto hodnotu pak nazýváme vypočtená osmolarita – získáme ji dosazením plazmatických koncentrací do následujícího vztahu:
Osmo (Calc) = 2 [Na+]+ 2 [K+] + [urea] + [glukóza]
případně zjednodušeně jako:
Osmo (Calc) = 2 [Na+] + [urea] + [glukóza]
V některých situacích je užitečné určit tzv. osmolární / osmotické okno (osmol / osmotic / osmolality gap, OG), které vyjadřuje rozdíl mezi přímo změřenou osmolaritou a vypočtenou osmolaritou (např. dle vzorce (2)). Fyziologická hodnota osmotického okna je 4-12 mosm/l. Podstatou OG je to, že osmometr změří i soluty, jež nejsou započteny ve vzorcích. Pokud je v plazmě obsaženo významné množství těchto nezapočtených osmoticky aktivních látek, zjistíme nefyziologický rozdíl mezi přímo změřenou a vypočtenou osmolaritou. Výpočet OG pomáhá například při diagnostice otrav (např. ethanol, methanol, ethylenglykol, …) a dysbalancí intermediárního metabolismus (např. diabetická ketoacidóza provázející T1DM). Například 1 ‰ etanolu zvýší osmolaritu o 23 mmol/l.
_
Nízkomolekulární látky
Ionty
Pro zachování elektroneutrality krve je nevyhnutelné, aby v ní byly koncentrace kladně a záporně nabitých částic vyrovnány (zákon elektroneutrality). Z kationtů (přispívají ke kladnému náboji) jsou v plazmě nejvíce zastoupeny Na+, K+, Ca2+ a Mg2+. Základními anionty plazmy jsou Cl– a HCO3–, v mnohem menší koncentraci se v ní nacházejí také HPO42- a HSO4–. Rozdíl koncentrací běžně měřených kationtů (viz výše) a koncentrací běžně měřených aniontů se nazývá anion gap (AG, anionové okno):
AG = ([Na+] + [K+]) – ([Cl–] + [HCO3–])
přičemž kvůli nízké hodnotě můžeme v běžné praxi z výpočtu vynechat koncentraci K+. Protože hladiny uvedených kationtů převažují nad hladinami aniontů, je hodnota AG fyziologicky kladná – pohybuje se v rozmezí 14 ± 2 mmol/l. V AG jsou tedy obsaženy anionty, které se v krvi běžně nestanovují – fosfáty, sulfáty, plazmatické proteiny a anionty organických kyselin (laktát, ketolátky, …). Tyto látky vyrovnávají převažující kladný náboj kationtů krve. Hodnota anion gapu se mění za podobných situací jako u osmotic gapu – například při otravách (methanol, ethylenglykol, …), ketoacidóze či laktátové acidóze.
Sodný kationt (Na+) – 135-145 mmol/l
Sodný kationt je hlavní kationt extracelulární tekutiny. Společně s Cl– zodpovídá za 80 % osmolarity plazmy a vazbou vody určuje objem plazmy. Na regulaci jeho obsahu v plazmě se společně podílí aldosteron a systém natriuretických peptidů (např. ANP – atriální natriuretický polypeptid).
Chloridový aniont (Cl–) – 97-108 mmol/l
Chloridový aniont je hlavní aniont extracelulární tekutiny. Kvůli existenci elektrostatických interakcí provází sodíkový kationt, a podílí se tak s ním na tvorbě osmolarity a udržování objemu plazmy.
Draselný kationt (K+) – 3,8-5,2 mmol/l
Koncentrace draselného kationtu v plazmě (3,8-5,2 mmol/l) je v porovnání s jeho intarcelulární koncentrací (kolem 155 mmol/l) výrazně nižší (extracelulárně se nachází jen 2 % z celkového obsahu draslíku v těle, draslík je hlavní intracelulární kationt). Gradient, který tak draselný kationt na membráně vytváří, významně ovlivňuje hodnotu membránového potenciálu. Fyziologické rozložení kationtů (Na+ převážně v ECT a K+ v ICT), které je trvale i za cenu vysoké energetické náročnosti udržováno pomocí Na+/K+-ATPázy, je nezbytné pro zachování správné funkce buněk (nervosvalová dráždivost, srdeční činnost …).
Vápenatý kationt (Ca2+) – 2,25-2,75 mmol/l (ionizovaná frakce 1,1-1,4 mmol/l)
Hladina vápenatého kationtu v extracelulárním prostředí (2,25-2,75 mmol/) je o čtyři řády vyšší než jeho intracelulární koncentrace. Ca2+ se v plazmě vyskytuje ve dvou základních frakcích – vázané a volné:
1) 46 % Ca2+ je vázáno na plazmatické bílkoviny (zejména na albumin)
2) 6 % Ca2+ je vázáno v komplexech s malými anionty (HCO3–, citrát, laktát)
3) 48 % Ca2+ tvoří volnou, ionizovanou frakci, která je jako jediná fyziologicky aktivní
Poměr frakcí (při stálé kalcemii) je ovlivněn proteinemií (při ztrátě bílkovin se snižuje vázaná frakce) a pH (H+ ionty soutěží s Ca2+ o vazebné místo na albuminu, což se projeví poklesem ionizovaného Ca2+ při vzestupu pH a opačným efektem při poklesu pH – proto například v důsledku hyperventilace dochází k tetanii).
Význam vápenatého kationtu spočívá ve stabilizaci membrán vzrušivých tkání (proto při jeho poklesu dochází ke křečím), umožnění svalové kontrakce a hemokoagulace – krevního srážení (je aktivátorem koagulačních faktorů, jejichž tvorba je závislá na vitaminu K – f. II, VII, IX, X, protein C a S) a je nezbytný pro laktaci. Vápník je také součástí anorganické kostní matrix (hydroxyapatit) a mezi jeho množstvím v kostní tkáni a plazmatickou koncentrací existuje určitá rovnováha.
Hydrogenuhličitanový aniont, bikarbonát (HCO3–) – 24 ± 2 mmol/l
Bikarbonát je nejvýznamnějším pufrem krve – tvoří až polovinu její pufrační kapacity. Současně se podílí na transportu CO2 z tkání do plic.
Fosfáty – 0,7-1,5 mmol/l
_
Energetické substráty
Glukóza – 3,3-5,6 mmol/l
Glukóza je transportována volně rozpuštěná v krvi. Její plazmatická koncentrace (glykemie) je striktně regulována hormony (inzulin, glukagon, adrenalin, kortizol, …) i autonomním nervovým systémem.
Volné mastné kyseliny – 0,6-1,7 mmol/l
Mastné kyseliny s řetězcem kratším jak 12 uhlíků jsou v plazmě volně rozpuštěné, ty s řetězcem delším jsou transportovány ve vazbě na albumin (přesněji se dá říci, že čím je řetězec delší, tím více převládá vazba na albumin). Transport ostatních lipidů zajišťují vysokomolekulární částice – lipoproteiny – viz dále v textu.
Ketolátky
Ketolátky jsou podobně jako glukóza rozpustné ve vodě a transportují se tedy v plazmě volně. Koncentrace 3-hydroxybutyrátu je nalačno <0,5 mmol/l, při hladovění se zvyšuje. Jako ketoacidózu označujeme stav metabolické acidózy, kdy koncentrace ketolátek překročí množství 3 mmol/l a vede k významnému poklesu pH krve.
Aminokyseliny – 2,3-4,0 mmol/l
Jednotlivé aminokyseliny jsou v plazmě zastoupené v různé míře a hladina 2,3-4,0 mmol/l představuje jejich celkovou plazmatickou koncentraci. Nejvyšší podíl má glutamin (0,6 mmol/l), jenž je hlavní transportní formou amoniaku, a alanin (0,3 mmol/l).
Dusíkaté metabolity
Amoniak – 6-35 µmol/l
Většina amoniaku pochází z deaminace aminokyselin. Protože se jedná o vysoce toxickou látku, je v krvi transportován zejména ve formě glutaminu, méně jako alanin.
Urea (močovina) – 2,5-8,3 mmol/l
Urea představuje konečný degradační produkt metabolismu proteinů / aminokyselin. Je tvořena v játrech.
Kreatinin – 50-120 µmol/l
Kreatinin je tvořen ve svalech ireverzibilní neenzymatickou dehydratací a odštěpení fosfátu z kreatinfosfátu (který slouží jako zdroj energie pro obnovu ATP). Plazmatická koncentrace kreatininu výrazně závisí na tělesné konstituci jedince, zejména na množství svalové hmoty, a též na dietě.
Kyselina močová – 150-360 µmol/l
Kyselina močová představuje konečný degradační produkt metabolismu purinů. Její hladina se liší u obou pohlaví.
Bilirubin – do 17 µmol/l
Celková koncentrace bilirubinu je tvořena součtem koncentrací nekonjugovaného a konjugovaného bilirubinu. Při hodnotách >40 µmol/l dochází k rozvoji ikteru.
_
Vysokomolekulární látky
Lipoproteiny
Lipoproteiny (LPP) jsou částice kulovitého tvaru tvořené:
1) Amfifilním obalem z fosfolipidů, cholesterolu a apoproteinů
2) Hydrofóbním jádrem obsahujícím TAG a estery cholesterolu
Na fosfolipidy jsou nekovalentně, prostřednictvím elektrostatických a hydrofóbních interakcí, vázány apoproteiny (označované jako Apo a příslušné písmeno / číslo), které se liší u různých lipoproteinových tříd. Pomocí apoproteinů tedy můžeme charakterizovat určitou třídu lipoproteinů. I naše tělo podle jejich distribuce rozeznává a zpracovává jednotlivé lipoproteiny – apoproteiny fungují jako ligandy pro receptory v cílových tkání a jako aktivátory enzymů lipoproteinového metabolismu. Celkově můžeme funkce apoproteinů shrnout:
1) Strukturální Apo: Apo B100 a Apo B48
2) Kofaktory (aktivátory) enzymů: Apo C-II (enzym lipoproteinová lipáza) a Apo A-I (enzym LCAT)
3) Ligandy receptorů: Apo B100 a Apo E (pro LDL-receptor), Apo E (pro zbytkový receptor), Apo A-I (pro HDL-receptor)
Lipoproteiny mohou být na základě své hustoty a obsahu apoproteinů klasifikovány do pěti tříd. Čím vyšších je obsah TAG v jejich jádře, tím je hustota nižší, a naopak čím vyšší je obsah proteinů, tím je hustota vyšší. Charakteristická je vzájemná výměna apoproteinů, TAG a esterů cholesterolu (CE) mezi jednotlivými třídami LPP při jejich cirkulaci v krvi. Podle stoupající hustoty rozlišujeme následující třídy:
1) Chylomikrony
2) VLDL (very low density lipoprotein)
3) IDL (intermediate density lipoprotein)
4) LDL (low density lipoprotein)
5) HDL (high density lipoprotein)
1) Chylomikrony
Chylomikrony jsou tvořeny v enterocytech střeva z TAG a esterů cholesterolu (CE) a slouží k jejich transportu ze střeva do tkání. Právě kvůli vysokému podílu TAG je jejich hustota nejnižší mezi všemi LPP. Jejich charakteristickým apoproteinem je Apo B48, na jejich povrchu se ale nachází i Apo C-II a Apo E, které získávají v cirkulaci od HDL.
Ze střeva se chylomikrony nejprve dostávají do lymfy a pak skrze ductus thoracicus, obcházejíc játra, do v. cava superior a systémové cirkulace. Apo C-II aktivuje lipoproteinovou lipázu (LPL) (lokalizovanou především na endotelu tukové tkáně a příčně pruhované svaloviny, aktivuje ji inzulin), která katalyzuje hydrolýzu TAG na MK, které se vstřebávají do tkání, a MAG (monoacylglyceroly).
Z chylomikronů postupně vznikají chylomikronové zbytky, které jsou oproti původním LPP menší a obsahují větší podíl CE a MAG. Z oběhu jsou vychytávány a odstraňovány játry (ligandem receptorů je Apo E).
2) VLDL (very low density lipoprotein)
VLDL se tvoří v játrech a jsou do nich ukládány zde nasyntetizované TAG. Jejich hustota je jen o málo vyšší než hustota chylomikronů. Povrchovým markrem je Apo B100. VLDL slouží k transportu TAG z jater do periferie, kde jsou v nich obsažené TAG rozkládány prostřednictvím LPL (na MK a MAG, analogie k chylomikronům). VLDL se tak zmenšují na tvz. IDL (nazývané i VLDL zbytky).
I VLDL si s ostatními lipoproteiny, především HDL, vyměňují svůj obsah. Za účasti enzymu CETP (cholesterolester transport protein) se z HDL do VLDL přenáší CE a opačným směrem putují TAG.
3) IDL (intermediate density lipoprotein)
IDL vznikají z VLDL činností LPL (proto je jejich strukturním apoproteinem také Apo B100, jako u VLDL) a liší se od svého předchůdce především vyšším obsahem CE a nižším obsahem TAG. Jejich osud je ukončen v játrech, kde jsou buď pohlceny a následně rozloženy hepatocyty a zanikají, nebo se z nich činností HRHL (heparinem uvolnitelné hepatální lipázy) odštěpí TAG a přemění se na LDL částice s vysokým podílem CE.
4) LDL (low density lipoprotein)
LDL mohou být tvořeny de novo, nebo vznikají z IDL činností HRHL. Je pro ně charakteristický Apo B100. Ve svém jádře obsahují převážně CE, které transportují do tkání (tímto se vysvětluje jejich proaterogenní potenciál – bývají označovány jako „zlý“ cholesterol). Při potřebě cholesterolu exprimují buňky LDL-receptor (receptor pro je Apo B100 a Apo E) a s jeho pomocí částice LDL internalizují.
Koncentrace LDL v plazmě by neměla přesáhnou 3,0 mmol/l (u diabetiků 2,5 mmol/l).
5) HDL (high density lipoprotein)
Hlavní úlohou HDL je reverzní transport cholesterolu z periferních tkání do jater, kde může být cholesterol přeměněn na žlučové kyseliny a vyloučen. HDL částice jsou syntetizovány zejména v játrech a enterocytech, a to ve formě plochých prázdných disků sestávajících jen z membrány s obsahem Apo A1,2,3 a menšího množství Apo C-II a Apo E. Tyto prázdné disky se označují jako nascentní HDL.
Činností enzymu LCAT (lecitin cholesterol acyl transferáza), která esterifikuje cholesterol při přenosu do HDL (jejím kofaktorem je Apo A-I), se nascentní HDL postupně plní estery cholesterolu a přeměňují se na HDL3 a HDL2α, které se liší obsahem cholesterolu (HDL3 ho obsahuje méně).
HDL2α si prostřednictvím CETP (cholesterolester transport protein) vyměňuje lipidy s VLDL, od nichž získává TAG, a mění se tím na HDL2β. Ten směřuje jater, kde ho postihne podobný osud jako IDL. HRHL (heparinem uvolnitelná hepatální lipáza) hydrolyzuje obsažené TAG, čímž mění HDL2β zpět na HDL3 a posílá ho zpět do cirkulace. Část HDL v játrech zaniká a jejich cholesterol se v podobě žlučových kyselin vyloučí do stolice.
HDL je označovaný jako „hodný“ cholesterol, protože působí proti aterogenezi. Jeho koncentrace v plazmě má být u mužů vyšší než 1,0 mmol/l a u žen vyšší než 1,2 mmol/l (před menopauzou chrání ženy před aterosklerózou pohlavní hormony).
Existují mutace postihující různé části řetězce syntézy, transportu a vychytávání lipoproteinů, které mohou vést ke zvýšeným koncentracím příslušných LPP v krvi, a významně tak zvyšovat riziko aterosklerózy. Příkladem je mutace genu pro LDL receptor, která způsobí zhoršené vychytávání LDL částic a zvýšení hladiny cholesterolu. Ten se pak ukládá ve stěně cév a způsobí rozvoj aterosklerózy a jejích následných komplikací (infarkt myokardu, cévní mozková příhoda, …) již v mladém věku.
Plazmatické proteiny – 60-80 g/l
Plazmatické proteiny tvoří různorodou skupinu zahrnující více než 300 druhů proteinů. Z chemického hlediska patří většina z nich do skupiny glykoproteinů, nejvýznamnější výjimku tvoří albuminu, který glykosylovaný není. Díky přítomnosti karboxylových i amino skupin se proteiny chovají jako amfolyty. Při fyziologickém pH plazmy (7,4) převažuje v proteinech záporný náboj a tvoří anionty.
Syntéza většiny plazmatický proteinů probíhá v játrech, výjimku tvoří imunoglobuliny, jež jsou syntetizovány plazmatickými buňkami. Kromě hepatocytů jsou schopné syntézy některých proteinů i jiné buňky těla (například β2-mikroglobulin).
Celková koncentrace v plazmě („celkový protein“), pohybující se v rozmezí 60-80 g/l, závisí na mnoha faktorech: rychlost syntézy a odbourávaní, distribuce v tělních tekutinách, ztráty do třetího prostoru, hydratace organismu, eliminace z těla. Fyziologicky se zvyšuje při poloze ve stoje a zvýšené svalové aktivitě, naopak nižší je u dětí, těhotných a po delším lačnění.
Plazmatické proteiny vykazují mnoho funkcí:
1) Zabezpečují udržování části osmotického tlaku – koloidně-osmotický tlak plazmatických bílkovin, nazývaný také tlak onkotický (jeho hodnota je přibližně 25 mmHg = 2,2 kPa), vzniká díky tomu, že stěna cév je za normálních okolností pro většinu proteinů nepropustná
2) Podílejí se na procesech hemokoagulace a fibrinolýzy
3) Tvoří jeden z pufračních systémů krve
4) Transportují látky špatně rozpustné ve vodě
5) Jsou součástí imunitního systému – protilátky, komplement a reaktanty akutní fáze
6) Antioxidační funkce
7) Využití pro diagnostiku onemocnění: enzymy, markery
Jedním ze základních screeningových vyšetření plazmatických proteinů sloužící k vyhledávání odchylek ve složení jejich spektra je elektroforéza. Jejím podkladem je separace plazmatických proteinů na základě pohyblivosti jejich molekul přes vhodný nosič v elektrickém poli. Při použití agarozového gelu jako nosiče vzniká pět až šest frakcí:
1) Albumin
2) Alfa-1 frakce
3) Alfa-2 frakce
4) Beta frakce (někdy rozdělena na beta-1 a beta-2 frakci)
5) Gama frakce
1) Albumin – 35-53 g/l
Albumin tvoří 60 % všech plazmatických proteinů. Molekula albuminu je relativně malá (Mr = 68 000), stojí na hranici prostupnosti glomerulární filtrační membránou (proto se při poruše membrány jako první z plazmatických proteinů začíná filtrovat do moče albumin). Jeho tvorba v játrech je přibližně 12 g/den, což představuje asi 25 % celkové výrobní kapacity jater. Poločas rozpadu je relativně dlouhý, kolem 20 dnů, což znamená, že pokles produkce (například při hladovění) se projeví až po delší době.
Základní funkcí albuminu je udržování onkotického tlaku plazmy (vytváří až 80 % jeho hodnoty). Hypoalbuminémie vede k úniku tekutiny do intersticia a k tvorbě otoků. Albumin je také nejvýznamnější transportní látkou plazmy – podílí se na přenosu nekonjugovaného bilirubinu, MK, thyreoidálních hormonů, iontů (Ca2+, Mg2+, Zn, …) a léků (penicilin, digoxin, salicyláty). Při přílišném zvýšení koncentrace některé z transportovaných látek mohou být v důsledku kompetice na albuminu jiné látky z vazby vytěsněny a následně se v plazmě vyskytovat ve zvýšené koncentraci.
Interzóna albumin / alfa-1
HDL
Alfa-1 fetoprotein (AFP): protein syntetizovaný během vývoje zárodku, používaný v prenatální diagnostice (tzv. triple test). Vysoké hladiny AFP jsou spojeny s rizikem neuronálních defektů. U dospělých se jeho hladina zvyšuje při karcinomech jater
Alfa-1 kyselý glykoprotein (orozomukoid)
2) Alfa-1 frakce
Alfa-1 antitrypsin: jeden z RAF, patří mezi inhibitory proteáz (elastáz, kolagenáz), které se tvoří ve zvýšené míře při různých infekcích, aby snížily příliš vysokou aktivitu proteáz produkovaných bakteriemi a makrofágy
Interzóna alfa-1 / alfa-2
Alfa-1 antichymotrypsin: inhibitor proteáz a RAF
3) Alfa-2 frakce
Alfa-2 makroglobulin: inhibitor endoproteáz (trypsin, chymotrypsin), jeho koncentrace v plazmě závisí na věku (nižší je v dětství). Je typicky zvýšený při nefrotickém syndromu, protože na rozdíl od ostatních proteinů se kvůli své velké velikosti do moče nedostává
Haptoglobin: protein vázající a transportující volný hemoglobin. Komplex haptoglobin-hemoglobin je rychle vychytáván RES a metabolizován. Brání tak ztrátám železa močí a působí jako antioxidant
Ceruloplazmin: hlavní transportní protein mědi (přenáší 90 % Cu v krvi, zbylých 10 % transportu zabezpečuje albumin)
4) Beta frakce
Transferin: hlavní transportní protein železa, schopný vázat dva kationty Fe3+. Vyvázáním železa působí jako antioxidant
C-reaktivní protein (CRP): patří mezi RAF a jeho koncentrace (normálně stoupá při akutním bakteriálním zánětu
Fibrinogen: vláknitý protein patřící mezi koagulační faktory (faktor I), normálně přítomný v koncentracích 1,5-4,5 g/l. Patří mezi RAF
Hemopexin: zabezpečuje vyvazování a transport volného hemu
C3 složka komplementu
LDL
5) Gama frakce
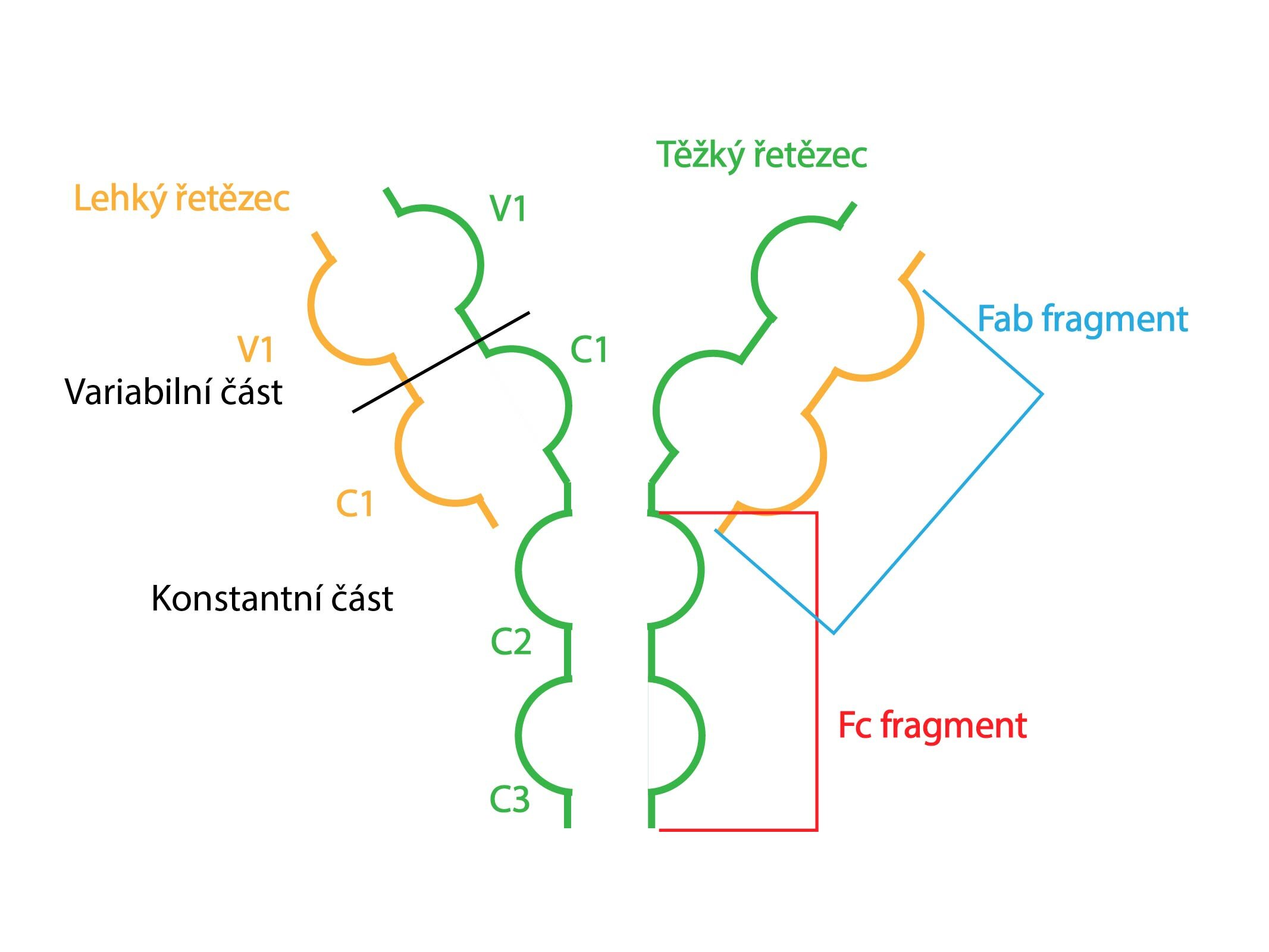
Gama frakce je tvořena gamaglobuliny (imunoglobuliny, protilátky, Ig), které jsou na rozdíl od ostatních plazmatických proteinů syntetizovány plazmatickými buňkami. Jejich strukturu vytvářejí dva páry těžkých a dva páry lehkých řetězců vzájemně spojené S-S můstky.
Podle těžkých řetězců rozlišujeme pět tříd gamaglobulinů: IgA, IgG, IgM, IgD a IgE.
Proteiny (reaktanty) akutní fáze (RAF)
RAF představují skupinu proteinů tvořící součást nespecifické imunitní odpovědi organismu v reakci na působení stresoru. Jejich produkci v játrech stimulují zánětlivé cytokiny (IL-1, IL-6 a TNFα). Mezi RAF patří například: CRP, alfa-1 antitrypsin, haptoglobin, koagulační faktory či složky komplementu.
Patologické změny plazmatických proteinů
V rámci různých patologických stavů dochází ke změnám v koncentraci plazmatických proteinů a často k typickým změnám průběhu elektroforetické křivky. Uvádíme zde nejtypičtější případy:
1) Akutní zánět
Dochází především ke zvýšené syntéze RAF, což se projeví vzestupem obou alfa-frakcí. V důsledku zvýšeného katabolismu se může mírně snížit hladina albuminu.
2) Chronický zánět
Na křivce je vidět vzestup gama-frakce, a to ve všech jejích složkách (polyklonální hypergamaglobulinémie / hyperimunoglobulinémie), a také mírný vzestup alfa-frakcí (tvorba RAF).
3) Chronická hepatopatie
Typicky se vyskytuje u stavů těžké jaterní fibrózy a cirhózy. Syntetická funkce jater je snížená, což se na křivce projeví poklesem proteinů, které játra produkují (albumin, alfa i beta frakce). Gama-frakce je naopak kvůli průběhu chronického zánětu zvýšená. Zvýšené je i IgA – na elektroforetické křivce v oblasti mezi beta a gama frakcemi (β-γ můstek).
4) Nefrotický typ
Při poruše filtrační glomerulární membrány (nefrotický syndrom) dochází ke ztrátám bílkovin ledvinami. Nejvíce se pokles projeví na nejmenších bílkovinách (albumin, gamaglobuliny). Proteiny o relativně větší Mr svůj podíl naopak zvyšují (i díky nastartované proteosyntéze snažící se o doplnění ztrát) – např. α2– makroglobulin, β-lipoprotein.
5) Monoklonální hyperimunoglobulinémie (monoklonální gamapatie)
Vzniká při nádorových onemocněních, při kterých dochází ke klonální produkci jednoho typu Ig (tzv. paraprotein). Typický je nález úzkého vysokého pruhu monoklonálně tvořené protilátky kdekoliv v oblasti beta a gama frakcí.
6) Hypogamaglobulinémie
Vzniká v důsledku primárního nebo sekundárního deficitu tvorby protilátek či v důsledku nadměrných ztrát imunoglobulinů. Typický nález je povšechný pokles v oblasti gama globulinů.
7) Malnutriční typ
Při dlouhodobém deficitu složek potravy dochází k výraznému poklesu albuminu, ale snížené jsou i ostatní frakce proteinů.
Autoři podkapitoly: Petra Lavríková a Josef Fontana