Náplň podkapitoly:
1. Úvod do vitaminů a výživy
2. Vitaminy rozpustné ve vodě
3. Vitaminy rozpustné v tucích
4. Výživa
5. Stopové prvky
_
Úvod do vitaminů a výživy
Definice a dělení vitaminů
Vitaminy představují heterogenní skupinu organických látek, které tělo až na výjimky nedovede syntetizovat, a tak musí být přijímány v potravě. Různé organismy mají různou schopnost produkce jednotlivých vitaminů. Proto látky vedené jako vitaminy pro člověka nemusí být esenciální pro jiné živočišné druhy. Kromě potravy jsou zdrojem některých vitaminů (vitamin K, biotin) i bakterie tlustého střeva, které tedy mají významný podíl na zajištění dostatečného množství těchto vitaminů v těle.
Stejné vitaminy se často vyskytují ve formě více sloučenin označovaných jako vitamery, jež se vzájemně liší strukturou (například vazbou různých substituentů nebo funkčními skupinami) a funkcí (např. vitamery vitaminu A: retinol, retinal a kyselina retinová).
Vitaminy můžeme obecně dělit dle polarity jejich molekuly (a tím i rozpustnosti ve vodě) do dvou skupin:
1) Vitaminy rozpustné ve vodě
Tyto vitaminy mají hydrofilní charakter, ale kromě něj se z chemického hlediska jeden druhému podobá jen málo. Jejich absorpce je snadnější než u vitaminů rozpustných v tucích. V krvi nevyžadují speciální transportní molekuly a při nadbytečném příjmu se vyloučí močí, proto u nich nehrozí riziko z předávkování. Do této skupiny patří vitaminy skupiny B a vitamin C.
2) Vitaminy rozpustné v tucích
Vesměs se jedná o deriváty isoprenu, které mají nepolární lipofilní charakter. Pro jejich vstřebávání je nutná neporušená resorpce lipidů. V krvi se jednak přenášejí prostřednictvím lipoproteinů (podobně jako jiné lipidy), jednak využívají specifické proteiny – vitamin D binding protein či retinol binding protein. Lipofilní charakter umožňuje jejich skladování v tukové tkáni (obecně v tkáních bohatých na lipidy), kde se mohou při nadbytku kumulovat, což zapříčiňuje jejich toxicitu při vysokém příjmu. Na druhou stranu tuková tkáň slouží při jejich nepravidelném příjmu jako sklad, odkud mohou být uvolňovány. Do této skupiny řadíme vitaminy A, E, D a K.
Provitaminy
Některé vitaminy se do těla dostávají ve formě prekurzorových molekul – provitaminů. Tyto látky nevykazují biologickou aktivitu, ale v organismu se přeměňují na molekuly vitaminů. Jako příklad lze uvést pigment β-karoten, provitamin vitaminu A.
Funkce a patologie vitaminů
Vitaminy obvykle potřebujeme jen v malém množství (řádově v mikro- a miligramech), ale jejich role v organismu je nezastupitelná. Mnoho vitaminů funguje jako kofaktory enzymů, a účastní se tedy enzymové katalýzy řady metabolických reakcí. Některé vitaminy patří mezi antioxidanty, chrání tak buněčné struktury před oxidačním stresem.
Nedostatek vitaminů, který může nastat z různých příčin (nedostatečný příjem vitaminů v potravě, poruchy střevní absorpce nebo metabolismu provitaminů), zaviňuje hypovitaminózy, v extrémních případech až avitaminózy. Ty se projevují (dle míry deficitu a druhu chybějícího vitaminu) různými příznaky – například onemocnění beri-beri z nedostatku thiaminu či kurděje při absenci vitaminu C. Patologické stavy se mohou vzácně vyvinout i v důsledku nadbytku některých vitaminů (zejména rozpustných v tucích) – nejčastěji vitaminu A a D. Jedná se o tzv. hypervitaminózy.
_
Vitaminy rozpustné ve vodě
Vitamin B1 (thiamin)
Vitamin B1 obsahuje ve své struktuře substituovaná jádra thiazolu a pyrimidinu. V organismu je jeho biologicky aktivní formou thiamindifosfát (thiaminpyrofosfát – TPP), tvořící se za účasti transferázy lokalizované v mozku a játrech.
Thiamindifosfát je kofaktor reakcí, během nichž dochází k transferu aktivovaného aldehydového zbytku. Jedná se o skupinu oxidativních dekarboxylací α-ketokyselin, kde spoluvytváří multienzymové komplexy (například komplex pyruvátdehydrogenázy). Druhá skupina reakcí s transferem aldehydového zbytku, kterých se thiamin účastní, tzv. transketolace, figuruje například v pentózovém cyklu.
Thiamin se v bohaté míře nachází v zevních vrstvách obalujících zrna obilovin, v kvasnicích (obsahují obecně vitaminy skupiny B), luštěninách, ve vepřovém mase či mléku. V bílém pečivu (pokud se nefortifikuje) a v loupané hlazené rýži je jeho obsah nízký. Doporučená denní dávka thiaminu činí 1,1 mg.
Při příjmu stravy chudé na vitamin B1 (například při zpracovaní obilovin odstraňujícím obaly zrn, jež obsahují thiamin) vzniká choroba beri–beri charakterizovaná poruchou metabolismu sacharidů a aminokyselin. Mezi její příznaky patří periferní myopatie, vyčerpanost, anorexie. Později nastupují otoky, kardiovaskulární, neurologické a svalové poruchy. Toto onemocnění se dříve masově objevovalo zejména v jihovýchodní a východní Asii, kde byla hlavní potravinou loupaná rýže, která kvůli odstranění osemení již žádný vitamin B1 neobsahuje.
U chronických alkoholiků dochází po létech abusu k rozvoji tzv. Wernickeho encefalopatie s neurologickými příznaky.
Vitamin B2 (riboflavin)
Chemická struktura riboflavinu (lat. flavus – žlutý) obsahuje alkohol ribitol napojený na heterocyklické jádro.
V organismu je riboflavin fosforylací transformován do svých aktivních forem – flavinmononukleotidu (FMN) či flavinadenindinukleotidu (FAD). Ty tvoří prostetické skupiny oxidoredukčních enzymů zvaných flavoproteiny. Mezi nejznámější patří enzymy dýchacího řetězce, NADH-dehydrogenáza nebo sukcinátehydrogenáza.
Riboflavin obsahují droždí, játra, ledviny, vejce nebo mléko. Doporučená denní dávka činí 1,4 mg.
Nedostatek tohoto vitaminu naštěstí nezpůsobuje významnější potíže. Objevují se jen necharakteristické příznaky typické pro deficit vitaminů skupiny B – např. záněty v oblasti ústní dutiny (rty, jazyk, koutky úst), změny na kůži a zpomalené hojení ran.
Vitamin B3 (niacin)
Vitamin B3 je souhrnným názvem pro kyselinu nikotinovou a nikotinamid. Dříve býval označován jako vitamin PP (protipelagrový).
Biologicky aktivními formami v organismu jsou nikotinamidadenindinukleotid (NAD+) a jeho fosforylovaný derivát – nikotinamidadenindinukleotidfosfát (NADP+).
Jedná se o hojně rozšířené koenzymy cytosolických i mitochondriálních oxidoreduktáz. NAD+ bývá obecně kofaktorem oxidoredukčních enzymů oxidačních drah (jako je Krebsův cyklus), NADPH je součástí dehydrogenáz či reduktáz účastnících se tzv. redukčních syntéz – například v rámci metabolismu mastných kyselin či v pentózovém cyklu.
Působením přes speciální receptory spřažené s G-proteinem a exprimované zejména v tukové tkáni (ale i ve slezině a buňkách imunitního systému) inhibuje kyselina nikotinová lipolýzu a uvolňování volných mastných kyselin z tukové tkáně. To snižuje jejich dostupnost při syntéze lipoproteinů v játrech a plazmatické hladiny VLDL (a následně i LDL a celkového cholesterolu) klesají. Nikotinamid tento efekt nemá.
Dobrými zdroji niacinu jsou játra, ryby (i jiné maso), kvasnice nebo otruby. Protože tělo dokáže niacin do jisté míry syntetizovat z esenciální aminokyseliny tryptofanu, příznaky nedostatku vitaminu B3 se projeví až při nepřítomnosti obou v přijímané potravě. Doporučená denní dávka tohoto vitaminu je poměrně vysoká – 16 mg.
Při nedostatku niacinu vzniká pelagra, „nemoc tří D“, charakterizovaná trojicí příznaků: dermatitis, diarea (průjem) a demence.
Vitamin B5 (kyselina pantothenová)
Vitamin B5 tvoří šestiuhlíkatá větvená hydroxykyselina – kyselina pantoová vázaná na β-alanin. Název pro kyselinu pantothenovou se odvozuje z řeckého pantothen – všude se nacházející. Vitamin B5 se vskutku nachází v řadě potravin rostlinného i živočišného původu (blíže viz dále).
Pantothenát, prekurzor koenzymu A, funguje v metabolických drahách jako přenašeč acylových zbytků. Mezi nejvýznamnější reakce, jichž se koenzym A účastní, patří reakce Krebsova cyklu, syntézy i degradace mastných kyselin nebo syntézy cholesterolu. Význam vitaminu B5 je tedy značně široký.
Jak již bylo uvedeno výše, kyselina pantothenová se vyskytuje v mnoha přístupných druzích potravin, například v luštěninách, celozrnných obilných produktech, masu, vnitřnostech či v kvasnicích. Proto je její nedostatek, spojený s poruchami kůže a atrofií vlasových folikulů, velmi vzácný. Doporučenou denní dávku činící 6-10 mg většinou není problém dodržet.
Vitamin B6 (pyridoxin)
K vitaminu B6 řadíme tři příbuzné pyridinové deriváty se stejnou biologickou účinností – pyridoxol (pyridoxin), pyridoxamin a pyridoxal.
Všechny tři musí být vnitřní transformací a fosforylací enzymem pyridoxalkinázou, přítomnou ve většině tkání těla, přeměněny na pyridoxalfosfát (PLP), biologicky účinnou formu vitaminu B6.
Pyridoxalfosfát funguje jako kofaktor mnoha enzymů účastnících se metabolismu aminokyselin, např. aminotransferáz (transamináz) či dekarboxyláz. Při těchto reakcích se vážou aldehydové skupiny pyridoxalfosfátu na aminoskupinu aminokyseliny a vzniká tzv. Schiffova báze.
Dalším enzymem, který vyžaduje přítomnost pyridoxalfosfátu jako kofaktoru, je glykogenfosforyláza, umožňující štěpení glykogenu.
Vitamin B6 se nachází v mnoha potravinách rostlinného i živočišného původu. Jako příklad můžeme uvést játra, maso (včetně ryb), celozrnné produkty, ořechy, zeleninu (brambory, zelí, mrkev) či banány a avokádo. Doporučená denní dávka činí 2 mg.
Izolovaný deficit vitaminu B6 je vzácný, častěji souvisí i s deficitem ostatních vitaminů skupiny B. Deficit se pak projeví příznaky charakteristickými ve větší či menší míře i pro nedostatek ostatních vitaminů skupiny B: dermatitidy, záněty sliznic (zejména dutiny ústní) a poruchy CNS. Dochází i k poruše metabolismu tryptofanu.
Nedostatek může být vyvolán i některými léky, například antituberkulotikem isoniazidem. Ten tvoří s vitaminem B6 komplex, který znesnadňuje jeho funkci.
Vitamin B7 (biotin, dříve vitamin H)
Vitamin B7 je derivátem imidazolu. Působí jako kofaktor enzymů katalyzujících karboxylační reakce, kde má úlohu přenašeče CO2. Za tímto účelem vzniká aktivovaný meziprodukt kaboxybiotin. Mezi příklady reakcí, kterých se biotin účastní, patří biosyntéza mastných kyselin (kde je kofaktorem acetyl-Co-A karboxylázy) nebo anaplerotická reakce syntézy oxalacetátu z pyruvátu (působí jako kofaktor pyruvátkarboxylázy).
Z větší části je biotin tělu dodáván prostřednictvím jeho syntézy střevními bakteriemi. Zdroje v potravě (jako játra, maso, kvasnice nebo ořechy) tak nemají v jeho příjmu úplně zásadní význam. Nutriční deficit se proto téměř nevyskytuje a nedostatek biotinu je zapříčiněn spíše poruchami jeho využití. Například vaječný bílek obsahuje glykoprotein avidin, který s biotinem tvoří pevnou vazbu a brání tak jeho resorpci. Nedostatečnou produkci ve střevě a deficit biotinu může poškozením střevní mikroflóry vyvolat také užívání antibiotik. Absence biotinu se projevuje například svalovými bolestmi, dermatitidami, nechutenstvím či psychickými poruchami (deprese, halucinace).
Vitamin B9 (kyselina listová)
Kyselina listová (lat. folium – list) a její deriváty, foláty, jsou tvořeny kyselinou pteroylglutamovou obsahující pteridin s navázanou kyselinou p-aminobenzoovou (PABA) a kyselinou glutamovou. Tyto sloučeniny (foláty a kyselinu listovou) společně označujeme jako folacin.
V potravě jsou foláty přítomné převážně ve formě polyglutamátů (obsahujících v molekule víc glutamátových zbytků), které se v tenkém střevě enzymaticky štěpí na monoglutamáty s mnohem vyšší vstřebatelností.
Ve střevních buňkách jsou resorbované foláty nejprve přeměněny na dihydrofolát a následně enzymem dihydrofolátreduktázou (DHFR, za spotřeby NADPH) redukovány na svou aktivní formu, tetrahydrofolát (THF), který je uvolňován do krve. Kromě THF se v plazmě vyskytují i jeho deriváty 5-methyl-THF a 10-formyl-THF, syntetizované v játrech ze zachyceného THF a opětovně uvolňované do krve.
THF působí jako přenašeč jednouhlíkatých zbytků různého stupně oxidace (například methyl, methylen, methenyl či formyl), a umožňuje tedy činnost mnoha transferáz. Methylentetrahydrofolát je donorem methylové skupiny při syntéze thymidylátu (katalyzuje thymidylátsyntáza), prekursoru thyminu, a formyl-THF se účastní tvorby purinových bází (ve dvou krocích). Obě reakce jsou nepostradatelné pro syntézu DNA.
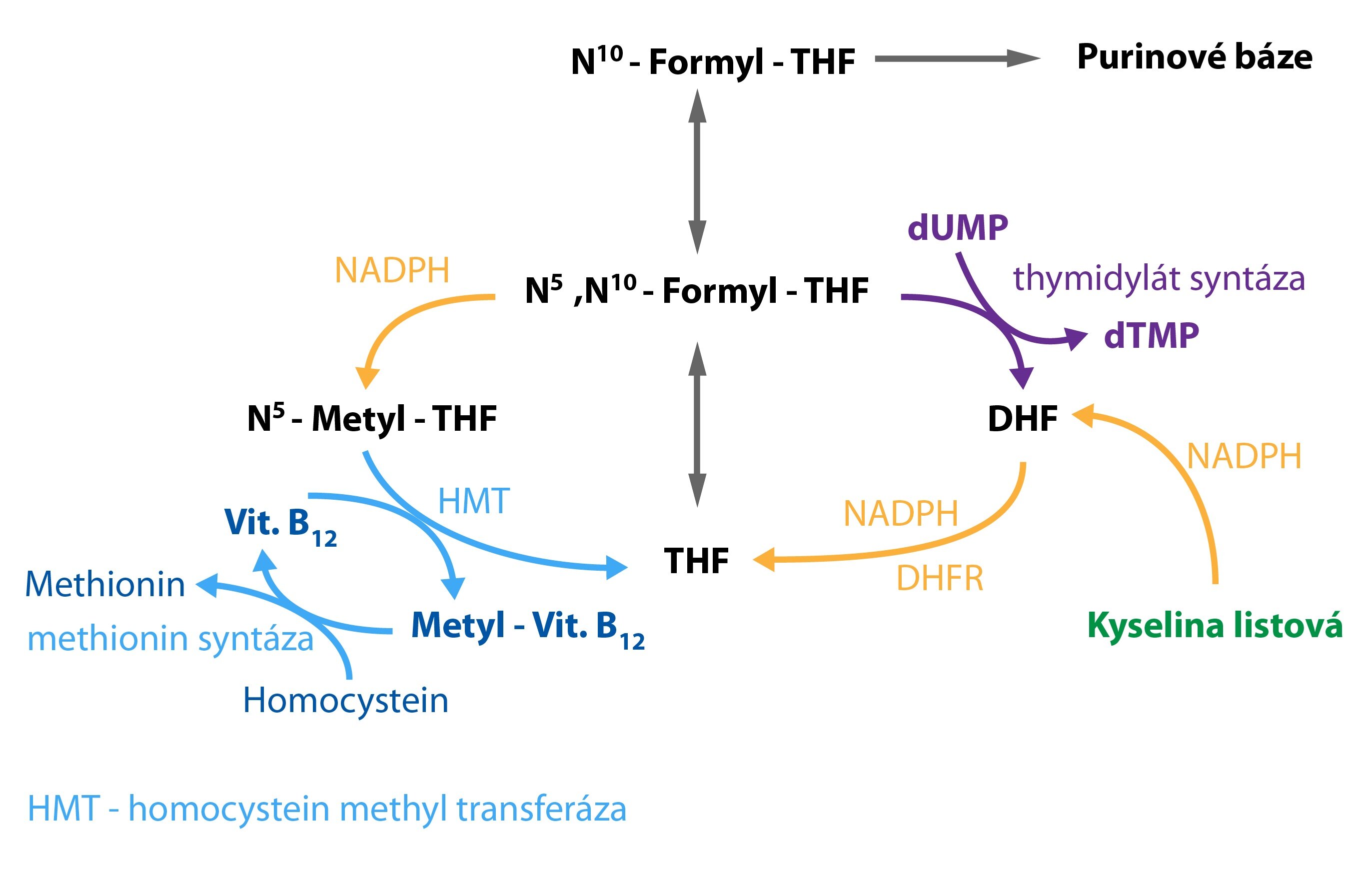
Cyklus folátu
Tetrahydrofolát se přeměňuje na methylen-THF (donorem methylenového můstku se stávají například aminokyseliny serin nebo glycin), který může být následně (viz obrázek):
1) Redukován (za spotřeby NADPH) na methyl-THF (nevratná reakce). Při obnově THF přenáší methyl-THF svoji methylovou skupinu na vitamin B12 (vzniká methylcobaltamin). K regeneraci vitaminu B12 dochází přenosem methylové skupiny na homocystein za vzniku methioninu (viz obrázek), reakci katalyzuje enzym homocysteinmethyltransferáza. Defekt tohoto enzymu nebo nedostatek vitaminu B12 tak mohou způsobit hromadění methyl-THF a příznaky nedostatku folátů.
2) Pro methylen-THF se nabízí další možnost být donorem uhlíkatých zbytků. Za katalýzy enzymem thymidylátsyntázou nastává při této reakci jeho přeměna na DHF a vznik dTMP. THF musí být z DHF opětovně obnoven enzymem DHFR.
Methylen-THF + dUMP ↔ dihydrofolát + dTMP
Syntézy nukleových kyselin se v buňkách účastní redukované formy folátů (10-formyl-THF a methylen-THF). Pokud tedy nedochází redukcí k recyklaci THF (a následně jeho derivátů), vzniká porucha syntézy DNA a rozvíjejí se symptomy nedostatku kyseliny listové.
Zdrojem folátu je listová i jiná zelenina, kvasnice, játra, maso, vejce či mléko. Také jej tvoří flóra tlustého střeva. Téměř vždy dostatečný příjem pokrývá doporučenou denní dávku 0,2 mg.
Při nedostatečném příjmu či působením léčiv (viz dále) se podobně jako u nedostatku vitaminu B12 rozvíjí makrocytární megaloblastická anemie (pro poruchu syntézy DNA). Zvýšený příjem folátu může naopak maskovat rozvoj poruchy krvetvorby při nedostatku vitaminu B12. Zde hrozí velké nebezpečí, protože jiné důsledky deficitu vitaminu B12 (zejména neurologické poruchy) se rozvíjejí dále.
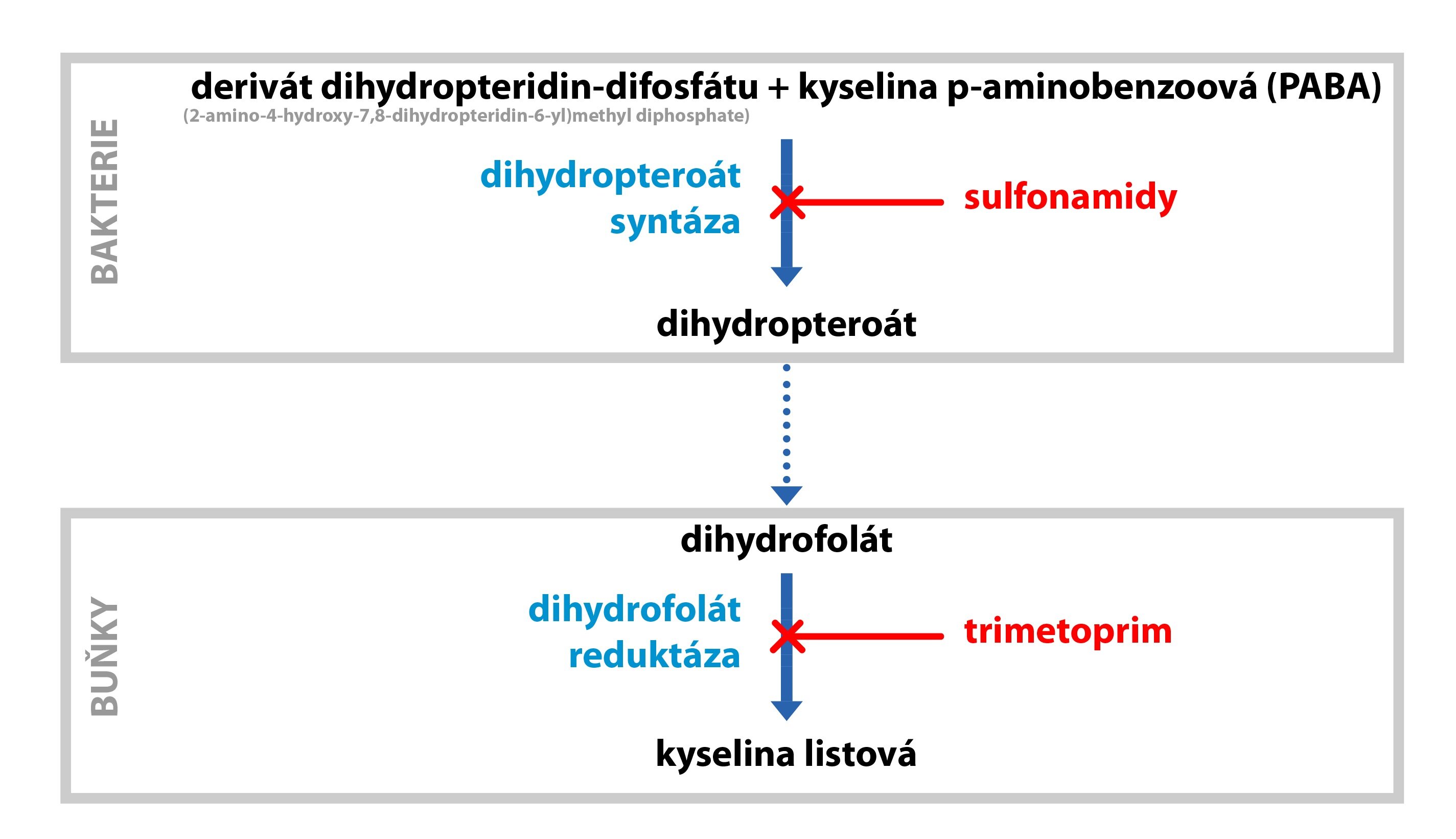
Příčinou příznaků nedostatku folátu může být i podávání léků působících jako kompetitivní inhibitory dihydrofolátreduktázy, mluvíme o tzv. antagonistech folátu (antifolika). Jedná se o cytostatikum metotrexát (chemicky se podobá dihydrofolátu), které účinně inhibují buněčné dělení, čehož se využívá například při léčbě některých hematologických malignit.
Metabolismus folátu ovlivňují také některá chemoterapeutika – sulfonamidy využívaná k léčbě vybraných infekcí. Lidský organismus neumí tvořit vlastní THF, zatímco patogenní bakterie to dokážou. Sulfonamidy se strukturně podobají p-aminobenzoové kyselině, která je substrátem pro tvorbu folátu. Bakterie se pokoušejí včlenit sulfonamidy do molekuly THF, ale výsledkem je nefunkční kofaktor. Sulfonamidy jsou tedy kompetitivními inhibitory enzymu podílejícího se na syntéze THF. Lidské buňky žádným způsobem nepoškozují.
Za významný považujeme i fakt, že kyselina listová zabraňuje vzniku některých vrozených vývojových vad (např. spina bifida) a předčasným porodům a potratům.
Vitamin B12 (kobalamin)
Struktura vitaminu B12 se podobá porfyrinovému kruhu. Základ ale tvoří korinový kruh, v jehož centru je navázán iont kobaltu.
Vitamin B12 je kolektivní název pro několik vitamerů lišících se přítomností různých substituentů a také funkcí. Můžeme se setkat s hydroxykobalaminem (-OH), methylkobalaminem (-CH3), kyanokobalaminem (-CN) či deoxyadenosylkobalaminem.
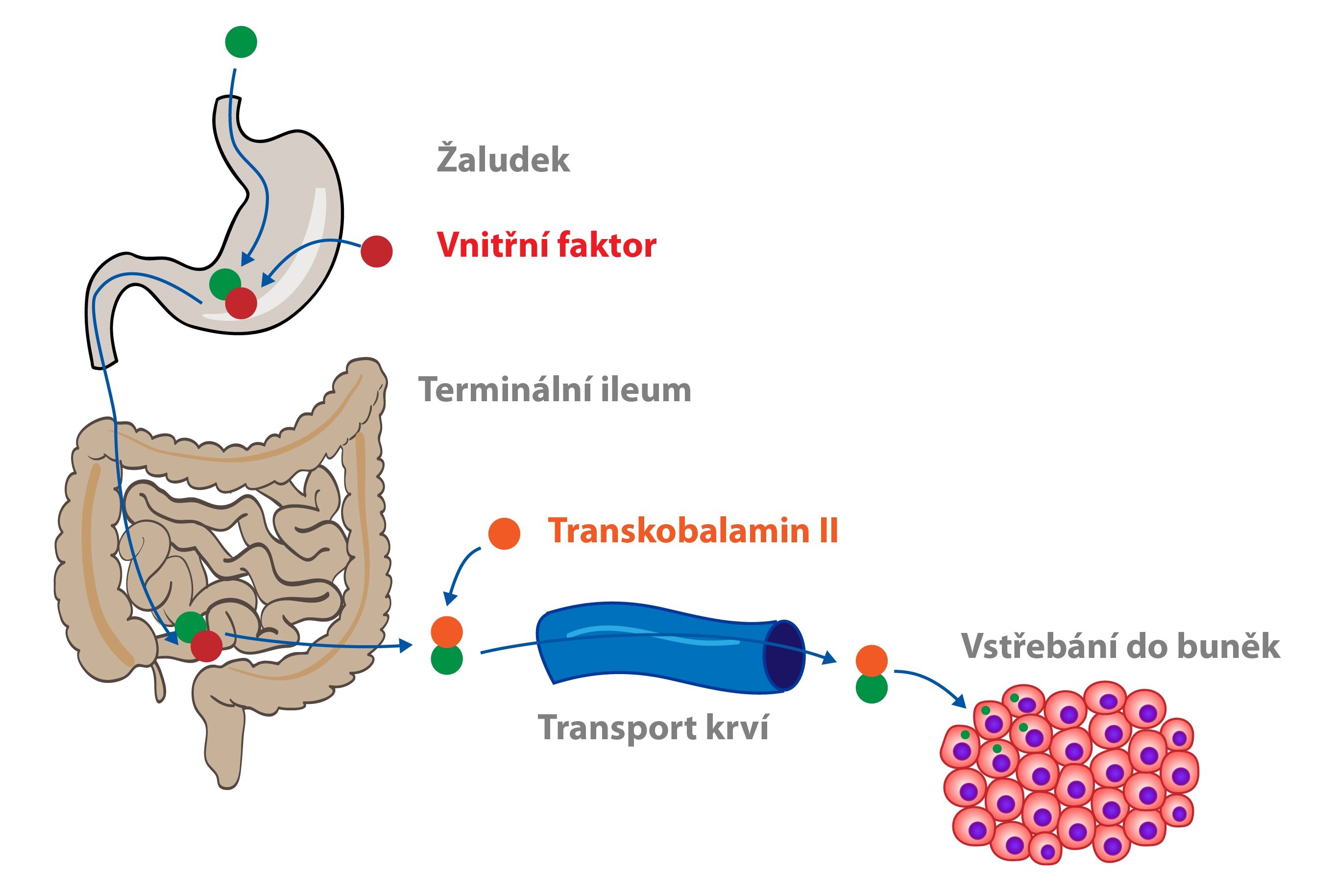
Pro efektivní resorpci vitaminu B12 se vyžaduje přítomnost tzv. vnitřního faktoru (IF, intrinsic factor), což je glykoprotein syntetizovaný parietálními buňkami žaludeční sliznice. Vnitřní faktor váže kobalamin (zevní faktor) a umožňuje jeho receptory zprostředkovanou endocytózu v oblasti terminálního ilea (receptorem je tzv. cubilin). V krvi je vitamin B12 transportován ve vazbě na plazmatický protein transkobalamin II, který také napomáhá jeho vstupu do buněk (endocytóza po navázání na specifický receptor). Pro vstup do buněk se kobalamin přemění na hydroxykobalamin. Celkové množství vitaminu B12 uchovávaného v těle činí 2-5 mg, hlavní zásobárnou jsou játra (kde je vázán na transkobalamin I). Tyto zásoby dokážou pokrýt potřebu vitaminu po dobu několika let.
V buněčném metabolismu se uplatňují aktivní formy vitaminu B12 – methylkobalamin (vznikající v cytosolu) a 5‘-deoxyadenosylkobalaminu (syntetizován v mitochondriích), v obou případech sloužící jako kofaktory enzymů.
Deoxyadenosylkobalamin je kofaktorem přeměny methylmalonyl-CoA na sukcinyl-CoA (katalyzuje metylmalonyl-CoA-mutáza) nezbytné pro zapojení propionátu do citrátového cyklu a pro průběh glukoneogeneze.
Methylkobalamin se účastní přeměny homocysteinu na methionin (enzym methioninsyntáza). Methylkobalamin je následně zpětně regenerován při přeměně methyltetrahydrofolátu na tetrahydrofolát, reakce tedy současně umožní i obnovu tetrahydrofolátu.
Kobalamin dovedou syntetizovat jen mikroorganismy, živočichové ho ale dovedou skladovat. Nutričně významnými zdroji vitaminu B12 jsou játra, vnitřnosti, maso, ryby, vejce, mléko a mléčné výrobky. Do rostlinných potravin se dostává jen při kontaminaci (např. pokud byly zpracovány mikrobiální fermentací – kysané zelí). Při příjmu výhradně rostlinné stravy tedy hrozí riziko jeho nedostatku. Vitamin B12 je syntetizován také bakteriemi tlustého střeva, ale k jeho resorpci tu již nedochází. Doporučená denní dávka vitaminu B12 činí 2-3 μg (nejnižší ze všech vitaminů).
Nedostatek kobalaminu vede ke vzniku makrocytární megaloblastické anemie způsobené poruchou syntézy DNA při nedostatku tetrahydrofolátu. Příčinou mohou být poruchy resorpce při nedostatku vnitřního faktoru (například důsledkem gastrektomie či pro autoimunitní zánět žaludeční sliznice) nebo při onemocnění ilea (resekce, záněty). Pokud za onemocněním stojí autoimunitní proces s produkcí autoprotilátek narušujících resorpci vitaminu z GIT (protilátky mohou být namířeny proti parietálním buňkám, vnitřnímu faktoru či brání vazbě komplexu vitamin B12-IF na receptor), mluvíme o tzv. perniciózní (zhoubné) anemii.
Další příznaky deficitu kobalaminu zahrnují zvýšenou hladinu homocysteinu, poruchy slizničních povrchů (např. záněty) a také poruchy nervového systému. Dochází k demyelinizaci axonů, již způsobuje nedostatek methioninu potřebného pro syntézu chlolinu, který je důležitou složkou fosfolipidů myelinových pochev. Toto postihuje zadní a postranní míšní provazce i mozkovou kůru. Neurologické změny mohou být i přes zahájenou terapii vitaminem B12 trvalé, poruchy krvetvorby naopak zpravidla odeznějí.
Vitamin C (kyselina L-askorbová)
Struktura vitaminu C se podobá glukóze, ze které je i syntetizován skrze kyselinu D-glukuronovou. Většina druhů dokáže vitamin C tvořit, neschopnost tvorby vitaminu C je spíše výjimkou – zahrnuje primáty a několik málo dalších druhů (např. morče).
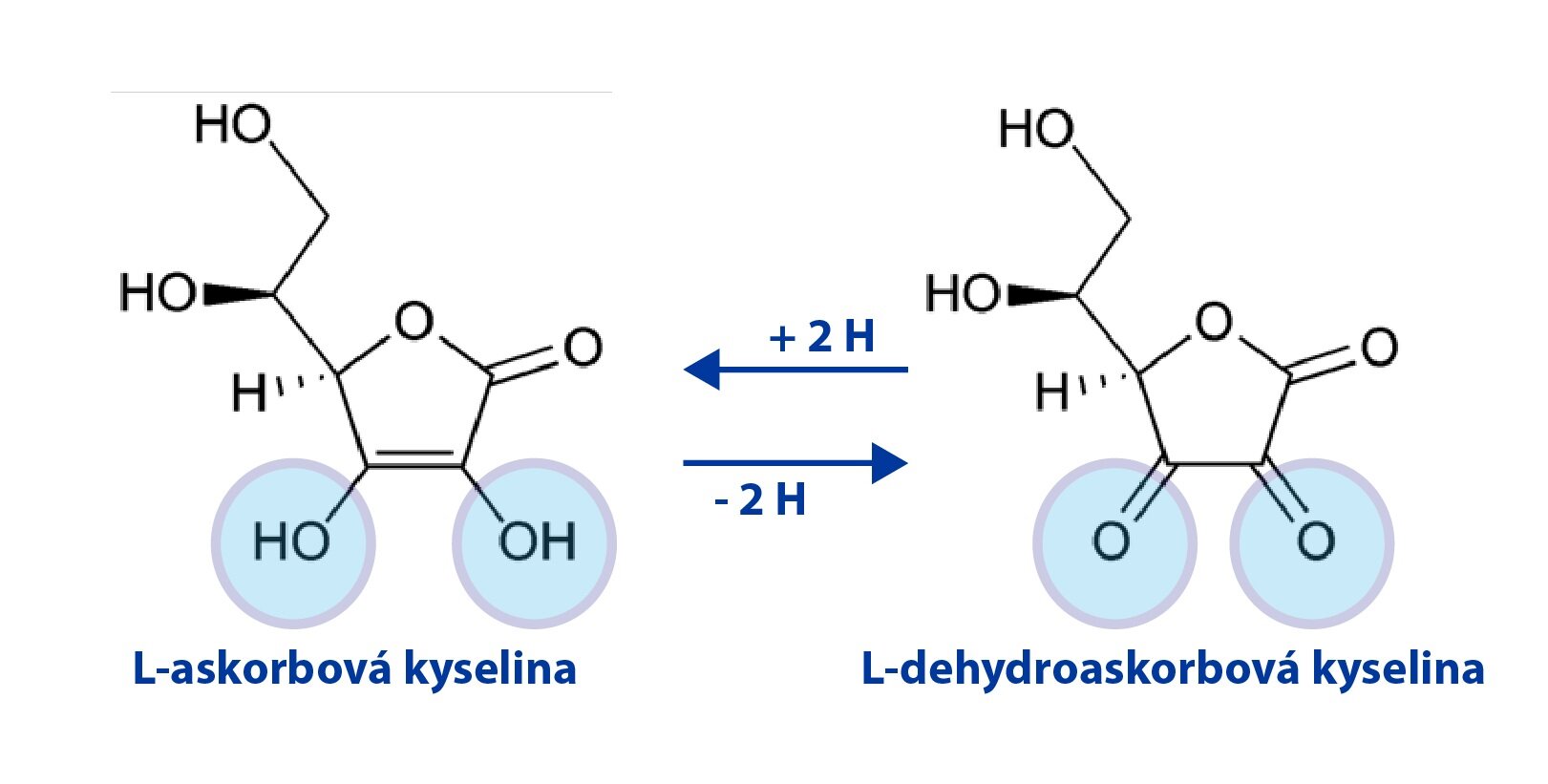
Kyselina L-askorobová představuje ve formě askorbátu a dehydroaskorbátu oxidoredukční systém, který funguje jako donor redukčních ekvivalentů.
Zapojuje se do procesů resorpce železa (redukuje Fe3+ na Fe2+), odbourávání tyrosinu, biosyntézy katecholaminů z tyrosinu či tvorby žlučových kyselin. Je také důležitým kofaktorem hydroxyláz prolinu a lysinu účastnících se syntézy kolagenu (důležité například pro hojení ran). Tvoří významný antioxidační systém chránící buňky před oxidačním stresem a zároveň umožňuje regeneraci jiných antioxidantů, například vitaminu E.
Obecně rozšířená představa citrusových plodů jako bohatého zdroje vitaminu C není úplně správná. Nejvíce vitaminu C obsahují černý rybíz, kapusta, květák nebo rajčata, zatímco citrusové plody se nacházejí někde v půlce žebříčku. Brambory samy o sobě nevykazují vysoký obsah vitaminu C (zvláště při dlouhém skladování), což ale kompenzuje jejich vysoká spotřeba, čímž se stávají jedním z jeho hlavních zdrojů. Vitamin C jen slabě odolává teplu a oxidaci – tepelná úprava potravin a kontakt s kovovým nádobím snižuje jeho obsah. Na rozdíl od ostatních vitaminů se doporučené denní dávky askorbátu pohybují řádově v desítkách miligramů (60-80 mg za den).
Deficit vyvolává dobře známé onemocnění, skorbut (kurděje). Charakterizuje jej porucha syntézy kolagenu (pro nedostatečnou hydroxylaci prolinu a lysinu) a z ní vyplývající snížená odolnost sliznic a kůže, poškození kapilár umožňující vznik krvácení, ztráta zubů (poškození fixačních kolagenních fibril) i poruchy osifikace. V dnešní době se jedná o vzácné onemocnění, dříve ovšem často postihovalo, ba doslova ničilo námořníky na dlouhých plavbách.
Hypervitaminóza C neexistuje. Při extrémních příjmech se většina askorbátu vyloučí močí. Může však ovlivnit výsledky chemického vyšetření moči.
Historická korelace:
Vitamin C poprvé izoloval z tkáně nadledvin v roce 1927 Albert Szent-Györgyi. O deset let později byla tomuto maďarskému biochemikovi a fyziologovi udělena Nobelova cena za fyziologii a medicínu („for his discoveries in connection with the biological combustion processes, with special reference to vitamin C and the catalysis of fumaric acid“).
_
Vitaminy rozpustné v tucích
Vitamin A
Struktura a metabolismus
Zastřešujícím pojmem vitamin A se označuje skupina látek s biologickou aktivitou vitaminu A. Přírodní a syntetické formy bývají společně označovány jako tzv. retinoidy. V největší míře jsou v těle zastoupeny ve formě alkoholu – retinolu. Méně početnými formami jsou retinal a kyselina retinová.
Zdroj vitaminu A představují živočišné produkty, zejména rybí tuk, máslo, vejce a játra. K efektivní absorpci vitaminu A je potřeba žluč. Tělo může také na vitamin A přeměnit jeho provitamin β-karoten, což je tetraterpen přítomný v některých druzích zeleniny, hlavně v mrkvi. B-karoten (poskytuje dvě molekuly vitaminu A) se oxidativně (s použitím molekuly O2) štěpí na dvě molekuly retinalu. Ten se následně (za spotřeby NADPH) redukuje na retinol, nebo v malé míře oxiduje na kyselinu retinovou. Retinol se ukládá do zásoby v Itových buňkách jater.
V krvi je retinol transportován ve vazbě na plazmatický retinol vázající protein (RBP, retinol binding protein). Proteiny stejné rodiny existují i intracelulárně a při jejich syntéze se předpokládá důležitá role zinku. Zinek tak zasahuje do absorpce, transportu i utilizace vitaminu A a kromě toho je kofaktorem enzymu konvertujícího retinol na retinal. Nedostatek zinku se tak může projevit i poruchami z nedostatku vitaminu A. Doporučená denní dávka vitaminu A činí 800 μg. Vitamin A je jedním z vitaminů, jejichž nadměrný příjem může způsobit hypervitaminózu – viz dále v textu.
Funkce
Mechanismus působení vitaminu A je podobný steroidním hormonům. V buňce se váže na specifické receptorové proteiny a vytvořený komplex následně ovlivňuje expresi určitých genů v jádře.
Svým působením na transport oligosacharidů přes buněčné membrány se kyselina retinová spolupodílí na syntéze glykoproteinů a glykolipidů a podporuje tak růst a diferenciaci tkání, zejména epitelů. Některá od vitaminu A odvozená léčiva, označovaná jako retinoidy, se v dermatologii využívají k terapii onemocnění jako akné nebo psoriáza.
Retinal je jako 11-cis-retinal ve vazbě na protein opsin součástí rhodopsinu, zrakového pigmentu. Při působení světla nastává štěpení zrakového pigmentu za vzniku all-trans-retinalu, který následně zpětně regeneruje na 11-cis-retinal. Protože se kyselina retinová nemůže redukovat na retinal, tohoto procesu se neúčastní. Více informací viz: Kapitola 13.
U retinolu a kyseliny retinové se předpokládají také antikarcinogenní účinky. Podíl na nich má i β-karoten, a to svým antixoxidačním působením.
Poruchy příjmu
Nedostatek vitaminu A se projeví poruchou syntézy glykoproteinů a glykolipidů. Typickým příznakem je keratinizace (rohovění) epiteliálních tkání, atrofie sliznic a snížená sekrece slizničních žláz, která vede k osychání povrchu sliznic. Vzniklá xeroftalmie (snížená sekrece slz) může dokonce přivodit až slepotu. Další projev, tzv. hemeralopii (šeroslepost, porucha vidění za šera), způsobuje zhoršená adaptace oka na tmu.
U vitaminu A má význam při nadměrném příjmu jeho toxicita. Hypervitaminóza A umí naše tělo trápit různými způsoby: poškozením jater, nauseou, zvracením, průjmy, hubnutím, ale i vznikem alopecie (oblasti s vypadáváním vlasů), zvýšenou fragilitou kostí či krváceními. Významný je také teratogenní efekt vitaminu A. Hypervitaminóza A nehrozí při zvýšené konzumaci β-karotenu, protože tělo jeho konverzi na retinoidy umí kontrolovat. Jediným následkem tedy zůstává oranžové zabarvení kůže a séra.
Vitamin E (tokoferol)
Struktura a příjem
Vitamin E souhrnně označuje čtyři izomery tokoferolu (α, β, γ a δ) a čtyři izomery tokotrienolu (α, β, γ a δ), z nichž nejvyšší biologickou aktivitu má D-α-tokoferol. Všechny jsou tvořeny chromanolovým kruhem a hydrofobním fytylovým vedlejším řetězcem zapříčiňujícím špatnou rozpustnost ve vodě, a naopak dobrou lipofilitu. Tokoferoly proto snadno pronikají do buněčných membrán a stávají se jejich součástí. Na chromanolovém kruhu je připojena jedna hydroxylová skupina jako dárce vodíkových atomů, podmiňující antioxidační účinek látky, a methylové skupiny, jejichž různý počet určuje konkrétní tokoferol. Nejrozšířenější D-α-tokoferol má také největší antioxidační aktivitu.
Funkce a poruchy příjmu
Vitamin E patří mezi nejdůležitější přirozené antioxidanty a vychytávače (scavengery) reaktivních forem kyslíku. Působí zejména proti peroxidaci polyénových kyselin fosfolipidů buněčných membrán, ve kterých se hromadí. Ochranný účinek se uplatňuje i na lipoproteinových částicích, například LDL. Tokoferol tedy velmi účinně snižuje míru lipoperoxidace. Sám při tom podléhá oxidaci a vytvořené radikály se regenerují například s vitaminem C nebo podléhají další přeměně, při níž se nepárového elektronu zbaví a následně jsou v konjugátech s kyselinou glukuronovou vyloučeny žlučí.
Kromě toho účinkuje synergicky se selenem přítomným v glutathionperoxidáze, enzymu působícím antioxidačně proti vzniklým peroxidům.
Nedostatek vitaminu E (vzniklý hlavně v souvislosti s malabsorpcí tuků) se projeví nadměrnou tvorbou kyslíkových radikálů a poškozením membrán, a to především v tkáních, kde je běžná vyšší koncentrace O2 (například erytrocyty, buňky dýchacího systému). Při jeho deficitu v těhotenství hrozí u novorozence nebezpečí anemie.
Vitamin D
Struktura a metabolismus
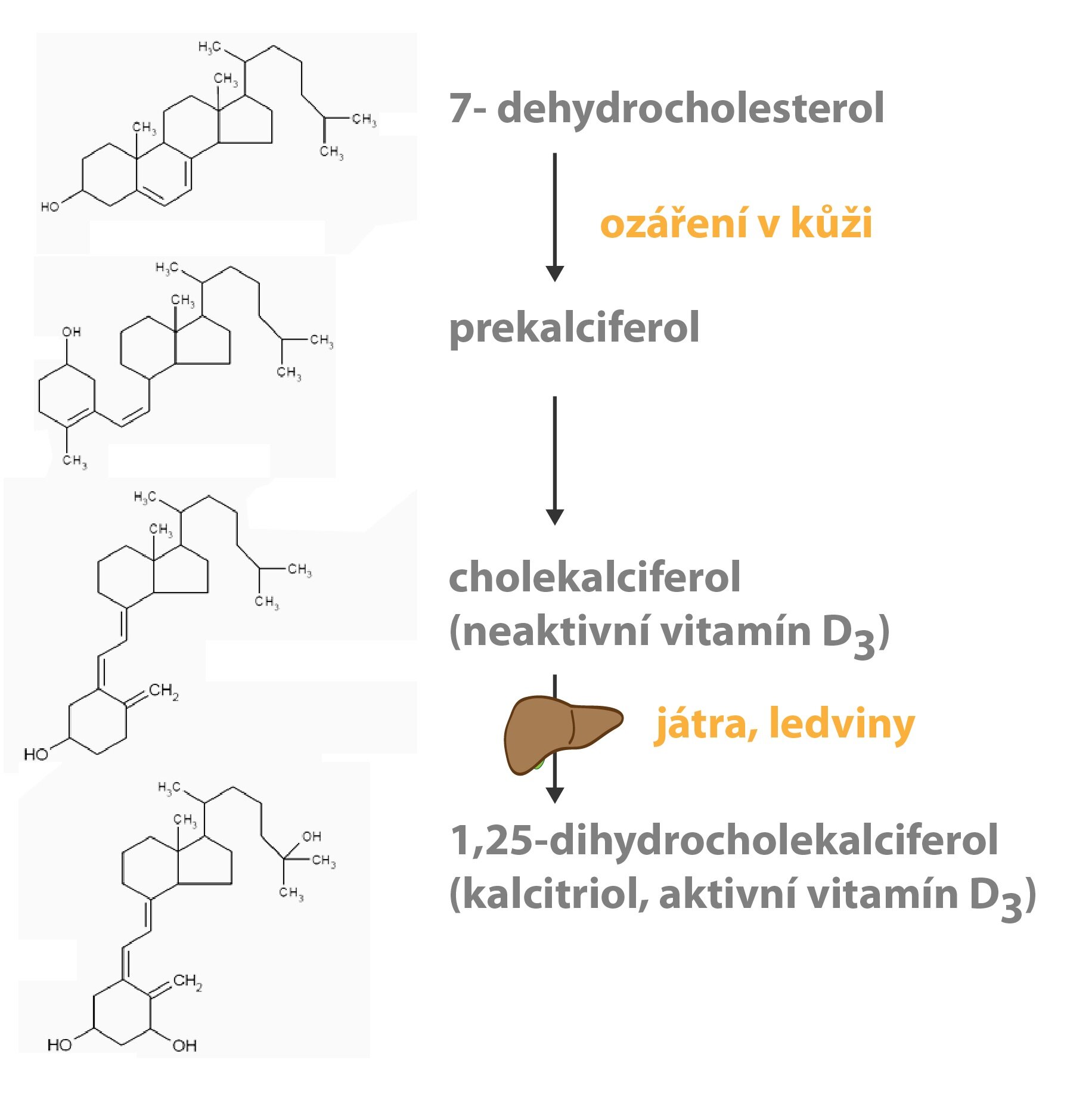
Vitamin D nazývaný kalciferol nebo kalciol se vyskytuje v několika formách. V rostlinách jako ergokalciferol (erkalciol, vitamin D2), v živočišných buňkách jako cholekalciferol (kalciol, vitamin D3). V pravém slova smyslu se jedná o prohormony (oba stejně účinné), ze kterých v organismu vzniká aktivní forma – kalcitriol (D2– nebo D3– kalcitriol).
Vitamin D, zejména ve formě vitaminu D3, se do těla dostává v potravě (játra, ryby, vejce, mléko), ale organismus ho dokáže také sám syntetizovat z jeho provitaminu 7-dehydrocholesterolu. Vitamin D3 se z něj tvoří fotolýzou UV zářením v buňkách epidermis. V játrech je nasyntetizovaný i potravou přijatý vitamin D3 hydroxylován na poloze 25 a vzniká 25-hydroxycholekalciferol. Protože vstupuje do enterohepatálního oběhu, poruchy tohoto oběhu mohou zapříčiňovat nedostatek vitaminu D. 25-hydroxycholekalciferol může být podle potřeby organismu dále hydroxylován na poloze 1 (výsledkem je účinný 1,25-dihydroxycholekalciferol neboli kalcitriol) nebo na poloze 24 (za vzniku neúčinného metabolitu). Enzymy katalyzující 1-hydroxylaci jsou přítomné v ledvinách, kostech a placentě. 24-hydroxylace se účastní enzymy nacházející se v ledvinách, střevu, chrupavce a placentě.
Funkce a poruchy příjmu
Vitamin D se ve své aktivní formě účastní regulace metabolismu vápníku a fosfátů. Kalcitriol stimuluje v tenkém střevě syntézu bílkovin umožňujících absorpci Ca2+ a fosfátů, tím zajišťuje jejich dostupnost pro stavbu kostí a souběžně aktivuje osteoblasty k syntéze kolagenu (další informace viz: Kapitola 7).
Hypovitaminóza vede k poruchám mineralizace kostí, která se u dětí projeví vznikem křivice (rachitis) charakterizované deformací lebky, páteře, hrudníku a dlouhých kostí. U dospělých se dekalcifikace kostí vyznačuje jejich měknutím – tzv. osteomalacie. Nedostatek vitaminu D může vyvolat nejen jeho nedostatečný příjem, ale i nedostatek slunečního záření či onemocnění ledvin.
Hypervitaminóza D se projevuje žízní, zvracením a průjmy, svěděním kůže a depozicí vápenatých solí v měkkých tkáních (například v cévních stěnách nebo v ledvinách).
Vitamin K
Struktura a zdroje
Skupina vitaminů K patří z chemického hlediska k derivátům naftochinononu. V rostlinách se nachází vitamin K1 (fyllochinon), živočichové disponují vitaminy K2 (menachinony), též syntetizovanými bakteriemi tlustého střeva. Vitamin K3 (menadion) se přirozeně nevyskytuje, ale je také biologicky účinný.
Vitaminy K přijímá tělo jednak v potravě (zejména listová zelenina, ovesné vločky, játra), ale při jejich absenci je dokáže plně zastoupit vitamin K tvořený střevními bakteriemi. Proto se hypovitaminóza z nedostatečného příjmu za normálních okolností téměř nevyskytuje.
Funkce a poruchy
Základní funkcí vitaminu K je jeho účast na procesu srážení krve. Působí totiž jako kofaktor karboxylázy, která umožňuje γ-karboxylaci glutamátových zbytků prekurzorových proteinů. Tato reakce je zásadní pro syntézu koagulačních faktorů II, VII, IX a X a také protisrážlivých proteinů C a S. Karboxylací vytvořené γ-glutamátové zbytky umožňují vazbu Ca2+ iontů potřebných pro průběh srážení. Při průběhu reakce dochází k oxidaci redukované formy vitaminu K. Následně je nutné tuto redukovanou formu regenerovat.
Existují látky schopné tuto reakci inhibovat. Mezi nejznámější patří deriváty kumarinu, například warfarin, které tak inhibicí zpětné redukce vitaminu K brání v syntéze příslušných faktorů srážení krve a působí tak antikoagulačně. Jejich antidotem jsou vyšší dávky vitaminu K.
Hypovitaminóza K je z důvodu jeho produkce střevní mikroflórou u dospělých osob vzácná. K nedostatku vitaminu K však může při nízkém příjmu dojít u novorozenců, a to kvůli nedostatečně vyvinutému bakteriálnímu osídlení tlustého střeva a relativně nízkému prostupu vitaminu K přes placentu. Důsledkem může být patologická krvácivost a prodloužení času potřebného ke srážení krve. U dospělých by k podobné situaci mohla vést kombinace nízkého příjmu vitaminu K a zničení střevní bakteriální flóry, například antibiotickou terapií.
Hypervitaminóza K se projevuje rozpadem erytrocytů (hemolýza).
_
Doporučené denní dávky pro vitaminy (dle vyhl. 450/2004 Sb.)
| Vitamin B1 |
1,1 mg |
| Vitamin B2 |
1,4 mg |
| Vitamin B3 |
16 mg |
| Vitamin B5 |
6 mg |
| Vitamin B6 |
1,4 mg |
| Vitamin B7 |
50 μg |
| Vitamin B9 |
200 μg |
| Vitamin B12 |
2,5 μg |
| Vitamin C |
80 mg |
| Vitamin A |
800 μg |
| Vitamin D |
5 μg |
| Vitamin E |
12 mg |
| Vitamin K |
75 μg |
_
_
Výživa
Živiny jsou látky, které organismus potřebuje pro svoji výživu a vývin. Jedná se o organické sloučeniny, ze nichž tělo katabolickými procesy (typicky oxidace) získává energii. Mezi základní živiny patří sacharidy, lipidy a proteiny. Z hlediska zisku energie jde zejména o sacharidy a lipidy, proteiny se v tomto směru uplatňují v menší míře. Látkou využívanou v metabolismu k zisku energie patří i etanol.
Kromě látek, které mají pro tělo energetický význam, si organismus pro přežití žádá také složky neenergetické, sloužící jiným účelům – voda, minerály, stopové prvky, vitaminy či vláknina.
Energetický zisk a výdej
Jednotlivé živiny se liší množstvím energie, kterou mohou oxidací uvolnit. Při úplném spálení by hodnoty uvolněné energie (spalného tepla) byly následující:
Sacharidy 16,7 kJ/g (4 kcal/g)
Proteiny 16,7 kJ/g (4 kcal/g)
Lipidy 37,7 kJ/g (9 kcal/g)
Etanol 29,3 kJ/g (7 kcal/g)
Rozdíly vyplývají z rozdílného stupně oxidace jejich molekul (zejména vysoký podíl nasycených vazeb v molekulách tuků jako příčina jejich téměř dvojnásobné energetické hodnoty).
Energetický výdej závisí na několika základních faktorech:
1) Bazální metabolismus (BM)
Tímto pojmem rozumíme množství uvolněné energie nutné k zajištění základních funkcí organismu. K měření BM musí být jedinec v bdělém stavu, klidu, teplotně neutrálním prostředí a lačnící (čili nejméně 12 hodin po posledním příjmu potravy). BM, úměrný beztukové tělesné hmotnosti a velikosti povrchu těla, má tendenci s rostoucím věkem se snižovat. Častěji než měřením vypočítáváme hodnotu BM odhadem z rovnic – např. Harris-Benedictova rovnice, která bere do úvahy pohlaví, věk, výšku a hmotnost.
2) Termogenní účinek potravy (tzv. specificko dynamický efekt)
Termogenní účinek potravy představuje ta část energie, která se spotřebuje k trávení přijaté potravy. Na celkovém energetickém výdeji se podílí okolo 5-10 %.
3) Fyzická aktivita
Fyzická aktivita tvoří největší podíl na rozdílech v energetickém výdeji mezi jednotlivci. Při náročné fyzické aktivitě může dojít k navýšení energetického výdeje oproti BM i několikrát.
4) Termogeneze
Termogeneze třesová i netřesová se spouští při poklesu teploty. Podobně se při přílišném nárůstu teploty aktivují mechanismy ochlazování těla.
Příjem živin v potravě
Kromě celkového energetického zisku je důležitý i správný poměr jednotlivých živin v stravě: 60-65 % sacharidy, 25-30 % tuky a 10-15 % bílkoviny.
Velké množství živin dokáže organismus syntetizovat sám z jiných sloučenin, jen jistou část představuje pro tělo skupina látek esenciálních (nepostradatelných). Denní potřeba ve značné míře závisí na věku, pohlaví, fyzické aktivitě a jiných faktorech. V průměru by měl jedinec přijmout minimálně 150 g sacharidů, 30 g proteinů a 35 g lipidů (i když organismus dokáže lipidy, kromě esenciálních, syntetizovat, při nižším příjmu trpí střevní absorpce lipofilních látek).
Bílkoviny jsou pro tělo zdrojem dusíku a esenciálních aminokyselin, které si nedokáže syntetizovat samo. Dusík se z organismu ztrácí převážně močí, stolicí, odlupujícími se buňkami kůže atd. Kromě kvantity přijímaných bílkovin je důležitá i jejich kvalita. Ta se hodnotí podílem esenciálních aminokyselin v dané potravě vůči jejich podílu ve správné výživě. Kvalitní proteiny obsahuje například vaječný bílek, maso či mléko.
Při nedostatečném příjmu živin se dostaví malnutrice – podvýživa. Může se jednat o:
1) Marasmus (prosté hladovění): nedostatečný přívod energie i bílkovin s proporcionálním snižováním tuku i beztukové hmoty v těle – např. anorexie. Hladina albuminu v plazmě je relativně normální nebo mírně snížená, nedochází k rozvoji otoků.
2) Kwashiorkor: nedostatečný přívod bílkovin (po kvalitativní i kvantitativní stránce) při zachovaném energetickém příjmu. Nenastává deplece tukových zásob, objevují se však otoky způsobené poklesem koncentrace plazmatických proteinů a s tím související změnou onkotického tlaku plazmy.
Karencí rozumíme izolovaný nedostatek některé z nutričních složek (vitaminy, stopové prvky, esenciální mastné kyseliny).
_
Stopové prvky
Železo
Železo je pro všechny živé tvory nepostradatelným prvkem. Existuje dokonce spekulativní teorie o původu života na Zemi, že první pokusy o metabolické pochody se objevily na povrchu na železo bohatých minerálů, hlavně disulfidu železnatého (FeS2).
Železo je komplikovaný prvek. Podobně jako další přechodné kovy může existovat v několika oxidačních stavech. V přírodě se v naprosté většině vyskytují železnaté a železité kationty, ačkoliv v některých enzymech byl detekován i kationt s oxidačním číslem +IV (např. cytochrom c oxidáza v mitochondriálním dýchacím řetězci) a sloučeniny obsahující železo v oxidačních stavech -II až VI byly uměle syntetizovány. Právě jeho schopností snadného přechodu z jednoho oxidačního stavu do druhého lze zdůvodnit, proč se tak často využívá jako katalyzátor biologických pochodů. Tato jeho vlastnost může ale také vyvolat problémy: volné železnaté kationty mohou například darovat jeden elektron molekule kyslíku a tím vytvořit potenciálně nebezpečný superoxid (O2–·). Proto nepřekvapí, že naše buňky vynakládají kvanta energie, aby striktně udržovaly koncentraci volného železa.
Další problém týkající se železa spočívá v tom, že se v přírodě většinou vyskytuje vázané, a to ve velmi slabě rozpustných sloučeninách. Z tohoto důvodu je jeho dostupnost pro metabolické potřeby organismu značně omezená, ačkoliv se jedná v našem světě štědrém na kyslík o bohatě se vyskytující kov. Většina forem života musela proto vyvinout komplikované mechanismy pro shromažďování železa ze svého okolí.
Železo je nepostradatelné, ale i potenciálně nebezpečné, navíc se obtížně získává. Pojďme se podívat, jak se s těmito výzvami vypořádají naše buňky.
Vstřebávání a exkrece železa
Není překvapením, že veškeré železo, jež potřebujeme, fyziologicky získáváme ze stravy. Abychom si udrželi zdraví, potřebujeme denní dávku železa v rozmezí 10 až 20 mg (10 mg pro muže, 20 mg pro ženy, ty totiž ztrácejí více železa během menstruace). Ve svém těle celkem máme kolem 5 g železa, přičemž více než polovinu obsahují červené krvinky. Za normálních okolností padají téměř všechny ztráty železa na vrub odlupujících se mrtvých buněk kůže a střevní sliznice. Neexistuje žádná jiná fyziologická cesta exkrece železa, protože k tomu není důvod. Tělo by se nelogicky zbavovalo tohoto cenného prvku.
Železo se v trávenině vyskytuje v nesčetných druzích komplexů s aminokyselinami, sacharidy a dalšími živinami. K jeho vstřebání dochází převážně v duodenu. Luminální membrána enterocytů obsahuje přenašeč schopný přenášet několik kovů – nazývá se transportér dvojmocného kovu-1 (divalent metal transporter-1 čili dmt1). Jak už sám název napovídá, je tento přenašeč specifický pro kationty s oxidačním číslem +II. Aby mohl být absorbován, musí se nejdříve železitý iont redukovat pomocí reduktázy, o jejíž identitě se stále diskutuje. Jakmile jednou železnatý iont vstoupí do enterocytu, může být využit pro potřeby enterocytu, uložen do ferritinu nebo exportován do krevního řečiště pomocí přenašeče ferroportinu. Jak opouštějí Fe2+ ionty buňky, jsou díky hephaestinu oxidovány na Fe3+ a následně se vážou na transferin (Tf) – vysokoafinní přenašeč železa.
Významná část železa se v západní dietě vyskytuje ve formě hemu, který se vstřebává z tráveniny mnohem efektivněji pomocí dosud neobjeveného přenašeče. Uvnitř buňky je hem rozložen hemoxidázou a uvolněné železo zpracováno stejným mechanismem, jak jsme uvedli výše. Vstřebávání hemového železa z potravy se zdá být mnohem efektivnější než vstřebávání nehemového železa, zčásti i proto, že hem uvolněný proteolýzou z hemoglobinu, myoglobinu a dalších hemoproteinů je mnohem více rozpustný ve vodných roztocích než ostatní formy železa.
Transport a skladování železa
Každá molekula transferinu váže dva Fe3+ ionty a přenáší je krevním řečištěm na místo určení. Transferinové receptory (TfR) exprimované na buněčných membránách vážou transferin nesoucí železo. Nato je celý komplex receptor-ligand pohlcen endocytózou a vzniká intracelulární váček. Při pH 7 váže transferin železo velmi pevně. Pokles pH vede k snadnějšímu uvolnění železa z vazby. Buňka proto endosom acidifikuje pomocí protonových pump, čímž se železo snadněji uvolňuje z vazby na Tf, současně ho redukuje a transportuje ven z endosomu – opět pomocí dmt1. Komplex Tf-TfR je následně recyklován do cytoplazmatické membrány, kde je opět vystaven vyššímu pH, z důvodu mnohem nižší afinity apotransferinu k TfR disociuje komplex a apo-Tf si může začít hledat nové železité kationty.
Jak buňka zachází s Fe2+ v cytoplazmě, zůstává stále do velké míry neznámou. Obecně ale můžeme říci, že je buď skladováno ve formě ferritinu, nebo transportováno do mitochondrie, kde se účastní syntézy hemu a proteinů obsahujících železo, či zůstává v cytoplazmě jako nestabilní pool železa.
Protein ferritin umožňuje dlouhodobé skladování železa v nereaktivní, a tudíž bezpečné formě. Celkem 24 ferritinových podjednotek tvoří kulovité pouzdro kolem minerálu, jejž nazýváme ferrihydrid. Proteinová obálka oxiduje Fe2+ z vnějšku a přenáší ho do krystalového jádra molekuly. Železo skladované ve ferritinu je inertní a zdá se, že je mobilizováno pouze po pohlcení celé molekuly ferritinu lyzosomem. V některých tkáních mohou napůl strávené částice ferritinu agregovat, čímž se tvoří pigment nazývaný hemosiderin. Celkové tělesné zásoby železa lze odhadovat stanovením sérové hladiny ferritinu a saturace transferinu železem. Obě hodnoty se snižují u pacientů s nedostatkem železa, a naopak se zvyšují u pacientů s přetížením železem (např. kvůli opakovaným krevním transfúzím).
Regulace metabolismu železa
Jak zde již zaznělo, železo je jak nepostradatelné, tak i nebezpečné. Striktní kontrola jeho vstřebávání, transportu, využití i skladování je proto zcela nezbytná. Centrální roli v této regulaci hrají senzory sledující koncentraci volného železa.
Iron response element-binding protein-1 čili irp1 (protein vázající elementy responzivní na železo) mění svoji strukturu podle množství rozpuštěných Fe2+ ve svém okolí. Je-li koncentrace železa nízká, zaujímá „otevřenou” konfiguraci, a naopak při vysoké koncentraci železa „uzavřenou” konfiguraci. Otevřená konfigurace irp1 může vázat specifické sekvence RNA nazývané iron response elements (ire).
Exprese většiny proteinů je řízena na úrovni genové transkripce. Proteiny metabolismu železa jsou ale současně regulovány i na úrovni RNA translace. IRE obsažené v některých RNA transkriptech tvoří malé smyčky, do nichž se může aktivovaný (otevřený) irp1 vázat. Pokud jsou tyto smyčky lokalizovány na začátku kódujících sekvencí (na konci 5’), vazba irpů zablokuje přístup této RNA molekuly do ribosomu a tím se sníží produkce proteinu, který tento transkript kóduje. Na druhé straně, pokud jsou kličky umístěny na 3’ konci dané RNA, způsobí vazba irp1 zpomalení degradace transkriptu a tím i zvýšení tvorby kódovaného proteinu.
Logika metabolismu železa na buněčné úrovni je tedy následující: když se buňce nedostává Fe2+, irp1 se stane aktivním a váže se na RNA transkripty genů obsahující ire sekvence. Ty geny, které kódují proteiny zvyšující buněčnou koncentraci železa (například pomocí zvýšení uptaku), mají ire sekvence na konci 3’, a budou se tudíž stabilizovat vazbou irp1 – například RNA pro transferinový receptor či pro dmt1. Současně transkripty s ire smyčkami na 5’ konci nebudou translatovány na proteiny: toto ovlivní třeba ferritin. Jestliže je ovšem naopak příliš (nebo právě dostatečné množství) železa v buňce, irp1 se stane neaktivním, nebude se vázat na RNA a tvorba proteinů bude regulována pouze na úrovni transkripce.
Vstřebávání železa ve střevech kromě irp-ire mechanismu reguluje i hormon nazývaný hepcidin. Ten byl původně objeven jako antimikrobiální peptid – signalizační molekula zajišťující komunikaci mezi extraintestinílními tkáněmi (hlavně játry) a duodenem. Hepcidin je uvolňuje do krve jako odpověď na vysoké hladiny železa, váže se na extracelulární část přenašeče železa, ferroportinu, a způsobuje jeho fosforylaci a následnou degradaci. Výsledkem je snížené uvolňování železa z buněk do krve, což v případě enterocytů vede k snížení vstřebávání železa z potravy.
Poruchy metabolismu železa
Aby naše buňky mohly správně fungovat, potřebují optimální koncentraci železa: ta nesmí být ani vyšší, ale ani nižší, než činí optimální rozmezí. Nedostatek železa většinou způsobuje jeho nízký obsah v potravě; to můžeme vidět u lidí dodržujících extrémní životosprávu či častěji u populace starších, chronicky nemocných pacientů, kteří mnohdy trpí malnutricí. Nedostatek železa v organismu dále zapříčiňují jeho zvýšená spotřeba (např. během těhotenství) nebo nadměrné krevní ztráty (např. chronické krvácení doprovázející maligní tumory trávicího ústrojí).
Příznaky deficitu železa jsou, stejně jako u většiny potravních deficitů, spíše nespecifické: únava, bledost pokožky, mírné bolesti hlavy, dechová nedostatečnost, zvýšená tepová frekvence atd. To vše způsobuje zejména hlavní následek deficitu železa, který je současně nejzřetelnějším laboratorním nálezem – nízká hladina hemoglobinu v krvi neboli anémie. Anémii u deficitu železa, nazývanou sideropenická či hyposiderická, charakterizuje nález malých červených krvinek, jež obsahují snížené množství hemoglobinu. Tomuto typu anémie proto říkáme mikrocytární. Logika je zřejmá: nedostatek železa v těle znamená i nedostatek železa, které by mohlo být vneseno do molekuly hemu, a proto klesá tvorba hemoglobinu.
Nadbytek železa v těle má také různé příčiny. Může se jednat o přebytek v potravě (zvláště snadno vstřebatelného hemového železa), což se stává ve většině západních diet, kde hemové železo pochází převážně z červeného masa. Existují i některé důkazy, že toto přebytečné železo může zvyšovat riziko kardiovaskulárních onemocnění a některých druhů rakoviny. Přetížení železem je běžné u pacientů, kteří musí dostávat opakované krevní transfúze (pamatujte, že tělo nemá prakticky mechanismus, jak se železa efektivně zbavit). Mezi tyto pacienty patří jedinci s porušenou tvorbou hemoglobinu, např. u vrozených thalasemií.
Defekty ve složité regulaci mohou také způsobit nadměrnou akumulaci železa v těle. Skupina těchto onemocnění (zahrnuje různé defekty) se nazývá hemochromatóza. Pacienti s hemochromatózou trpí různými defekty hepcidinové signalizační kaskády. Tím pádem se porušuje komunikace mezi tkáněmi a enterocyty vstřebávají maximum dostupného železa, i když je v těle již železa nadbytek. Vzniklý přebytek železa je ukládán v mnoha tkáních, primárně ovšem v játrech, slinivce, srdci, kloubech a mozku, což vede k postupnému poškození těchto orgánů. Kvůli hemochromatóze se vyvíjí jaterní cirhóza, kardiomyopatie, diabetes mellitus, arthritis či kožní hyperpigmentace.
V současné době známe dvě varianty léčby přetížení železem: krvácení či podávání chelátorů železa, které umí vázat nadbytečné železo a jsou následně vyloučeny z těla. Jeden z klinicky významných chelátorů železa je deferoxamin (desferioxamin).
Měď
Funkce a nedostatek
Měď, důležitá součást mnoha enzymů, je pro naše tělo dalším prvkem nezbytným pro přežití. Podobně jako železo se i měď v organismu vyskytuje v různých oxidačních stavech (zejména Cu+ a Cu2+). Právě schopnost být donorem nebo akceptorem elektronů jí umožňuje participovat na oxidoredukčních reakcích. Je například součástí enzymů dýchacího řetězce (cytochromoxidázy) a antioxidačních enzymů (superoxiddismutáza). Jako složka lysyloxidázy se účastní vyzrávání kolagenu a elastinu a tím je důležitá pro správnou stavbu pojivových tkání. Při jejím nedostatku tak vznikají poruchy růstu a vývoje kostní tkáně a jiných pojiv. Měď se spolupodílí na absorpci a využití železa a syntézy hemoglobinu. Nedostatek mědi způsobuje anemii u dětí živených výhradně mlékem, protože její obsah v mléku je velmi nízký.
Měď nabízejí například luštěniny, maso, vejce a ryby.
Vstřebávání a exkrece mědi
Po resorpci, která u člověka probíhá pravděpodobně zejména v žaludku a horní části tenkého střeva, se měď váže na plazmatické proteiny (hlavně albumin). Ty ji portální krví transportují do jater, kde je vychytávána a následně zabudována do jiných proteinů, v nichž je zpětně secernována do krve. Většina mědi opouštějící játra se váže na ceruloplazmin, její hlavní plazmatický transportní protein přenášející až 90 % mědi. Na transportu mědi do extrahepatálních tkání se podílí také albumin a z malé části i aminokyseliny.
Kromě vazby na transportní proteiny může být měď v játrech i vyloučena do žluče. Hladina mědi v organismu je regulována právě na úrovni její exkrece a žluč představuje hlavní cestu pro její vyloučení.
Genetický defekt transportního proteinu ceruloplazminu způsobuje onemocnění nazývané Wilsonova choroba (hepatolentikulární degenerace). Jde o poruchu inkorporace mědi do ceruloplazminu, tudíž o její omezené vylučování z jater. Měď, kterou nepřenáší ceruloplazmin, se následně hromadí v různých tkáních, zejména v játrech, mozku nebo rohovce, a vyvolává příznaky signifikující jejich poškození (cirhóza, křeče, třes …).
Selen
Selen je součástí enzymu glutathionperoxidázy, která působí v organismu jako důležitý antioxidační systém chránící tělo před působením reaktivních metabolitů kyslíku a oxidačního stresu. Pravděpodobně z tohoto důvodu se selenu připisuje zásluha na zpomalení stárnutí a antikancerogenní efekt. Selen zlepšuje i funkce imunitního systému, podporuje činnost CNS, motilitu a vyzrávání spermií.
Selen je resorbován v duodenu, v játrech se neukládá, vylučují jej ledviny. Proto jeho plazmatické hladiny při nedostatečném příjmu rychle klesají.
Deficit selenu není vzácný, jeho příjem v populaci se obvykle pohybuje na hranici optimální dávky. Nedostatek selenu vede k postižení srdečního svalu (kardiomyopatie), ke zvýšenému riziku nádorových onemocnění a k poruchám imunity se snížením odolnosti vůči infekcím. Endemicky (jako tzv. Keshanská choroba) se juvenilní kardiomyopatie způsobené nedostatkem selenu v půdě a vodě popisují v některých oblastech Číny.
Zinek
Existuje množství enzymů (okolo 300), které ke své aktivitě vyžadují přítomnost zinku (například alkoholdehydrogenáza, karboanhydráza nebo laktátdehydrogenáza). Zinek se také jako součást transkripčních faktorů účastní syntézy DNA, a proto má význam při buněčné proliferaci, regeneraci tkání a hojení ran.
Zdrojem zinku jsou především maso, sýry, kvasnice, luštěniny, celozrnné obiloviny nebo kořenová zelenina. Jeho resorpci z rostlinných zdrojů snižuje vláknina a další látky. Po resorpci se zinek neukládá v játrech; menší část (asi 10 %) se vyloučí močí, zbytek je vyloučen žlučí. Většina zinku v krvi se transportuje ve vazbě na albumin, menší část je vázána jinými plazmatickými proteiny (transferin). Plazmatické hladiny železa a zinku se tak mohou vzájemně ovlivňovat, při vyšší koncentraci železa se snižuje resorpce zinku a naopak.
Deficit zinku se projeví poruchami imunity, růstu, hojení ran, popsána byla také hyperplazie prostaty.
Chrom
Biologicky aktivní formou chromu je jeho kation Cr3+. Chrom zasahuje především do metabolismu sacharidů. Působí jako jeden z glukózotolerančních faktorů a podporuje účinek inzulinu. Při jeho nedostatku se snižuje glukózová tolerance.
Zdroje chrómu představují maso, kvasnice, sýry nebo pšeničné klíčky.
Na rozdíl od trojmocného kationtu je expozice Cr6+ toxická, mohou se rozvinout alergické reakce (kontaktní dermatitis) a pravděpodobně se zvyšuje riziko vzniku nádorových onemocnění.
Mangan
Mangan, podobně jako i jiné kovové prvky, tvoří důležitou součást některých enzymů (superoxiddismutáza, pyruvátkarboxyláza …). Právě jeho působení v roli kofaktoru mitochondriální SOD je důležité pro odstraňování reaktivních metabolitů kyslíku, které se tvoří v průběhu elektronového transportního řetězce. Musíme zdůraznit i jeho význam pro funkci CNS a strukturu kostní tkáně.
Mangan obsahují například celozrnné obiloviny, sója nebo ořechy.
Při expozici vysokým koncentracím manganu (v minulosti zejména u lidí zaměstnaných v jeho těžbě a produkci) se rozvíjejí příznaky tzv. manganového šílenství. V počátečních fázích se projevuje podrážděností a změnami nálady a chování, v konečných stadiích parkinsonismem.
Jód
Zdrojem jódu, prvku nezbytného pro produkci hormonů štítné žlázy, jsou především mořští živočichové, rostliny pěstované v půdě bohaté na jód a jodidovaná sůl. Nedostatkem jódu trpěly především populace bez přístupu k moři a právě opatření zaměřená na jodidaci některých potravin (sůl, mouka) výrazně přispěla ke snížení výskytu onemocnění souvisejících s deficitem jódu v potravě (tzv. endemická struma).
Na vzniku poruch vyvolaných nedostatkem jódu se mohou podílet i látky označované jako strumigeny zasahující různým způsobem do normálního průběhu metabolismu jódu. Příkladem je thiokyanid, který soutěží s jodidy o transportní místa a snižuje tak jejich vychytávání štítnou žlázou přes Na+/I– symport.
Projevy provázející nedostatečný příjem jódu se označují jako poruchy z nedostatku jódu (tzv. IDD – iodine deficiency disorders) a zahrnují například strumu nebo kretenismus. Obecně se jedná o zvětšení štítné žlázy či o poruchy mentálních funkcí, růstu a plodnosti. K rozvoji strumy může vést i nadbytečný příjem jódu. Podrobněji tyto poruchy komentujeme v Kapitole 11.
_
Doporučené denní dávky pro minerální látky (dle vyhl. 450/2004 Sb.)
| Draslík |
2000 mg |
| Fosfor |
700 mg |
| Fluoridy |
3,5 mg |
| Hořčík |
375 mg |
| Chrom |
40 μg |
| Jód |
150 μg |
| Mangan |
2 mg |
| Měď |
1 mg |
| Molybden |
50 μg |
| Selen |
55 μg |
| Vápník |
800 mg |
| Zinek |
10 mg |
|
Železo
Autoři podkapitoly: Petra Lavríková, Josef Fontana a Jan Trnka |
14 mg |