Náplň podkapitoly:
1. Úvod do vztahů v intermediárním metabolismu
2. Cyklus hlad – sytost
3. Fyzická aktivita
_
Úvod do vztahů v intermediárním metabolismu
V Kapitole 2 – Přeměna látek a energie v buňce jsme popisovali jednotlivé metabolické dráhy a jejich regulace. Během této podkapitoly se pokusíme zasadit tyto znalosti do kontextu celého těla, podívat se na jejich vzájemné vztahy a zodpovědět si několik základních otázek – Co? Kde? Kdy? Jak? Proč? Klíčové pro nás bude pochopení, jakými proměnami prochází intermediární metabolismus po najedení, během hladovění a znovu po najedení, neboli jak probíhá tzv. cyklus hlad – sytost (starve – feed cycle). Dále se v této kapitole budeme zabývat problematikou metabolismu za fyzické aktivity.
Dříve než se ale zaměříme na jednotlivé metabolické situace, musíme definovat některé významné pojmy.
Energie a základní parametry jednotlivých živin
Energii můžeme měřit ve dvou základních jednotkách. SI jednotka se nazývá joule – J (N.m), dále se užívá jednotky kalorie – cal, přičemž platí:
1 cal = 4,18 J
1 J = 0,239 cal
Kalorie je definována jako energie potřebná k ohřátí 1 g H2O o 1 °C (z 15,5 na 16,5 °C). V energetickém metabolismu i v lékařství se častěji setkáváme s jejich násobky – kilojoule (kJ) a kilokalorie (kcal, „velká kalorie“):
1 kcal = 4,18 kJ
1 kJ = 0,239 kcal
Katabolismus (oxidace) všech živin vyžaduje kyslík a vede k produkci CO2 a H2O. V případě aminokyselin (proteinů) se kromě nich musí ještě vyřešit osud v nich obsaženého dusíku. Za normální metabolické situace se 95 % dusíku z jejich aminoskupin přemění na močovinu, zbylých 5 % je pak exkretováno jako amoniak (transportován v krvi jako glutamin). Asi 5 g proteinů/den se vyloučí stolicí a kůží. 1 g N pochází přibližně z 6,25 g proteinů.
Dusíková bilance vyjadřuje rovnováhu mezi příjmem dusíku v potravě a ztrátami dusíku (zjednodušeně množství dusíku v moči). Za normálních okolností vykazuje dospělý jedinec vyrovnanou dusíkovou rovnováhu (platí zde: N přijatý = N vyloučený). Pokud se zvýší příjem proteinů v potravě, jsou nadbytečné aminokyseliny katabolizovány a jejich aminoskupiny vyloučeny jako močovina či amoniak. Pozitivní dusíková bilance, kdy příjem proteinů v potravě převyšuje ztráty, nastává například při rekonvalescenci po onemocněních, v obdobích růstu či podáváním anabolických hormonů. Negativní dusíková bilance, kdy ztráty dusíku překračují jeho příjem, nastává například během hladovění, těžších onemocnění či podáváním katabolických hormonů.
Nyní si definujeme několik základních pojmů – respirační kvocient (RQ), energetická hodnota živin, energetický ekvivalent a energetický výdej.
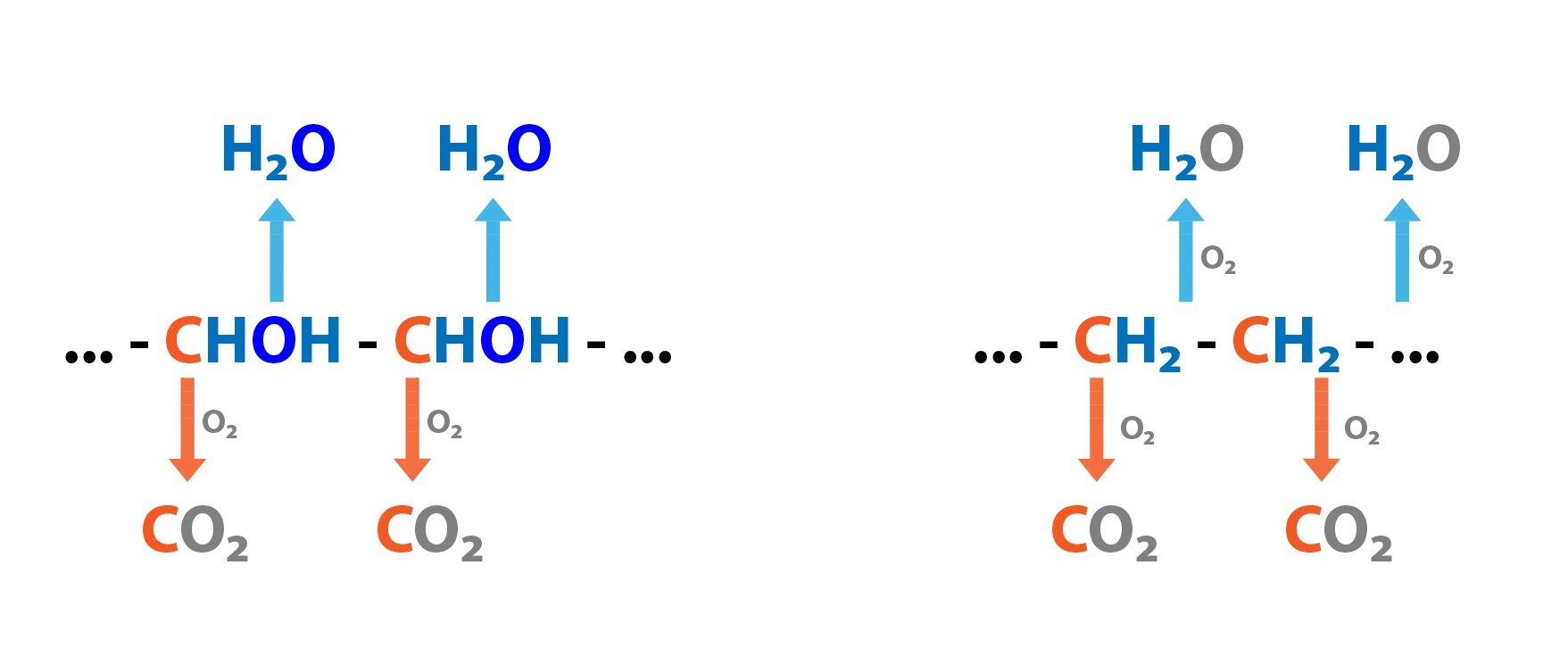
Respirační kvocient (RQ) se vypočítá jako množství vytvořeného CO2 ku množství spotřebovaného O2. Pro různé živiny nabývá různých hodnot. Nejnižší je pro lipidy – 0,71, následují aminokyseliny (proteiny) – přibližně 0,83 a nejvyšší hodnotu mají sacharidy – 1,0. Při anaerobním metabolismu činí hodnoty RQ >1,0.
1 g glukózy + 0,747 l O2 → 0,747 l CO2 + 0,6 g H2O RQ = 1,0
1 g proteinu + 1,031 l O2 → 0,859 l CO2 + 0,4 g H2O +0,16 g N RQ = 0,83
1 g TAG + 2,023 l O2 → 1,436 l CO2 + 1,07 g H2O RQ = 0,71
Energetickou hodnotou živin rozumíme energii uvolněnou oxidací 1 g živin. V případě sacharidů a lipidů je lhostejné, jestli k oxidaci dochází mimo tělo (tzv. přímá kalorimetrie) či v těle. Pro sacharidy činí 4,1 kcal/g, u lipidů se uvádí hodnota více než dvojnásobná – 9 kcal/g (v lipidech se tedy ukládá více energie než v sacharidech). V případě aminokyselin (proteinů) je situace poněkud složitější. Jejich oxidace v lidském těle totiž není úplná, a proto je jejich energetická hodnota v těle nižší – 4,1 kcal/g (jako pro sacharidy), než ta získaná přímou kalorimetrií – 5,3 kcal/g.
Energetický ekvivalent udává množství energie uvolněné spotřebou 1 l O2. Jeho hodnota činí přibližně 4,82 kcal/l. Přesné množství uvolněné energie závisí na oxidované látce: sacharidy – 21,1 kJ (5,05 kcal), proteiny 18 kJ (4,31 kcal) a lipidy 19 kJ (4,55 kcal).
Energetický výdej (EE, energy expenditure) je množství energie spotřebované za definovanou časovou jednotku.
Energetický výdej
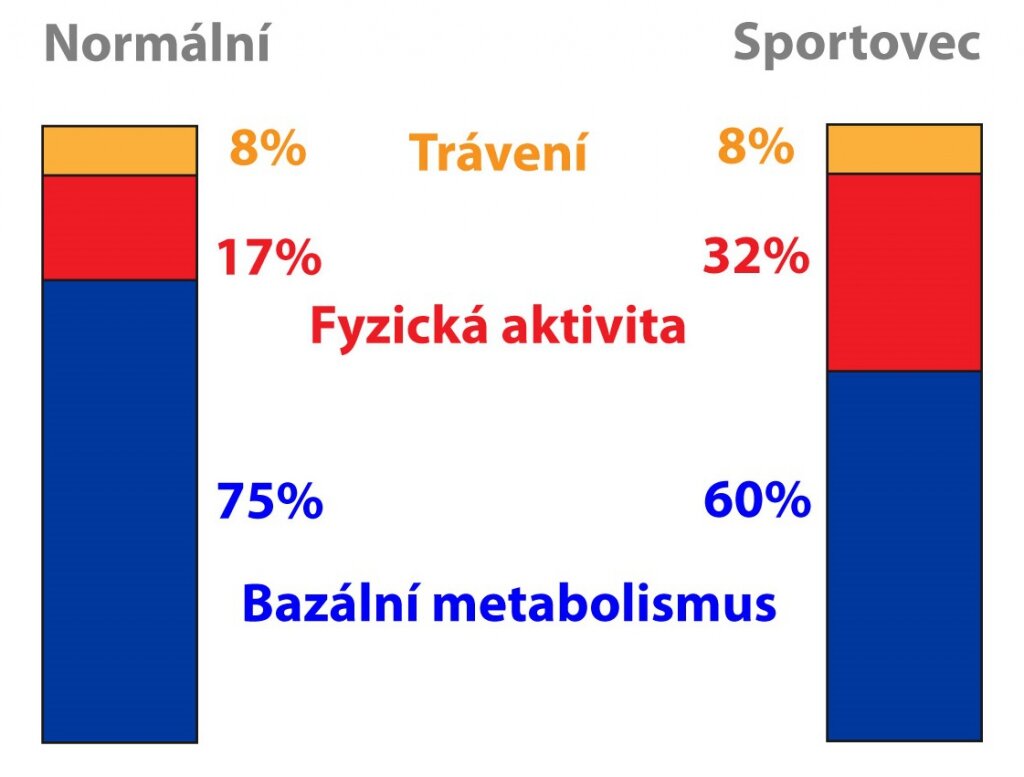
Energetický výdej sestává ze tří složek – rychlost bazálního metabolismu (basal metabolic rate – BMR, asi 60 %), dietou indukovaná termogeneze (asi 10 %) a fyzická aktivita (asi 30 %). Zastoupení fyzické aktivity je přitom nejvíce variabilní. Zjednodušeně se dá říci, že BMR se přibližně rovná 1 kcal/kg za hodinu, tedy 24 kcal/kg za den. Jeho hodnota závisí například na pohlaví (muži > ženy), věku (mladší > starší), tělesné teplotě či hladinách hormonů (stres, hormony štítné žlázy).
BMR je definován jako množství energie spotřebované v teplotně neutrálním prostředí, 12 hodin po posledním jídle (vyloučení efektu potravy a činnosti GIT), osoba musí být v celkově klidovém stavu (nesmí být stimulován ani CNS). Jde tedy o množství energie potřebné pro zajištění základních vitálních funkcí za bazálních podmínek.
Existuje několik vzorců pro odhad BMR. Nejčastěji se cituje ten z roku 1918 popsaný Harrisem a Benedictem – tzv. Harris-Benedictova rovnice, pro jejíž výpočet potřebujeme znát pohlaví, věk, výšku a váhu:
Harris-Benedictova rovnice pro ženy (BMR vychází v kcal/den):
BMR = 655,0955 + (9,5634 × váha v kg) + (1,8496 × výška v cm) – (4,6756 × věk v letech)
Harris-Benedictova rovnice pro muže (BMR vychází v kcal/den):
BMR = 66,473 + (13,7516 × váha v kg) + (5,0033 × výška v cm) – (6,755 × věk v letech)
V klinické praxi se přesná hodnota energetického výdeje stanovuje jen zřídka, většinou je dostačující jeho odhad stanovený na základě následujícího výpočtu:
EE = BMR x IF x AF x TF
IF (injury factor) – 1,0 u nestresovaného; 1,1 elektivní chirurgie; 1,5 septický šok
AF (activity factor) – 0,9 řízená ventilace; 1,0 klid na lůžku; 1,5 ambulantní nemocný nebo aktivně rehabilitující
TF (temperature factor) – při 37 °C činí 1,0, s každým stupněm tělesné teploty se TF mění o 0,1
Pokud se požaduje žádoucí přesnější stanovení energetického výdeje, využívá se nejčastěji metoda nepřímé kalorimetrie založená na principu měření spotřeby O2, výdeje CO2 a odpadu dusíku v moči.
Energetická homeostáza
Energetická bilance vyjadřuje poměr příjmu energie k jejímu výdeji. Pozitivní bilance vede k obezitě, negativní k podvýživě. Za centrum příjmu potravy bývá považován hypotalamus. Zjednodušeně se dá říci, že laterální hypotalamus vnímáme jako centrum hladu a mediální hypotalamus (nc. ventromedialis) jako centrum sytosti. Aferentními signály jsou například hormony – leptin (informuje o stavu tukových zásob), ghrelin, cholecystokinin či inkretiny (informují o přítomnosti či naopak nepřítomnosti potravy v GIT). Bližší informace viz: Podkapitola 12/9.
_
Cyklus hlad – sytost
Stav najedení
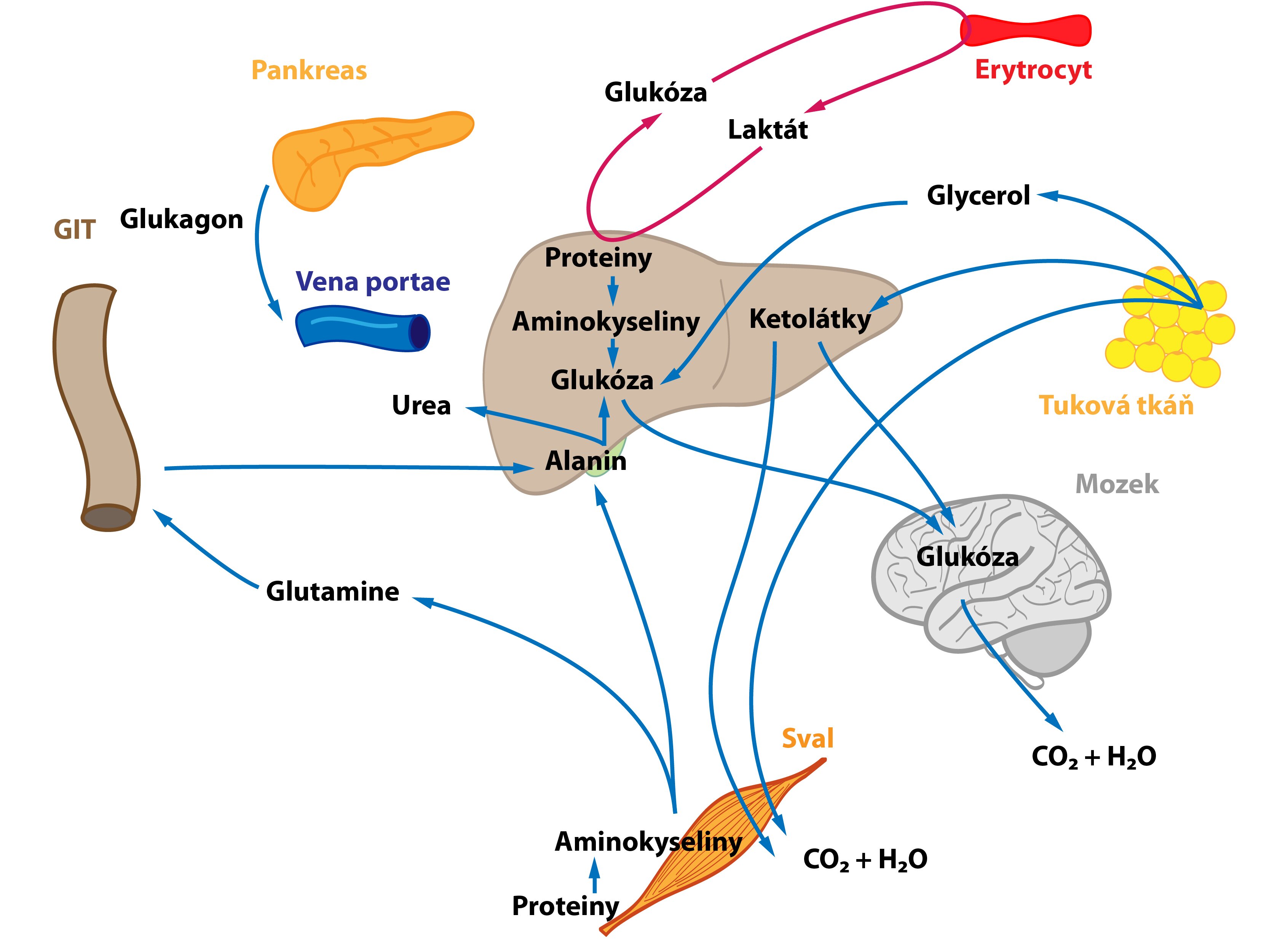
Stav po jídle neboli postprandiální stav charakterizuje zvýšený poměr hormonů inzulin/glukagon (podmíněný zvýšenou hladinou inzulinu – hyperinzulinémií) a dostatečným přísunem živin z GIT, které kryjí energetické požadavky buněk (ke zvýšení koncentrací glukózy a aminokyselin dochází přibližně 30 minut po jídle). Obecně nastává vysoká aktivita GIT, jater a pankreatu. Tělo vstupuje do anabolického metabolismu.
Metabolismus sacharidů (glukózy)
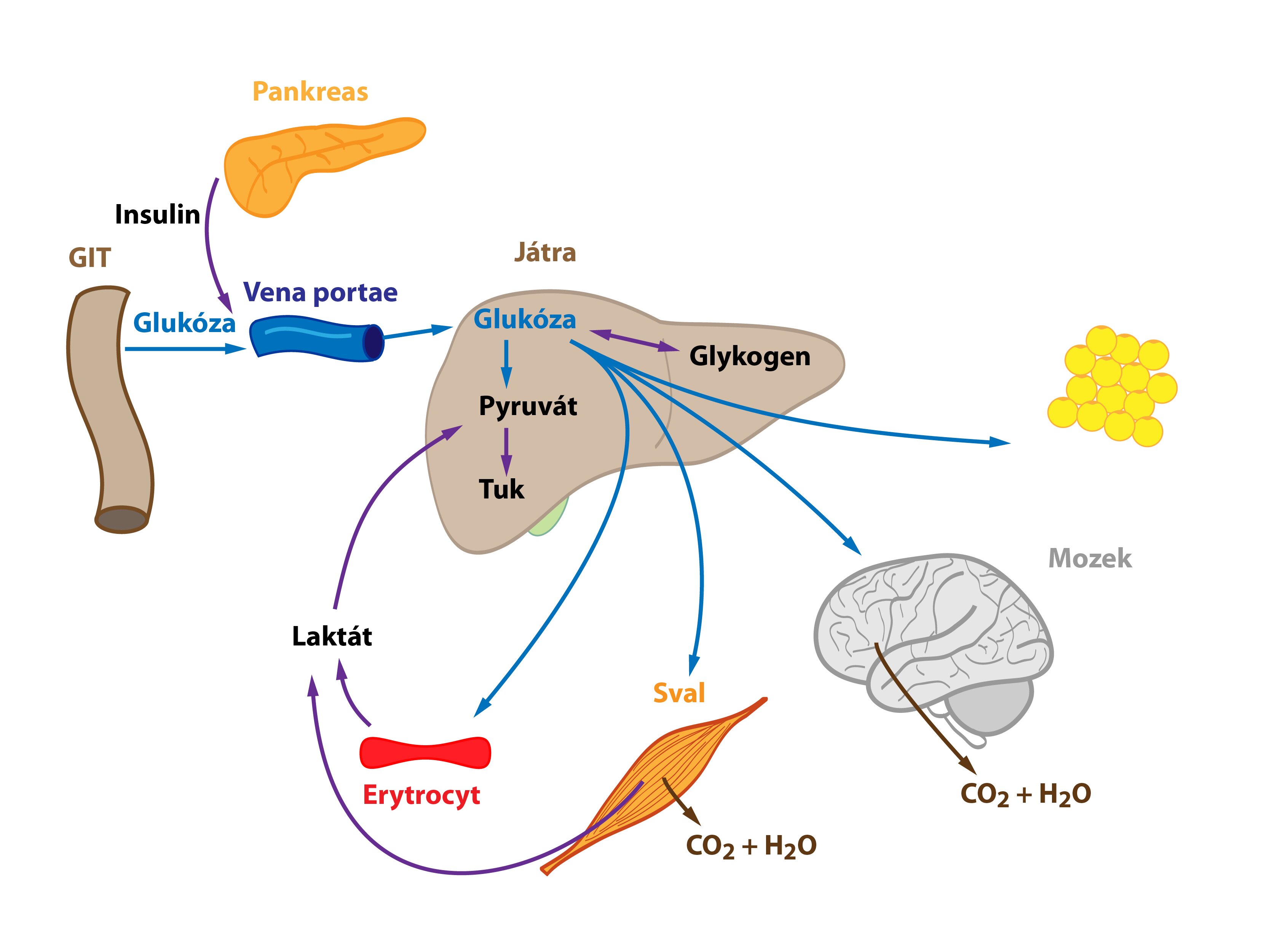
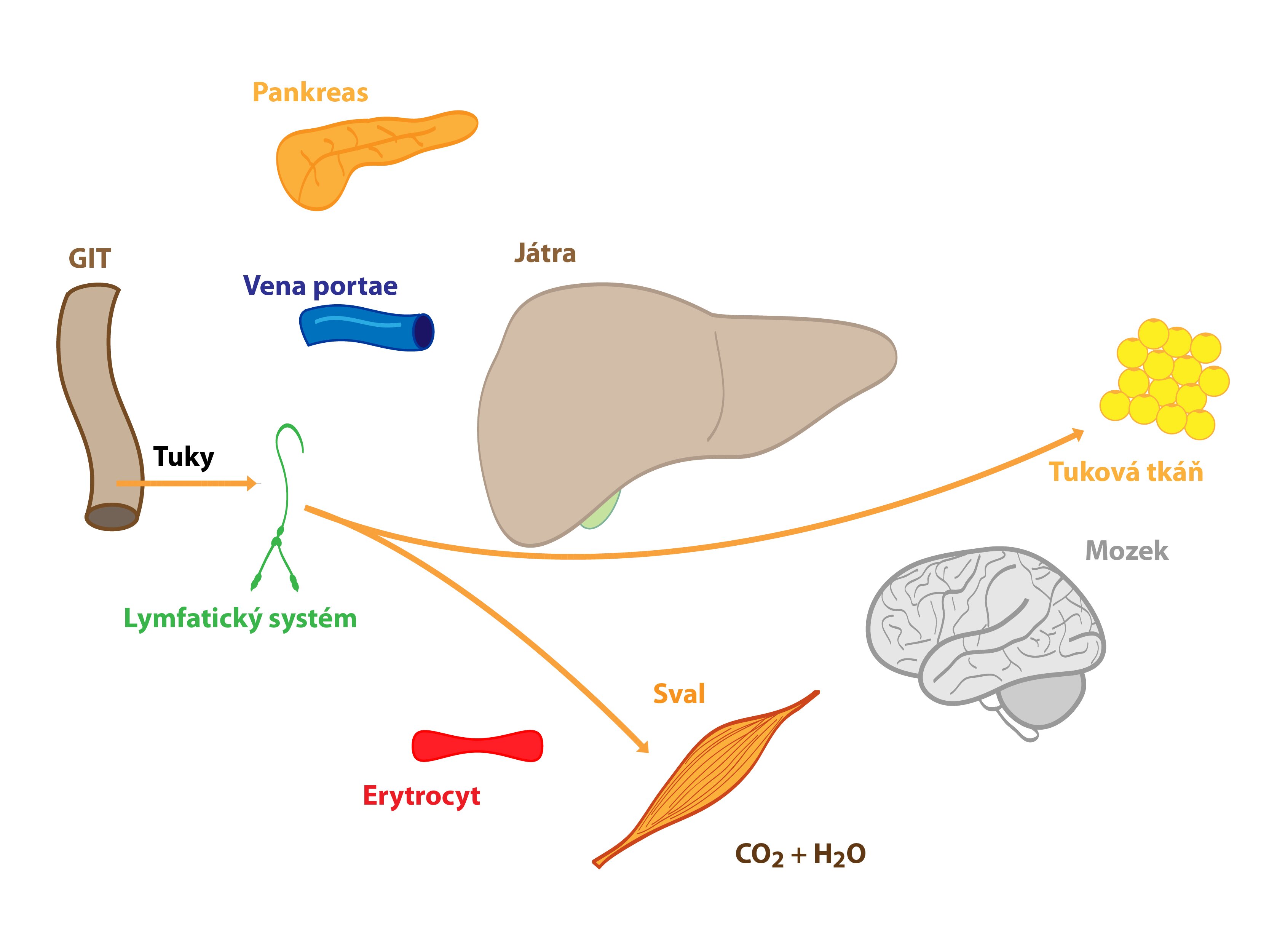
Glukóza se po uvolnění z enterocytů transportuje portální žilou do jater. Játra tedy představují první orgán lidského těla (s výjimkou střeva) setkávající se s glukózou z potravy a metabolizující ji. Vysoká hladina glukózy v portální krvi po jídle vede ke spuštění syntézy glykogenu v játrech – hepatocyty vychytávají glukózu a tvoří z ní glykogen. Při vysokém nadbytku glukózy (a nasycení zásob glykogenu) dochází k přeměně glukózy na mastné kyseliny a následně na TAG. Glukoneogeneze probíhá minimálně. Vzniklé TAG se uvolňují do krve ve formě VLDL. Ty jsou ve tkáních metabolizovány lipoproteinovou lipázou, kterou aktivuje inzulin. Uvolněné mastné kyseliny pak vstupují do buněk (adipocyty, svalové buňky atd). Coriho a alaninový cyklus jsou utlumeny (laktát je odsáván na syntézu TAG).
Mnoho molekul glukózy játry pouze prochází a dostává se přímo do tkání. Tuto glukózu dokážou využít téměř všechny buňky lidského těla. Za zmínku stojí jednak tkáně striktně závislé na glukóze (např. erytrocyty, buňky CNS), jednak tzv. inzulin senzitivní tkáně (např. kosterní svalovina, tuková tkáň, inzulin podporuje zabudování GLUT-4 přenašečů do membrán těchto buněk). Glukóza v nich může být spálena na energii, uložena do zásob (glykogen) či přeměněna na jinou látku (TAG).
Metabolismus aminokyselin a proteinů
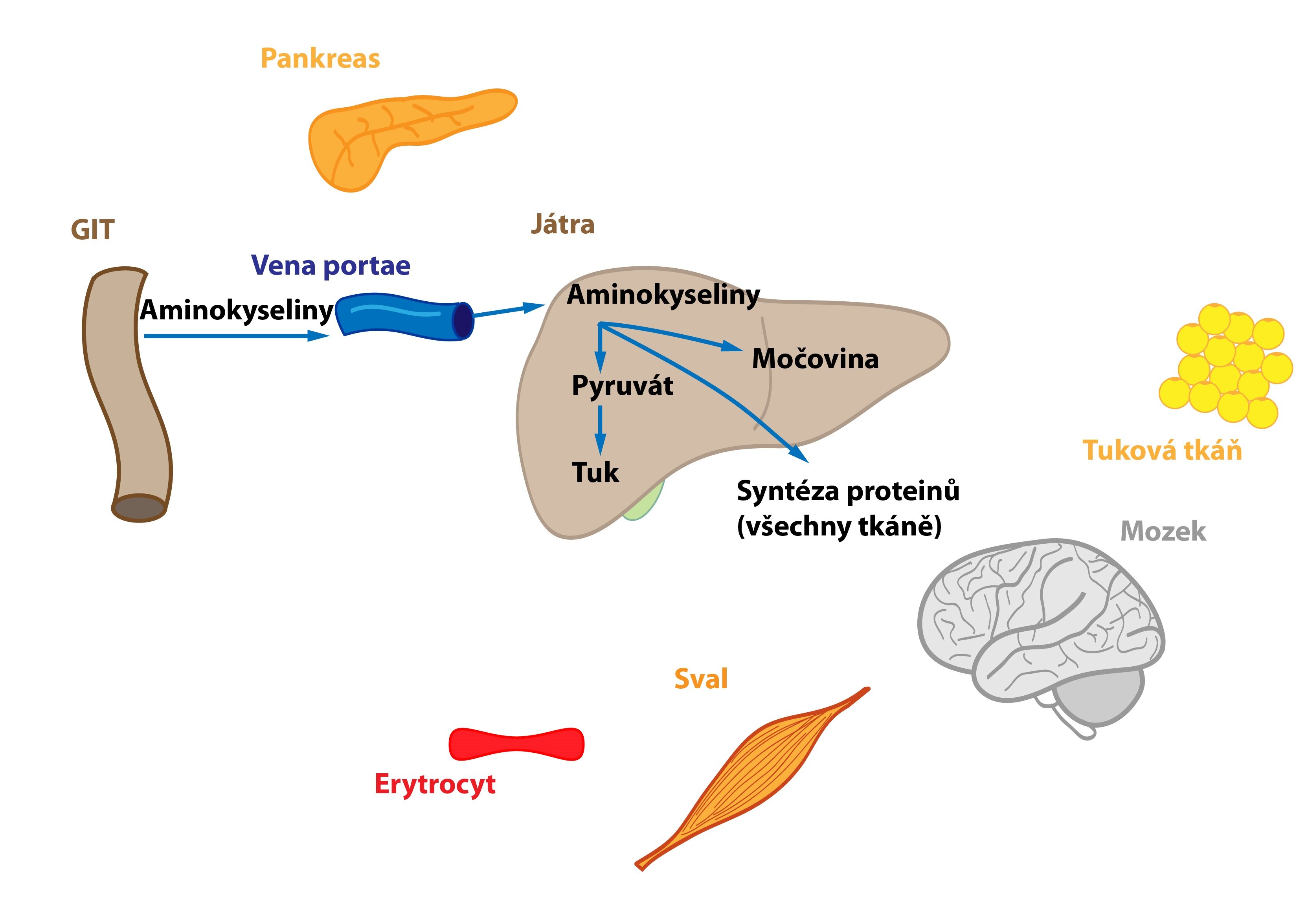
Aminokyseliny jsou částečně metabolizovány v enterocytech před jejich uvolněním do portální krve (např. Asp, Asn, Glu, Gln jsou metabolizovány v enterocytech na Ala, laktát, citrulin a Pro). V játrech se část aminokyselin utilizuje – zisk energie, přeměna na TAG (VLDL) či syntéza proteinů. Proto též roste rychlost tvorby močoviny. Podobný osud postihuje i ty aminokyseliny, jež játry pouze prochází a dostávají se do těla.
Metabolismus lipidů
Většinu absorbovaných lipidů ukládají enterocyty do chylomikronů, které se skrze lymfatické cévy a ductus thoracicus dostávají do krve. Mastné kyseliny kratší než 12 C jdou přímo do portální krve. Obě skupiny slouží v postprandiálním stavu jako zdroj energie (např. pro svaly) či jsou ukládány do zásob (v tukové tkáni). Játra současně syntetizují z nadbytku sacharidů a aminokyselin VLDL, jejichž osud jsme popsali výše. Maximální koncentrace chylomikronů a VLDL je dosaženo mezi 3. a 5. hodinou po jídle. Zvýšený poměr inzulin/glukagon posiluje aktivitu lipoproteinové lipázy metabolizující lipoproteinové částice a tvorbu TAG. Aktivita hormon senzitivní lipázy je naopak oslabena.
Počátek hladovění
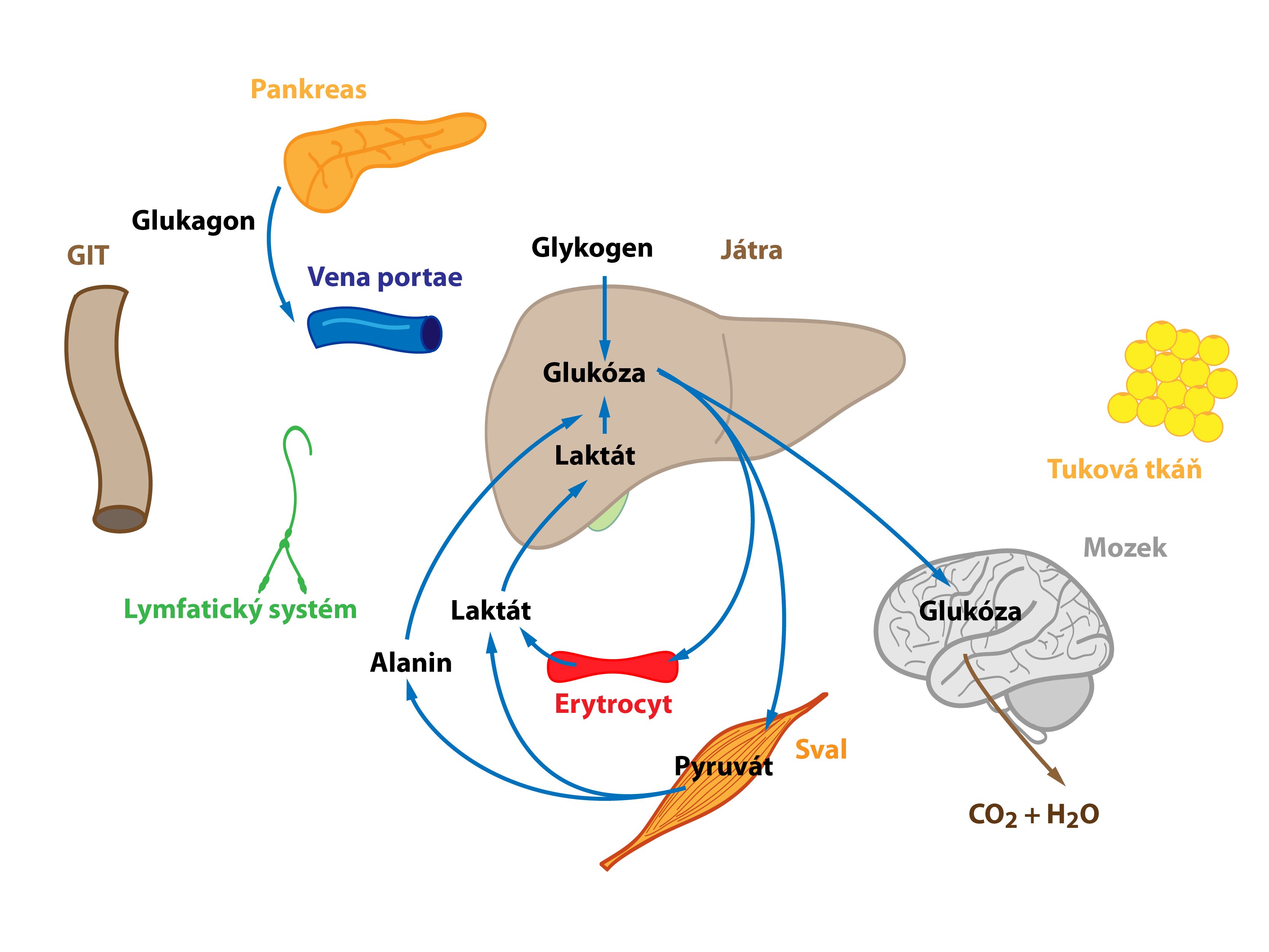
Tento stav nastává například ráno před snídaní po nočním přerušení příjmu potravy. Na začátku hladovění se mění poměr hormonů inzulin/glukagon, poměr se postupně snižuje (↓ inzulinémie, ↑ glukagonémie). Významný zdroj glukózy představujeje degradace jaterního glykogenu (jaterní glykogenolýza) s následným uvolněním glukózy do krve. Aminokyseliny, laktát a pyruvát jsou pozvolna využívány pro glukoneogenezi – nastartování Coriho a alaninového cyklu. Jaterní lipogeneze se snižuje.
Z adipózní tkáně se postupně lipolýzou uvolňují mastné kyseliny a glycerol – zapojují se do krytí potřeb těla. I svaly zaznamenávají mírnou aktivaci proteolýzy.
Hladovění
Můžeme rozlišit několik druhů hladovění. V této podkapitole budeme popisovat metabolické změny probíhající během tzv. prostého hladovění – dochází k němu při zastavení příjmu potravy. U prostého hladovění rozeznáváme tři základní fáze – časná, adaptační (protein šetřící) a terminální.
Prosté hladovění je adaptační proces vyvinutý během naší evoluce – hladovění znamenalo zcela běžnou součást života dřívějších generací (na rozdíl ode dneška – zkuste si vzpomenout, kdy jste naposledy nepřijímali potravu déle než jeden den). Jeho princip se zakládá na poklesu energetického výdeje, šetření proteinů a sacharidů (glukózy) a krytí většiny požadavků prostřednictvím oxidace lipidů (ketolátek). Hladiny inzulinu klesají. Jedná se o dobře léčitelný stav, většinou je dostačující prosté dodání kvalitní potravy (je-li ovšem k dispozici).
Dříve, než se podrobněji podíváme na průběh jednotlivých fází, shrneme si, s čím člověk do hladovění vstupuje.
Lidské tělo si energii ukládá převážně do dvou zásobních látek – triacylglycerolů a glykogenu. TAG se pro skladování jeví jako výhodnější – 1 g bezvodého TAG má 6x více energie než 1 g hydratovaného glykogenu. Kompletní oxidací 1 g TAG se získá přibližně 38 kJ (9 kcal), z 1 g sacharidů či proteinů jen 17 kJ (4,1 kcal).
U žádného proteinu nemůžeme říci, že by byl zásobní, protože degradaci každého proteinu tělo pocítí. Za „zásobní proteiny” můžeme považovat například svalové proteiny či některé proteiny krevní plazmy (např. albumin) – ty se během hladovění odbourávají nejdříve.
Celkově tedy 70 kg vážící muž střední postavy vstupuje do hladovění s:
1) 400 000 kJ v TAG (souhrnně asi 10,5 kg, tvoří 15 % hmotnosti těla)
2) 100 000 kJ v proteinech (svaly)
3) 2 500 kJ v jaterním glykogenu. Svalový glykogen přidává více než dvojnásobek – dohromady s jaterním to činí asi 8000 kJ uložených v glykogenu
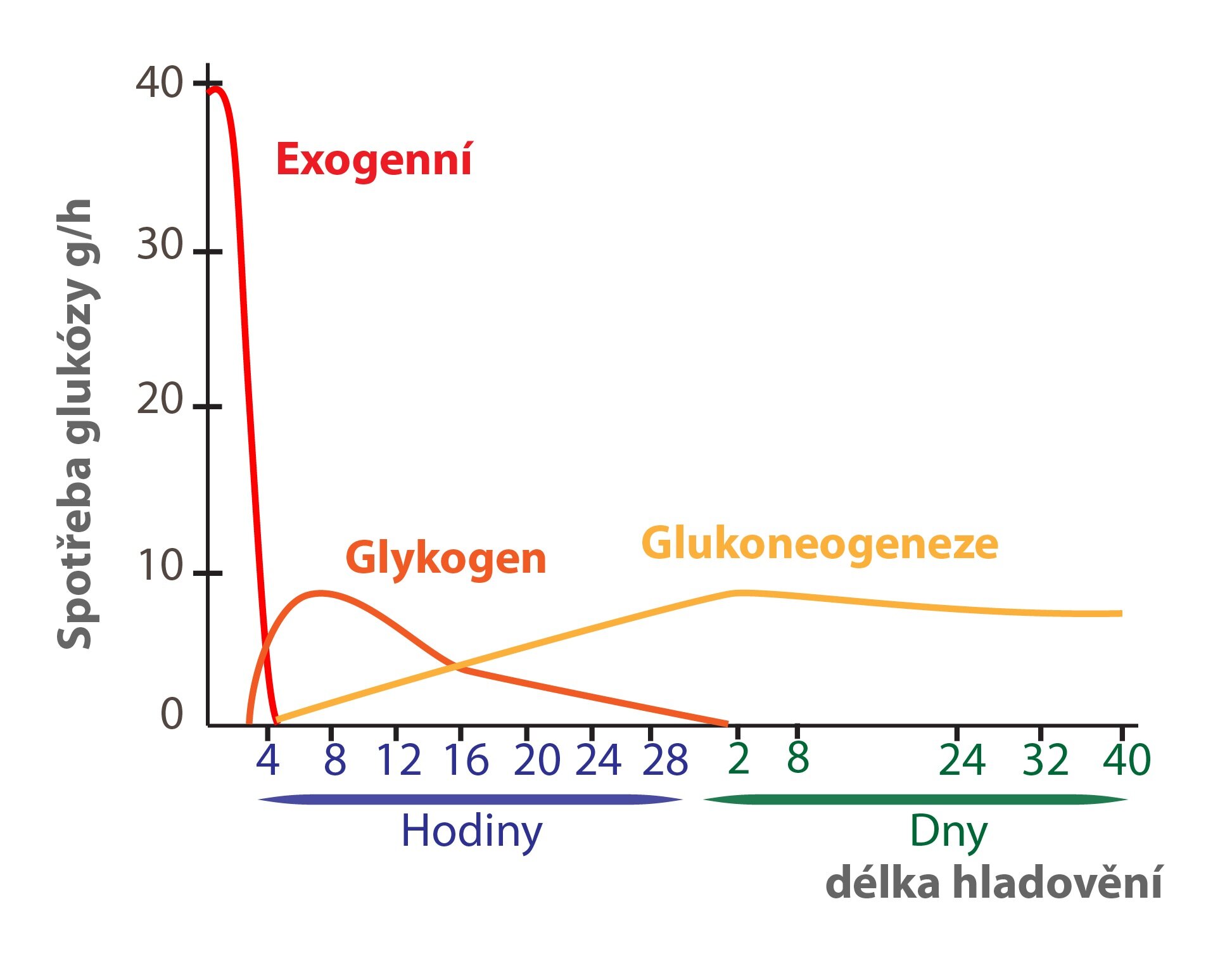
4) 170 kJ v glukóze
Pokud počítáme, že naše tělo spotřebuje přibližně 2 000 kcal denně, vystačily by zásoby jaterního glykogenu a glukózy maximálně na jeden den. TAG ale dovedou tyto nároky krýt po dobu týdnů.
Stav hladovění charakterizuje snížení poměru hormonů inzulin/glukagon (↓ inzulinémie, ↑ glukagonémie). Současně se snižuje tvorba hormonů štítné žlázy (redukuje se požadavek denní bazální energie až o 25 %). Ze střeva nepřicházejí žádné živiny, jež by kryly energetické požadavky buněk. Tělo tedy vstupuje do katabolického metabolismu.
Časná fáze prostého hladovění (trvá 2-3 dny)
Metabolismus sacharidů (glukózy)
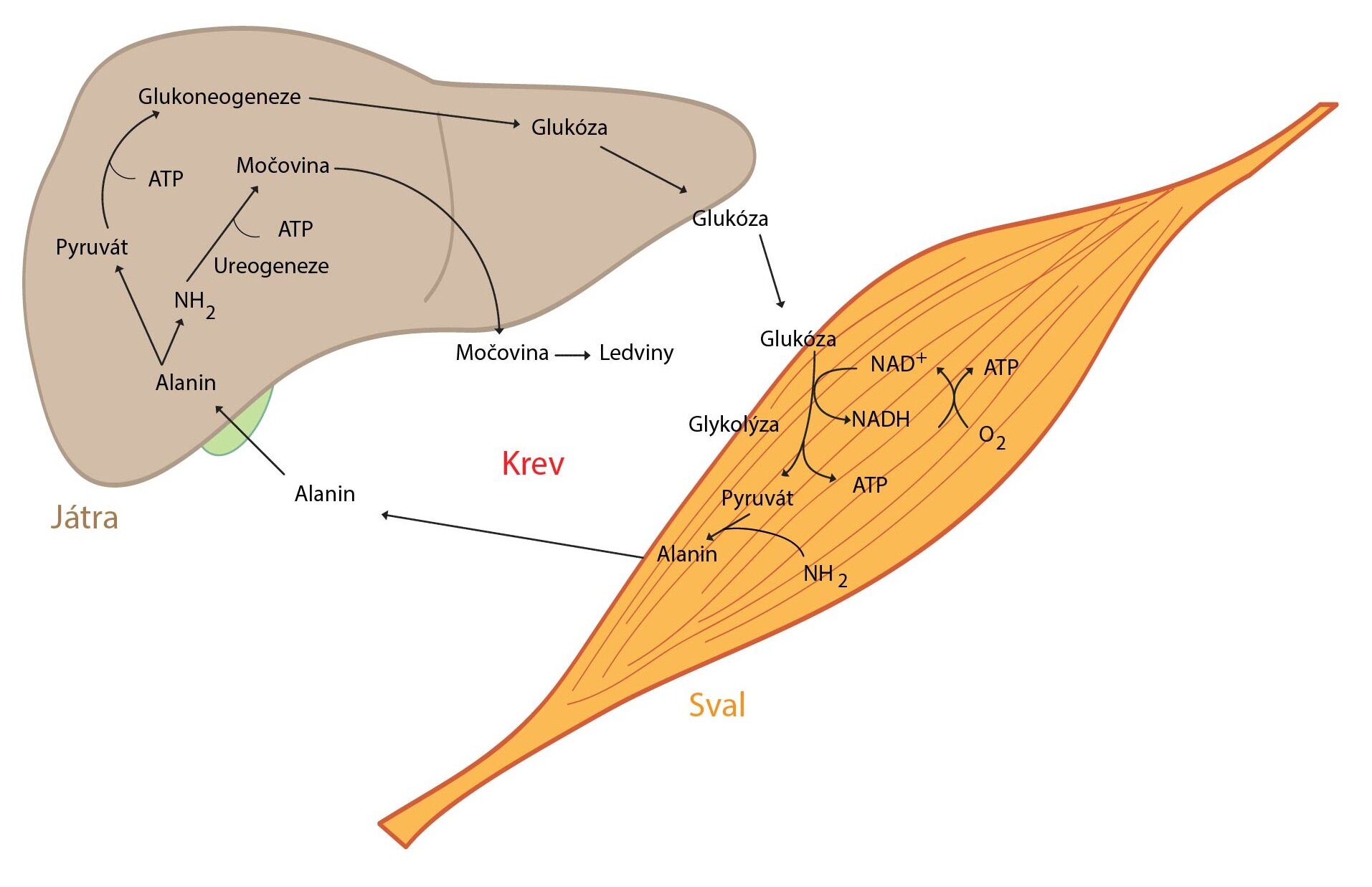
Když organismus lační po mnoho hodin a zásoby jaterního glykogenu se ztenčují, zahájí hepatocyty proces tvorby glukózy z necukerných substrátů (laktátu, glukogenních aminokyselin, glycerolu) – glukoneogenezi. Ta zajišťuje dodávku glukózy do tkání na ní striktně závislých. Narůstá význam Coriho a alaninového cyklu, ač samy nejsou zdrojem nových C atomů.
Metabolismus aminokyselin a proteinů
Proteiny, zvláště pak ty z kosterního svalstva, dodávají většinu uhlíkových atomů potřebných pro glukoneogenezi. Roste tedy proteolýza ve svalech. Většina aminokyselin je ihned ve svalu metabolizována na pyruvát a α-ketoglutarát, jen dvě aminokyseliny (Ala a Gln) jsou uvolněny ve větším množství do krve. Větvené aminokyseliny fungují jako hlavní zdroj dusíku pro produkci Ala a Gln ve svalu. Uvolněný glutamin, významný energetický substrát, využívají jednak enterocyty, jež ho přemění na alanin, jednak lymfocyty, které jej metabolizují na aspartát. Uvedený proces se nazývá glutaminolýza. Aminodusík detoxikuje syntéza močoviny probíhající v játrech.
Metabolismus lipidů
Lipidy se stávají hlavním zdrojem energie během hladovění. Kvůli změně poměru inzulin/glukagon se v adipocytech aktivuje lipolýza prostřednictvím hormon senzitivní lipázy. Tím se zvyšuje hladina mastných kyselin a glycerolu v krvi. Mnoho tkání přímo využívá mastné kyseliny (např. sval, srdce). V játrech poskytuje oxidace mastných kyselin většinu energie potřebné pro glukoneogenezi a další energeticky náročné procesy. Z části acetyl-CoA se v hepatocytech syntetizují ketolátky (ketogeneze), ty se stávají alternativním palivem pro extrahepatální tkáně obsahující mitochondrie. I mozek začíná využívat ketolátky jako dodatečný zdroj energie (čím delší hladovění, tím více ketolátek mozek využívá – šetření glukózy). Ketolátky také potlačují proteolýzu a oxidaci větvených AK ve svalové tkáni a snižují uvolňování alaninu do cirkulace. Glycerol je využíván jako substrát pro glukoneogenezi.
Adaptační fáze prostého hladovění (nejdelší fáze – trvá týdny)
Obecně se dá říci, že pokračují změny nastartované v první fázi. Hlavními energetickými substráty jsou mastné kyseliny a ketolátky. Zastoupení ketolátek v krytí potřeb organismu postupně narůstá (např. vyšší využití v CNS). Pyruvát, laktát, aminokyseliny a glycerol se využívají pro udržení glukoneogeneze.
Terminální fáze prostého hladovění (po 7-8 týdnech úplného hladovění)
Dochází k vyčerpání zásob TAG, nastává masivní proteokatabolismus – progresivní ztráta svalové hmoty, výrazné potlačení imunitních funkcí.
Těsně po najedení
Po najedení se opět začíná zvyšovat poměr inzulin/glukagon (↑ inzulinémie). Metabolismus se pomalu navrací do anabolického stavu.
Lipidy jsou metabolizovány obvyklým způsobem jako ve stavu najedení. Metabolismus sacharidů oproti tomu ještě nějaký čas přetrvává v „částečně hladovějícím modu” – přetrvává aktivace jaterní glukoneogeneze. Ta poskytuje molekuly glukózy převážně pro tvorbu jaterního glykogenu, aby se doplnily jeho zásoby. V periferních tkáních je ale glukóza normálně katabolizována. Za určitý čas rychlost jaterní glukoneogeneze klesá a začíná převažovat glykolýza – tzv. glukózový paradox. Ve svalech dochází k doplnění zásob glykogenu a v tukové tkáni se syntetizují TAG. Aminokyseliny slouží jednak jako zdroj uhlíkových atomů pro glukoneogenezi, jednak se z nich syntetizují proteiny (játra i ostatní tkáně).
Metabolismus glutaminu
Glutamin zastupuje amoniak v mnoha metabolických pochodech – například v detoxikaci aminoskupiny (transport -NH2, močovinový cyklus) či v syntéze nukleotidů. Také se z něj syntetizuje citrulin – jde o další propojení s močovinovým cyklem. Glutamin představuje významný energetický substrát pro rychle se dělící buňky – např. enterocyty či buňky imunitního systému (přeměna na glutamát a α-ketoglutarát, jenž vstupuje do Krebsova cyklu, slouží také jako donor N v syntéze nukleotidů).
Jak zvýšený příjem proteinů potravou, tak i degradace vlastních proteinů vyústí ve zvýšení koncentrace glutaminu v krvi.
_
Fyzická aktivita
Rozlišujeme jednak aerobní cvičení (běhy na dlouhou trať, dlouhý trénink), jednak anaerobní cvičení (sprinty, vzpírání).
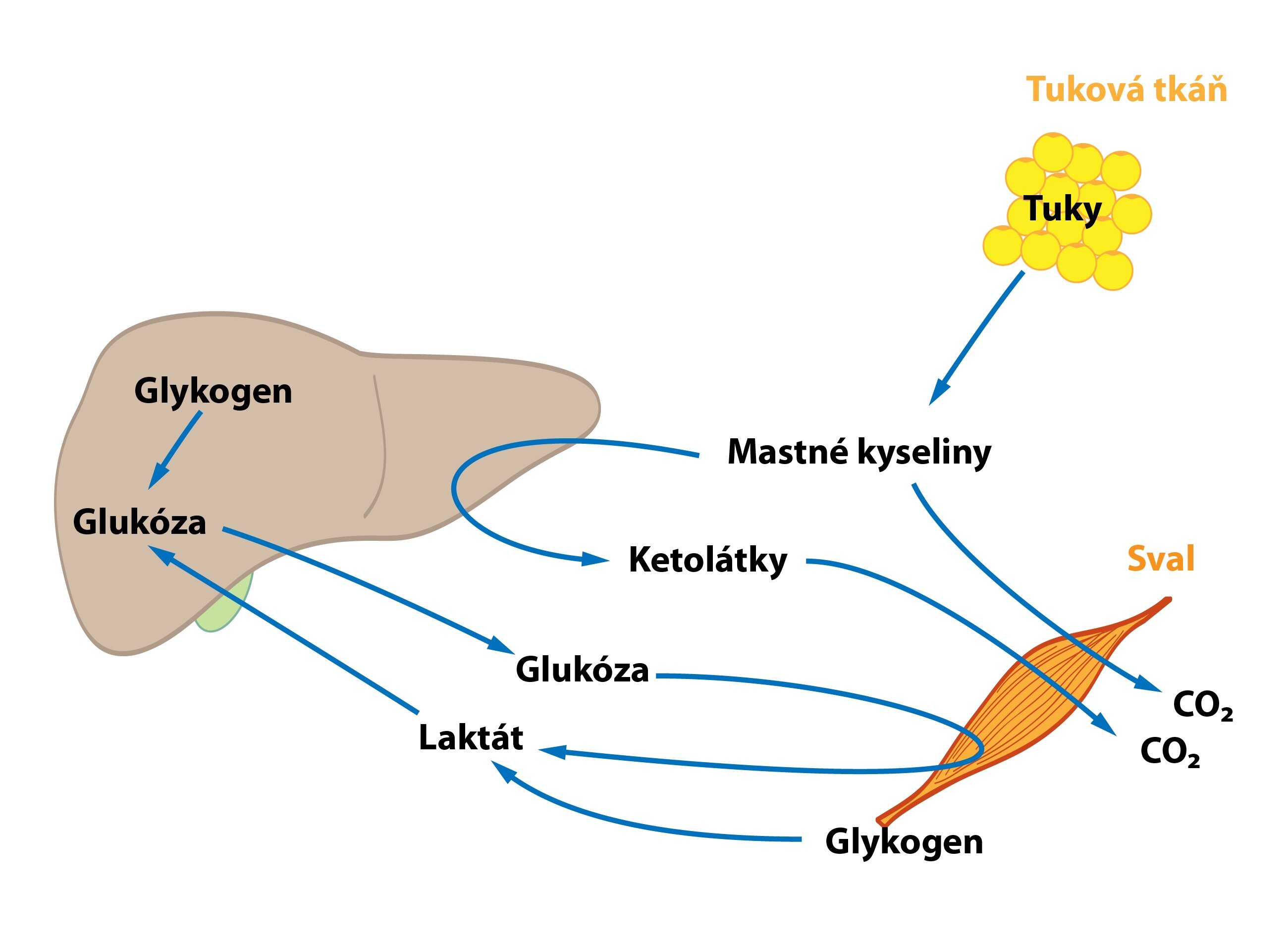
Při anaerobním cvičení funguje interorgánová spolupráce minimálně. Svalové krevní cévy jsou totiž během kontrakce staženy, svalstvo se tím částečně izoluje od zbytku organismu. Svalové buňky tedy mohou spoléhat jen na své interní zásoby – glykogen a fosfokreatinin.
I při aerobním cvičení získávají svalové buňky mnoho energie procesem glykolýzy glukózy získané degradací svalového glykogenu. Množství svalového glykogenu se může zvýšit určitými postupy – např. důkladným, vyčerpávajícím tréninkem, po němž následuje odpočinek proložený stravou s vysokým obsahem sacharidů. Běžný smrtelník ale neskladuje dostatek glykogenu na pokrytí všech energetických nároků. Proto se využívají i mastné kyseliny – vzrůstá lipolýza a svaly oxidují více mastných kyselin než glukózy. Na rozdíl od hladovění se ale hladiny ketolátek v krvi výrazně nezvyšují (jsou rychle metabolizovány svaly). Dále dochází ke stimulaci metabolismu větvených aminokyselin.
Autoři podkapitoly: Petra Lavríková a Josef Fontana