Náplň podkapitoly:
1. Úvod do chemických smyslů – čichu a chuti
2. Čich
3. Chuť
_
Úvod do chemických smyslů – čichu a chuti
Jak čichový, tak chuťový analyzátor se během evoluce vyvíjely z analyzátoru, který uměl vnímat chemické složení okolí organismu. Naše chemické smysly (čich a chuť) tak činí i u nás.
_
Čich
Čich je u lidí v porovnání s ostatními obratlovci méně rozvinutý. Smyslové buňky jsou lokalizovány na stropu nosní dutiny ve žlutavě zbarvené oblasti – regio olfactoria. Rozsah její plochy dosahuje asi 4 cm2. Čichový epitel obsahuje u člověka asi 15 000 000 bipolárních neuronů (čichových receptorů). Jejich dendrity mají na svém konci asi 5-20 řasinek (cilií) zanořených do vrstvičky hydrofilního hlenu. Čichový receptor je sám o sobě pozoruhodné místo. Nervový systém se zde totiž dostává do nejtěsnějšího kontaktu se zevním prostředím. Axony čichových receptorů směřují ve svazcích (jako tzv. fila olfactoria) skrze lamina cribrosa intrakraniálně. Blíže viz čichová dráha (viz dále v textu).
Když se pachová látka (odorant) dostane do blízkosti regio olfactoria, závisí na její chemické povaze, jaký ji čeká osud. Hydrofilní látky se mohou volně rozpustit ve vrstvě hlenu, zatímco látky lipofilní se musí nejprve navázat na OBP (odorant binding proteins). OBP jsou lokalizovány v hlenové vrstvě, koncentrují molekuly odorantu a přenášejí ho k receptorům na ciliích. Druhů OBP je více, s různou schopností vázat různé odoranty. Podobné vázací proteiny se uplatňují i při vnímání chuti. Odoranty jsou zpravidla malé molekuly (obsahují do 20 atomů uhlíku).
Čichový receptor
Řasinky čichových neuronů jsou vybaveny receptorovými molekulami. Všechny receptorové molekuly jsou asociovány s Gs-proteinem (tzv. G-olf protein). V buňce dochází následně k aktivaci adenylátcyklázy – tvorbě cAMP – otevření neselektivních kanálů pro kationty – vstupu Na+ a Ca2+ do buněk – depolarizaci membrány a vzniku akčního potenciálu.
Receptory kóduje u myši asi 1000 genů (u člověka 500-750 genů). Jedna smyslová buňka má ve své membráně vždy jen receptor kódovaný jedním genem. Je pozoruhodné, že kolem 1 % lidského genomu připadá na tvorbu pachových receptorů. Tvoří tak největší genovou rodinu popsanou u savců (je jich více, než kdybyste sečetli dohromady skupiny genů pro imunoglobuliny a pro receptory T-lymfocytů). Jeden receptor není zcela specifický jen pro jednu chemickou látku, obvykle je aktivován skupinou látek o podobné chemické struktuře.
Historická korelace:
Za objev čichového receptoru, jeho postreceptorových pochodů a organizace čichového systému byla roku 2004 udělena Nobelova cena za fyziologii a medicínu – laureáti Linda B. Buck a Richard Axel.
Práh a adaptace čichu
Práh je pro různé látky velmi rozdílný. Např. pro methylmerkaptan (aroma česneku) stačí nižší koncentrace kolem 350 pg/l. Umíme rozlišit až 10 000 různých pachů, ale nejsme na výši v určování kvantity (koncentrace) látky pomocí čichu. V evoluci bylo asi výhodnější zjistit, že se pach vyskytuje, a ne jeho přesné množství. Rozlišovací práh čichu je asi 25% změna koncentrace látky.
Adaptace je stav, kdy i přes stále stejnou intenzitu podnětu ho naše smysly už nevnímají stejně silně. Adaptace čichu je velmi rychlá (sekundy, maximálně pár minut) a specifická (práh pro ostatní pachy zůstává nezměněn).
Ženy vykazují vyšší senzitivitu na čichové vjemy, a to především během ovulace. Staří lidé naopak často trpí hyposmií (snížení citlivosti čichu). Úplná ztráta čichu se označuje pojmem anosmie.
Převod čichových signálů do vyšších center
Čichové buňky se poprvé přepojí již v těsné blízkosti nad lamina cribrosa, kde se nachází bulbus olfatorius. Axony senzorických buněk končí na speciálním aparátu zvaném glomerulus. Na jednom glomerulu končí asi 25 000 čichových buněk předávajících informace na dendrity mitrálních buněk, které jsou také součástí glomerulu (jejich dendrity, nikoli celé buňky). Mitrální buňky ji pak dále distribuují v rámci CNS.
Dnes známe dva neuronální pooly, ve kterých je zpracovávána čichová informace:
1) Mediální čichový systém
2) Laterální čichový systém
Mediální čichový systém
Je jednou z nejstarších oblastí pro čichové vjemy. Topologicky se jedná o část mozku umístěnou v těsné blízkosti předního talamu (rostrálně vůči talamu). Vše, co je řazeno k tomuto systému, obvykle náleží k primitivním součástem limbického systému, zvlášť významné jsou pak ncc. septales. Význam tohoto systému spočívá v zajišťování primitivních reflexních reakcí na čichové vjemy (např. olizování se, slinění apod).
Laterální čichový systém
Tento systém se skládá jednak z prepyriformního a pyriformního kortexu, jednak z kortikální části ncc. amygdaloides. Opět má mocná propojení s limbickým systémem, zejména pak s hipokampální formací. Dle některých autorů odpovídá za nechuť k jídlu, se kterým jsme dříve měli špatnou zkušenost.
Vomeronazální (Jacobsonův) orgán – VMO
U většiny obratlovců se podél baze nosního septa nachází area čichové sliznice tvořící tento orgán. Jeho úkolem je vnímání sociálně významných pachů, například feromonů. Axony vomeronazálního orgánu se přepojují v přídatném čichovém bulbu a signály dále míří do limbického systému (amygdala a hypothalamus).
Receptory vomeronazálního orgánu jsou mnohem citlivější než receptory v regio olfactoria (dovedou zachytit jednotlivé molekuly) a skrze limbický systém mají přímý a silný vliv na chování jedince. U lidí je prý tento orgán málo vyvinutý.
_
Chuť
Buňky registrující chuť jsou umístěny v chuťových pohárcích. Ty se nacházejí hlavně na papilách jazyka, dále na měkkém a tvrdém patře a v hltanu. Lidé dovedou rozpoznat 5 hlavních chutí: hořkou, sladkou, umami (chuť glutamátu), kyselou a slanou.
V evoluci byla hořká chuť spojována s toxickými látkami, sladká a umami s látkami výživnými a prospěšnými, zatímco kyselé a slané doplňovalo předchozí.
Počet chuťových pohárků se pohybuje mezi 5 000-10 000 a v každém z nich je 50-100 smyslových buněk. Ty jsou na svém apikálním pólu vybaveny mikrovili. Dřívější rozdělení (chemotopická mapa čití chutí) tvrdící, že určité oblasti jazyka umějí snímat jen určitou chuť (sladkou na špičce, hořkou na kořenu atd.), dnes již přitom neplatí. Podle současných názorů rozdíly v distribuci čití chuti sice existují, ale jsou nevýznamné. Chuťový pohárek tedy obsahuje všech 5 typů buněk pro čití chuťových modalit.
Citlivost receptorů (práh) se liší látka od látky. Nejnižší je obecně pro hořké – hydrochlorid strychninu: 1,6 μmol/l, síran chininu: 8 μmol/l. Vysoký práh mají oproti tomu přirozeně sladké látky – glukóza: 80 mmol/l, sacharóza 10 mmol/l, syntetické sladké látky ho naopak mají zase nízký – sacharin: 23 μmol/l. Stejně jako v případě čichu máme i pro chuť malou schopnost rozeznávat rozdíly v intenzitě chuti (koncentraci látky). Opět je nutná asi 25% změna koncentrace látky.
Senzorické buňky nejsou bipolární neurony jako je tomu u čichu. Nervová zakončení jsou zanořená do membrány senzorických buněk. Smyslové buňky a nervová zakončení spolu komunikují přes purinergní receptory (ligandem je ATP). Přenos do CNS je podmíněn VII, IX a X hlavovým nervem – viz chuťová dráha. Odumřelé chuťové smyslové buňky jsou nahrazovány dělením bazálních buněk pohárku.
Hořká chuť
Evolučně bylo rozpoznání hořkého velmi důležité, a to především za účelem rozpoznání toxických substancí (např. rostlinných alkaloidů). Obecně receptory pro hořkou chuť registrují řadu organických látek: sloučeniny s dlouhými řetězci obsahující dusík, alkaloidy (morfin, chinin, kofein, strychnin, nikotin) a dále močovinu. Mezi hořké anorganické látky patří soli hořčíku, vápníku a amoniaku.
Pro rozpoznání hořké chuti jsme vybaveni 25-30 geny, které kódují receptorovou rodinu T2R. Stejně jako v oku se jedná o receptory spřažené s G-proteinem, ovšem zatímco v oku se G-protein nazývá transducin, zde hovoříme o gustducinu (Ggust). Gustducin aktivuje fosfodiesterázu, která degraduje intracelulární cAMP. Pokles cAMP otevře kanály pro sodík – depolarizace membrány. Současně ale gustducin aktivuje také PLC-β, jejímiž druhými posly jsou IP3/DAG.
Podobné receptory jsou uloženy i jinde v GIT, konkrétně v žaludku a tenkém střevu. Jsou také asociovány s gustducinem (synaptické neurotransmitery: peptid YY – PYY a cholecystokinin – CCK). Je obecně známo, že některé léky a toxiny po požití vyvolávají zvracení nezávisle na jejich koncentraci v krvi. Musí tedy existovat obranný mechanismus, který je zaregistruje ještě v lumen GIT a vede k aktivaci nauzey a zvracení. Zatímco chuťové buňky v dutině ústní by měly přinutit osobu k vyplivnutí škodlivé látky, receptory v žaludku vyvolávají zvracení.
Sladká chuť
Stejně jako v případě hořké chuti jsou i receptory pro sladkou chuť spojeny s G-proteinem (opět gustducin). G-protein následně aktivuje adenylátcyklázu, jež zvýší koncentraci intracelulárního cAMP, které vede buď přímo či nepřímo k uzavření kanálů pro draslík. Po uzavření těchto kanálů dochází k depolarizaci. Sladká chuť může být buď přirozená (sacharidy), či syntetická (sacharin, aspartam). Obojí se registrují obdobnou cestou. Rozeznáváme tři receptory pro sladkou chuť – T1R1, T1R2 a T1R3, přičemž jedna buňka obvykle exprimuje najednou dva typy receptorů, které tvoří heterodimery. Teprve ty dovedou reagovat na sladké látky.
Chuť glutamátu – umami
Mechanismus přenosu signálu pomocí receptoru pro L-glutamát je podobný jako u receptorů pro sladkou a hořkou chuť – opět receptor asociovaný s G-proteinem. Jedná se o tzv. metabotropní glutamátový receptor typu 4 – mGluR4. Jeho G-protein vede k aktivaci fosfodiesterázy – následuje proces popsaný výše.
Kyselá a slaná chuť
Kyselou i slanou chuť vnímáme podobným mechanismem. V membráně obou typů smyslových buněk jsou stále otevřeny iontové kanály. V buňkách pro slanou chuť je to ENaC pro Na+ a v buňkách pro kyselou chuť je to ASIC (acid-sensing ion channel) pro H+. Protože jsou tyto kanály stále otevřené, zvýšení koncentrace příslušných iontů vede samo o sobě k depolarizaci buněčné membrány. Oba dva tyto kanály patří do velké rodiny kanálů pro kationty DEG/ENaC (degenerin/epithelial Na+ channel). Členové této rodiny se nejen účastní vnímání chuti (ASIC, ENaC), ale slouží také jako mechanosenzory v mnoha tkáních. DEG/ENaC proteiny jsou exprimovány v senzorických gangliích (v těch, které obsahují bohatou populaci mechanoreceptivních neuronů) – ateriální baroreceptory – a dále v receptorech pro dotyk a vibrace.
Kyselá chuť
Pokles pH znamená nárůst koncentrace H+. Výše uvedený ASIC je jen jedním z proteinů, které umožňují vnímání kyselosti (celkem jsou tři). ASIC je stále otevřený kanál pro vodíkové protony, který jim umožňuje přímý průnik do smyslové buňky. Dále se v membráně vyskytují dva iontové kanály řízené H+. Prvním je kanál pro K+, který normálně umožňuje únik K+ z buňky. H+ blokují tyto kanály, a tak uvězní K+ v buňce. Druhým je iontový kanál pro Na+, který se po navázání H+ otevírá. Sodíkové kationty proudí do buňky a depolarizují ji. Influx kationtů vede k otevření napěťově řízených kanálů pro Ca2+. Kyselost určité kyseliny je úměrná koncentraci vodíkových iontů. Zajímavým paradoxem je, že organické kyseliny často při stejné koncentraci H+ chutnají kyseleji než anorganické (citrát vs. HCl). Proč se tak děje, není dosud zcela objasněno.
Stejný mechanismus čití kyselého je v receptorech pro pH krve a likvoru v mozkovém kmeni a hypothalamu (změna minutové ventilace jako odpověď na hodnotu pCO2 v arteriální krvi).
Slaná chuť
Slanou chuť vnímá nejjednodušší receptor – výše uvedený ENaC. Tento stále otevřený kanál umožňuje volný průchod Na+ do buňky, což samo o sobě depolarizuje buněčnou membránu a otevírá napěťově řízené kanály pro Ca2+. ENaC může být blokován amiloridem, který je využíván jako slabé diuretikum.
ENaC receptor se skládá ze tří podjednotek. Produkce minimálně jedné z nich je pod kontrolou aldosteronu. Proto je senzitivita k slané chuti zvýšena u zvířat / člověka, který má nedostatek sodíku (děje se tak přes indukci syntézy více ENaC kanálů). Systémový nedostatek sodíku vede k tzv. salt craving (neodolatelná touha po soli). Indukce tvorby podjednotky ENaC kanálu pomocí cirkulujícího aldosteronu názorně dokládá, jak tělo dokáže změnit své chuťové preference (chuťovou ostrost) při nedostatku určité látky. Velmi silný salt craving se vyskytuje například u Addisonovy nemoci či jiných poruch funkce nadledvin.
Jedna poznámka k amiloridu. U lidí je senzitivita k amiloridu mnohem nižší než u jiných obratlovců. To naznačuje, že se vnímání slané chuti musí účastnit ještě jiný, dosud nespecifikovaný mechanismus. Je ironií osudu, že ač jiné tělesné procesy týkající se sodíku jsou v těle dobře prozkoumané, o molekulárním podkladu vnímání slané chuti toho víme jen málo.
Shrnutí vzniku receptorového potenciálu při chuťovém vnímání
Hořká, sladká a chuť umami: všechny receptory jsou asociovány s G-proteiny, depolarizace vzniká otevřením sodíkových a vápenatých kanálů.
Kyselá a slaná chuť: depolarizace vzniká vstupem protonů, respektive kationtů do buňky přes stále otevřené kanály.
Převod chuťových signálů do vyšších center
Depolarizací membrány senzorických buněk kationty vzniká akční potenciál, který během aplikace dané chemické látky vykazuje zprvu vysokou frekvenci, jež s pokračující aplikací klesá. Z tohoto důvodu se například při degustacích vín podává i sýr, popřípadě jiná pochutina s diametrálně odlišnou chutí od degustovaného výrobku, předejde se tak totiž snížení frekvence akčních potenciálů na podobné stimuly (v našem případě vína). Frekvence a počet akčních potenciálů následně kódují intenzitu příslušné chuti. Suma aktivity všech receptorů pro všechny chutě pak udává výslednou chuť potraviny.
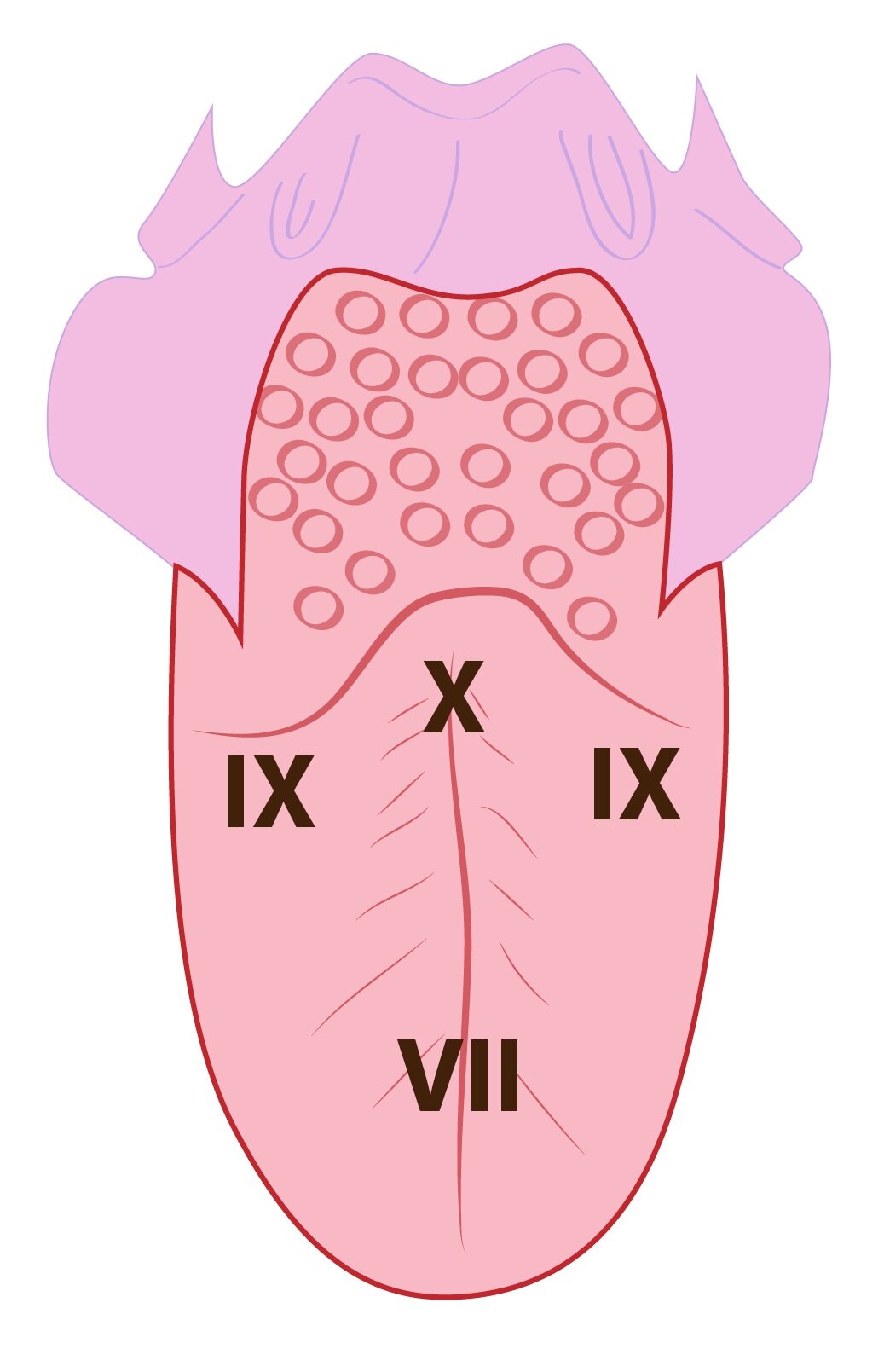
Chuťové signály jsou sbírány třemi cestami:
1) Z prvních dvou třetin jazyka sbírá signály n. lingvalis, který je pak cestou chorda tympani vede do n. facialis a konečně do mozkového kmene, respektive ncc. tractus solitarii.
2) Ze zbylé jedné třetiny sbírá chuťové signály n. glosopharyngeus, který také končí v ncc. tractus solitarii.
3) Z báze a faryngeální oblasti sbírá chemocepční informace n. vagus a přivádí je opět do ncc. tractus solitarii.
Z těchto jader je signál projikován prostřednictvím 2. neuronů chuťové dráhy do ventroposteromediálního jádra talamu (VPM). Zde je opět přepojen a pokračuje z VPM talamu 3. neuronem do části g. postcentralis, který je skryt hluboko ve fisura Sylvii. Zde pak probíhá integrace chuťových signálů a vznik jedné ucelené chuti.
Autoři podkapitoly: Patrik Maďa a Josef Fontana