Náplň podkapitoly:
1. Ischemická choroba srdeční (ICHS)
2. Poruchy chlopní
3. Srdeční selhání
4. Arytmie
5. Iontové dysbalance
6. Hypertenze
7. Edém
_
Ischemická choroba srdeční (ICHS)
Během zátěže spotřebuje srdeční sval více kyslíku, jehož přísun zajišťuje zvýšený krevní průtok v koronárním řečišti, který může narůst až pětkrát. Tento mechanismus se označuje jako funkční koronární rezerva. Spotřeba kyslíku je tedy základním faktorem působícím na regulaci koronárního průtoku. Jestliže koronární tepnu zužuje aterosklerotický plát, mohou nastat symptomy z nedokrvení srdečního svalu. Aterosklerotické pláty vzniklé poškozením endotelu mohou zúžit koronární tepny a vyvolat příznaky jako bolest na hrudi (angina pectoris) nebo dušnost. Kompletní uzávěr koronární tepny dokáže přivodit až infarkt myokardu. Ten se projeví akutní elevací ST úseku na EKG (v delším časovém horizontu vzniká patologický kmit Q), dále ztrátou schopnosti kontrakce a autonomním systémem zprostředkovanou bolestí za sternální kostí. Histopatologicky odumírají na srdci svalové buňky, a to směrem od subendokardu k subepikardu. Rozsah nekrózy závisí na velikosti oblasti, která je uzavřenou tepnou zásobována, a také na délce trvání uzávěru. Jediná možná cesta nápravy: obnovení perfúze kardioinvazivním či kardiochirurgickým řešením (dříve se užívala i trombolýza). Infarkt mohou komplikovat arytmie, srdeční selhání nebo poškození srdeční stěny.
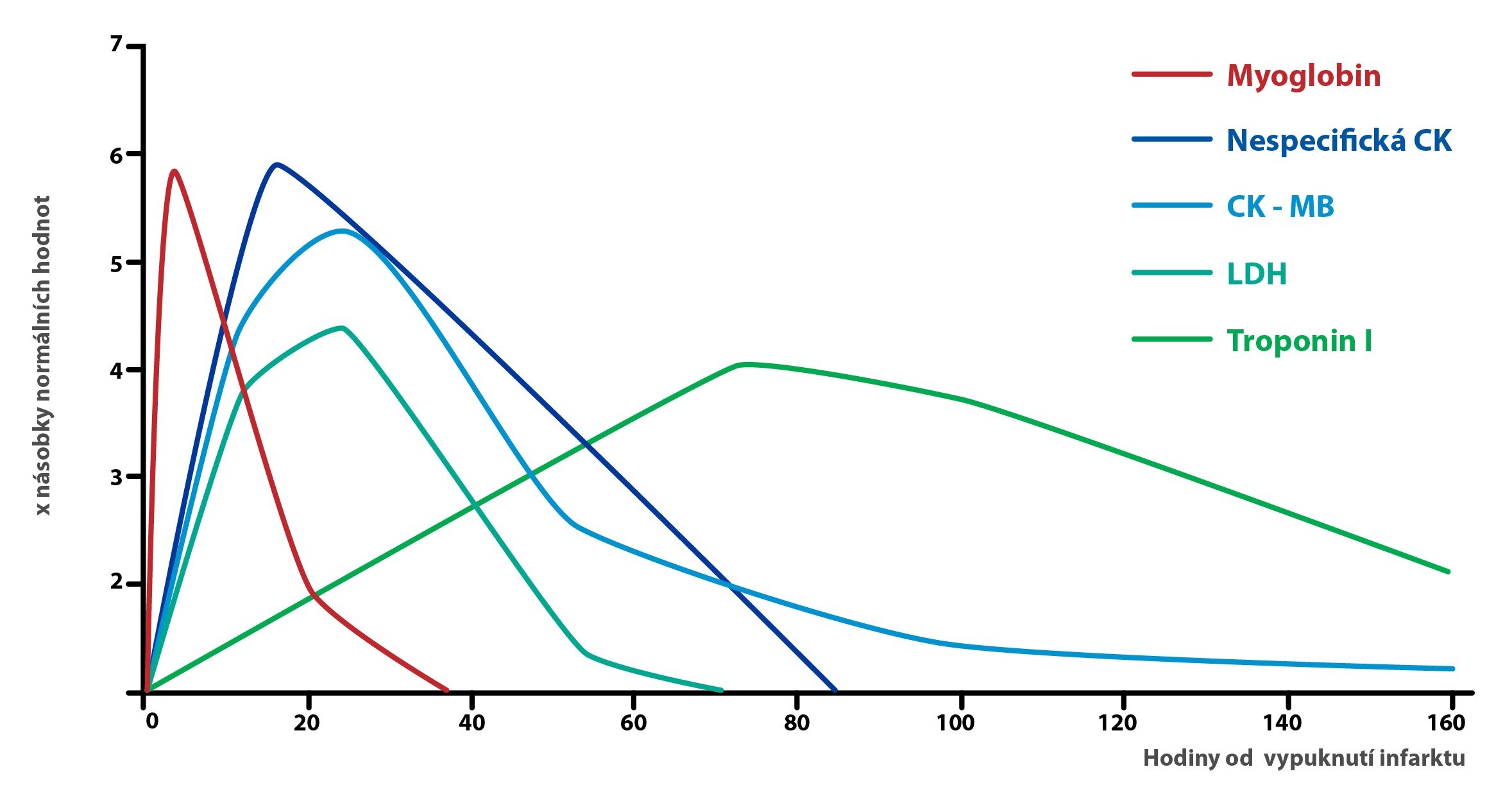
Při poškození buněk myokardu lze původně intracelulární látky, jež se dostávají do krevního oběhu, stanovit při odběru krve. Při infarktu myokardu jsou nejzásadnějšími látkami troponin T a troponin I (odlišné od troponinů v kosterní svalovině), kreatinkináza (CK) a její izoenzym CK-MB, či také AST a myoglobin. Poslední dva jmenované parametry mají dnes ale již jen historický význam.
_
Poruchy chlopní
Základními poruchami srdečních chlopní jsou nedomykavost a následný zpětný tok (insuficience a regurgitace) a zúžení (stenóza). Insuficience vede k poklesu tlaku v oddíle před chlopní a k její netěsnosti – dochází ke zpětnému toku krve a tím k objemovému přetížení srdečního oddílu nacházejícího se před chlopní. Stenóza způsobuje nárůst tlaku před chlopní a nedostatečný průtok krve přes chlopeň – nastává tlakové přetížení srdečního oddílu před chlopní. Neléčené srdeční vady končí srdečním selháním.
_
Srdeční selhání
Srdeční selhání je snížená schopnost výkonu myokardu, tedy selhání srdce jako pumpy. Srdeční selhání může zapříčinit prakticky každá nemoc postihující srdce – ICHS, hypertenze, chlopenní vady, kardiomyopatie nebo myokarditidy. Akutní srdeční selhání může vzniknout při akutních stavech, například při infarktu myokardu. Chronické srdeční selhání se vyvíjí postupně, například při chlopenních vadách.
Dalším možným dělením je rozdělení na systolickou nedostatečnost, která vzniká při objemovém přetížení, onemocnění myokardu nebo při tlakovém přetížení, a na poruchu diastolického plnění srdce, tedy diastolickou nedostatečnost při zvýšení tuhosti stěny komory.
Jako markery srdečního selhání se v současné době v praxi využívají natriuretické peptidy, zejména BNP (NT-proBNP).
_
Arytmie
Všechny kardiomyocyty jsou obdařeny schopností tvorby vzruchu – srdeční automacie (autonomie). Fyziologicky se vzruch generuje výhradně v pacemakerových buňkách, které se během diastoly spontánně depolarizují a po dosažení prahového potenciálu spouštějí akční potenciál. Různé etáže převodního systému mají jinou frekvenci spontánní depolarizace, a proto rozlišujeme aktuální a latentní pacemakerové buňky. Uzlová část převodního systému (uzel sinoatriální a atrioventrikulární) má poměrně nízkou (0,02-0,1 m/s) rychlost šíření vzruchu, ale naopak vysokou schopnost automacie. Za některých patologických situací jako např. při hypoxii, iontové dysbalanci (hlavně K+ a Ca2+), nadměrné stimulaci adrenergních receptorů, snížení teploty či účinkem některých léků se mohou i nepacemakerové buňky stát zdrojem depolarizace a tím i svalové kontrakce.
Srdce tepe normálním sinusovým rytmem v rozsahu 60-90 úderů za minutu. Fyziologicky ke zpomalení srdeční frekvence dochází například ve spánku (bradykardie) a ke zrychlení například při námaze (tachykardie). U mladých lidí se při dýchacích pohybech objevuje tzv. sinusová arytmie v závislosti na dýchání, kdy je při vdechu utlumena tonická vagová funkce, čím se srdeční frekvence při vdechu zvýší. V těchto případech hovoříme o arytmiích síňových. Sinusovou tachykardii mohou také vyvolat poruchy vybíjení SA uzlu (opakované rychlé vybíjení) nebo může být známkou krouživého (reentry) vzruchu. Mezi další síňové arytmie patří fibrilace síní, nepravidelné „míhání“ síní s frekvencí 300-600/min a s nepravidelným převodem na komory a flutter síní, s frekvencí 200-300/min a pravidelným převodem na komory z důvodu přítomnosti AV blokády (1:2, 1:3).
Jsou-li srdečním pacemakerem buňky komorového převodního systému, frekvence se zpomalí na 30-40/min a komplexy QRS jsou na EKG delší než 120 ms. Při vzniku reentry v komorách nastává paroxysmální komorová tachykardie. Při fibrilaci komor dochází k mnohačetnému reentry nebo ke vzniku mnohačetných ektopických ložisek vzniku vzruchu. Kvůli komorovému míhání je práce srdce neúčinná, fibrilující komory nečerpají krev a oběh se zastavuje. Jako účinná terapie se nabízí defibrilace. Komorová extrasystola je stah, který vzniká z ektopického ložiska v oblasti Purkyňových vláken. Supraventrikulární extrasystola se naopak vyznačuje štíhlým QRS komplexem.
Arytmie mohou dále vzniknout, přeruší-li se vedení vzruchů v srdci. Nastane-li přerušení převodního systému mezi síněmi a komorami (tzv. kompletní atrioventrikulární blokáda), aktivuje se komorový rytmus (30-40/min). Pokud se přeruší rytmus v oblasti nad AV uzlem, stává se tento pacemakerem s frekvencí 50/min – vzruch vzniká v oblasti AV junkce, a proto se nazývá junkční rytmus. Při zpomalení převodu vzruchu ze síní na komory dochází k nekompletní atrioventrikulární blokádě. Je-li vedení přerušeno za větvením Hissova svazku, vytváří se raménková blokáda (úplná nebo částečná, levá, pravá nebo bifascikulární). Ve všech výše uvedených případech se jedná o pravidelné arytmie.
_
Iontové dysbalance
Srdeční činnost ovlivňují jako zásadní faktor hladiny iontů. Nejdůležitějšími ionty při kontrakci srdečního svalu jsou K+, Ca2+ a Na+.
Draslík
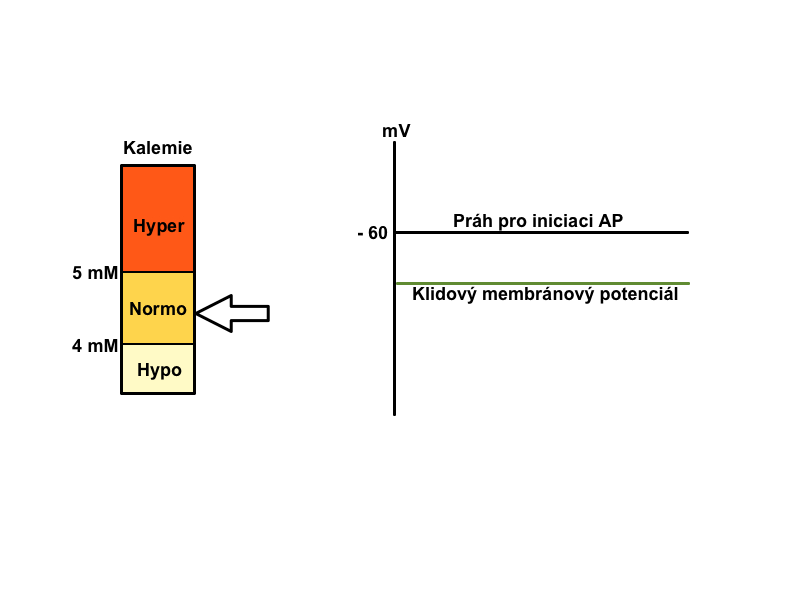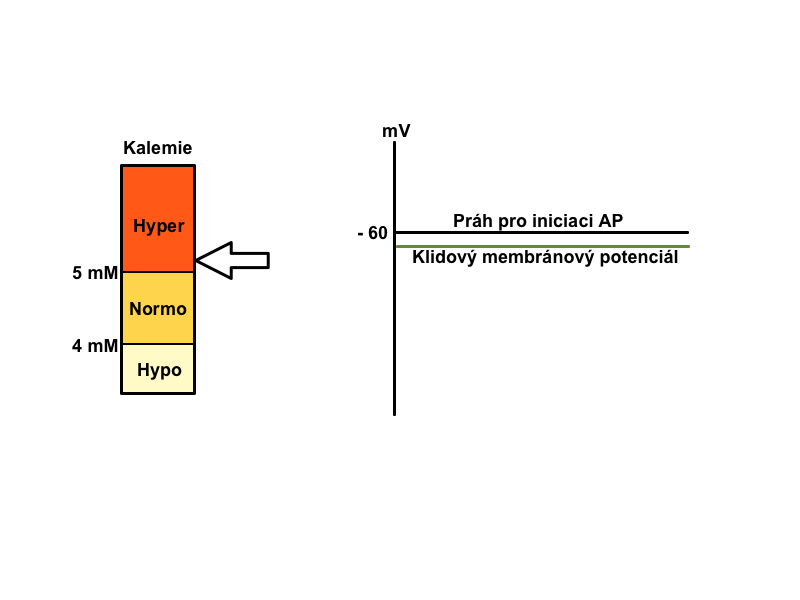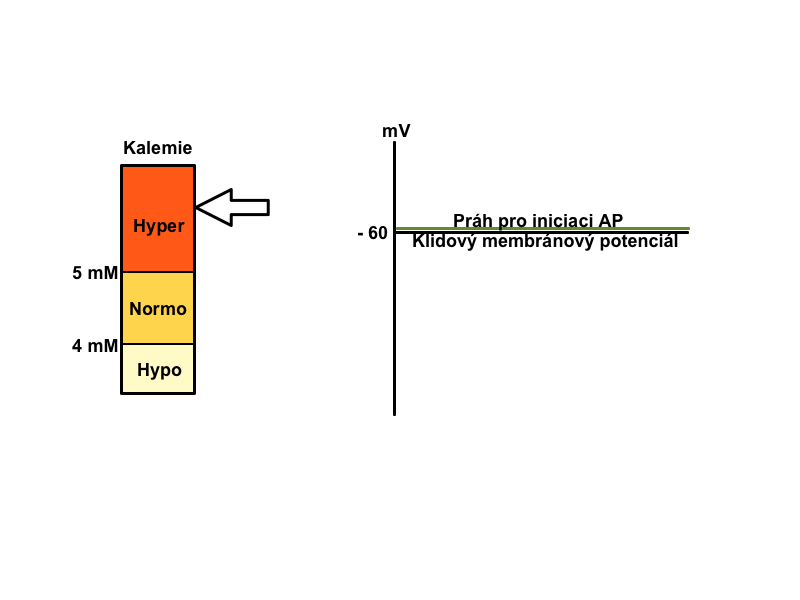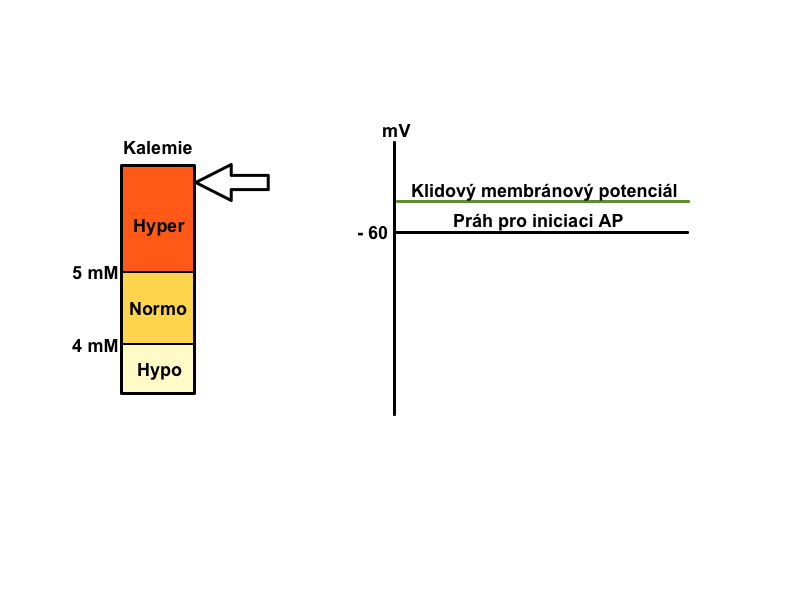
K+ si bere za úkol udržovat klidový membránový potenciál, který se při poruchách jeho homeostázy stává negativnějším (při hypokalemii) nebo pozitivnějším (při hyperkalemii), čímž ovlivňuje dráždivost elektricky aktivních tkání. Příjem K+ není významně regulován. Po příjmu většího množství K+ se vlivem inzulinu jeho většina přesune z krve do buněk (asi 80 %), odkud se pomalu uvolňuje a postupně vylučuje močí.
Přestup K+ do buněk ovlivňují různé faktory. Patří mezi ně zejména:
1) Zvýšená EC koncentrace K+ – zvyšuje aktivitu Na+/K+-pumpy
2) Inzulin – dodává energii Na+/K+-pumpě
3) Adrenalin – prostřednictvím β2-receptorů stimuluje Na+K+-ATPázu, α2-receptory ji naopak inhibují
4) Aldosteron – zvyšuje přestup K+ do buněk, v ledvinách ale způsobí zvýšené vylučování do moči)
5) pH – při alkalóze, kdy je v extracelulární tekutině málo protonů, vystupuje H+ z buňky výměnou za K+ – jestliže vystoupí kladný iont z buňky, pak v buňce chybí kladný náboj a musí být nahrazen. Tak vzniká hypokalemie. Při acidóze dochází naopak ke vstupu H+ do buněk, a aby byl zachován poměr kationty/anionty, K+ opouští buňku – vzniká hyperkalemie
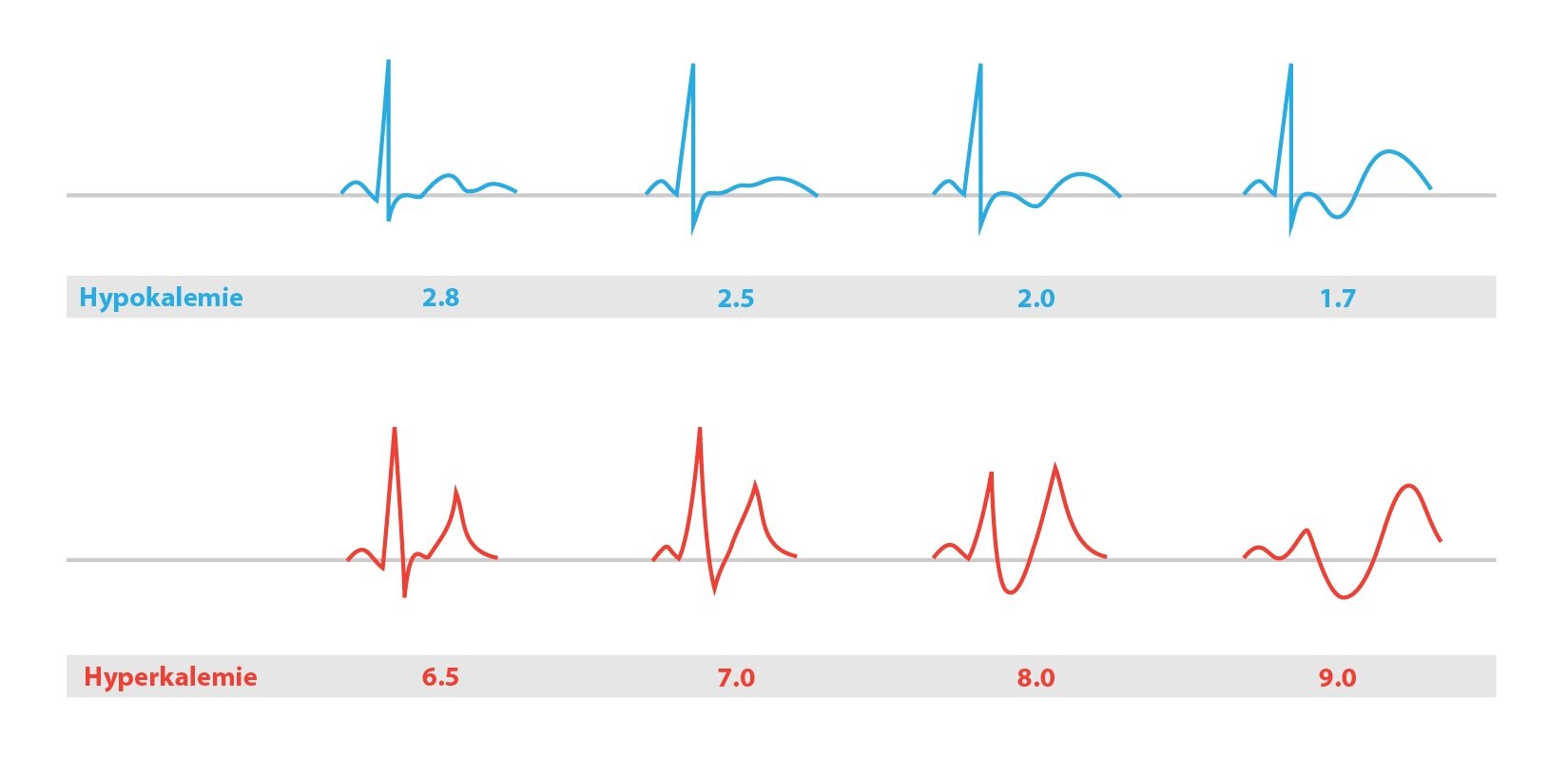
Při hyperkalemii se klidový membránový potenciál stává méně negativním, a proto v první fázi hyperkalemie je snazší vyvolat podněty. Zvětšuje se dráždivost a vodivost, v srdci mohou vznikat poruchy rytmu a pacienti mívají parestezie. Při těžké hyperkalemii dochází k vzniku ještě méně negativního klidového membránového potenciálu, sodné kanály zůstávají inaktivované a nastupuje fáze druhá, se svalovou slabostí až paralýzou. V případě extrémní hyperkalemie se celý proces uzavírá zastavením činnosti srdce – tzv. asystolie, ochrnutí srdce.
Hypokalemie nejčastěji nastává při snížení celkového množství K+ v těle, vzácně může být dána přestupem K+ do buněk. Příznaky začínají být zjevné při koncentraci K+ pod 3 mmol/l. Skutečný deficit draslíku způsobuje jeho neadekvátní příjem (hladovění, anorexie či alkoholismus), profúzní pocení, průjem, zvracení (přímá ztráta K+, ale také navození alkalózy ztrátou Cl–, což vede k přestupu K+ do buněk a kromě toho se kvůli ztrátě vody zvýší sekrece aldosteronu) či jeho ztráty ledvinami (diuretika, hypersekrece aldosteronu či kortikoidů, polyurie při renálním selhání). Relativní nedostatek draslíku vzniká jeho zvýšeným přesunem do buněk při akutní alkalóze nebo náhlým masivním zvýšením cirkulujícího inzulinu. Při hypokalemii se v srdci prodlužuje vedení vzruchu a snižuje se automacie srdce. V srdci se vytvářejí poruchy rytmu, na EKG se může objevit vlna U. Závažná hypokalemie může vyvolat maligní komorové arytmie včetně fibrilace komor.
Vápník
Pro myokard a neuromuskulární dráždivost má význam především ionizovaný vápník. Jeho pokles vede k vyšší dráždivosti, nárůst naopak stabilizuje membrány a snižuje dráždivost buněk. Zvýšení intracelulární koncentrace vzrušivost buněk zvyšuje (např. během hypoxie tkání). Vápenaté ionty zodpovídají za kontrakci srdce, jeho buňky ale současně nemají dostatečně vyvinuté sarkoplazmatické retikulum, a srdeční stah tedy významně závisí na extracelulárním vápníku (plazmatické ionizované Ca2+).
Při hladině Ca2+ vyšší než 4 mmol/l se objevuje hyperkalcemická krize, zmatenost, bezvědomí a zástava srdce v systole. Hyperkalcemie zkracuje délku akčního potenciálu, což se na EKG křivce projevuje zkrácením intervalu QT. Těžká hyperkalcemie vede k snižování amplitudy vln T až k jejich verzi. Při hypokalcemii se interval QT naopak prodlužuje.
_
Hypertenze
Střední arteriální tlak závisí na srdečním minutovém objemu (CO) a na celkové periferní rezistenci (PR). Optimální hodnota TK vzhledem k riziku vývoje kardiovaskulárních onemocnění činí 120/80 mmHg, nicméně jako hypertenze se uvádí krevní tlak vyšší než 140/90 mmHg. Hypertenzí nazýváme opakované zvýšení krevního tlaku ≥ 140/90 mmHg prokázané alespoň ve dvou ze tří měření při nejméně dvou návštěvách u lékaře.
Neléčený vysoký krevní tlak způsobuje přetížení levé komory, která nejdříve kompenzačně hypertrofuje, ale z dlouhodobého hlediska je pacient s hypertenzí ohrožen srdečním selháním. Rozlišujeme dva základní druhy hypertenze – primární a sekundární.
Primární (esenciální) hypertenze postihuje asi 95 % nemocných s hypertenzí. Jedná se o multifaktoriální onemocnění bez známé organické příčiny.
Sekundární hypertenze je zvýšení krevního tlaku kvůli zjistitelné organické příčině – například různá endokrinní onemocnění (primární hyperaldosteronismus, feochromocytom či Cushingův syndrom), postižení ledvin – tzv. renovaskulární hypertenze, syndrom spánkové apnoe či koarktace aorty. Souhrnně představuje kolem 5 % všech hypertenzí.
_
Edém
Edém je nahromadění intersticiální tekutiny v abnormálně velkém množství. Změny množství tekutiny v intersticiu mohou mít mnoho příčin: zvýšený filtrační či venózní tlak, snížená hladina plazmatických bílkovin, osmoticky aktivní látky v intersticiu, zvýšená permeabilita kapilár, retence solí nebo porucha lymfatického odtoku.
Autoři podkapitoly: Peter Ivák, Josef Kroupa, Patrik Maďa a Josef Fontana