Náplň podkapitoly:
1. Reologické vlastnosti krve
2. Tlak krve (TK) a jeho měření
3. Průtok krve orgány
4. Regulace krevního oběhu
5. Mikrocirkulace
6. Lymfatická cirkulace
7. Žilní návrat
8. Fetální krevní oběh
_
Reologické vlastnosti krve
Reologie je vědní obor, který zkoumá mechanické vlastnosti spojitých prostředí (tzv. mechaniku kontinua). V lékařství se pak zaměřuje na proudění krve v cévách a její další vlastnosti.
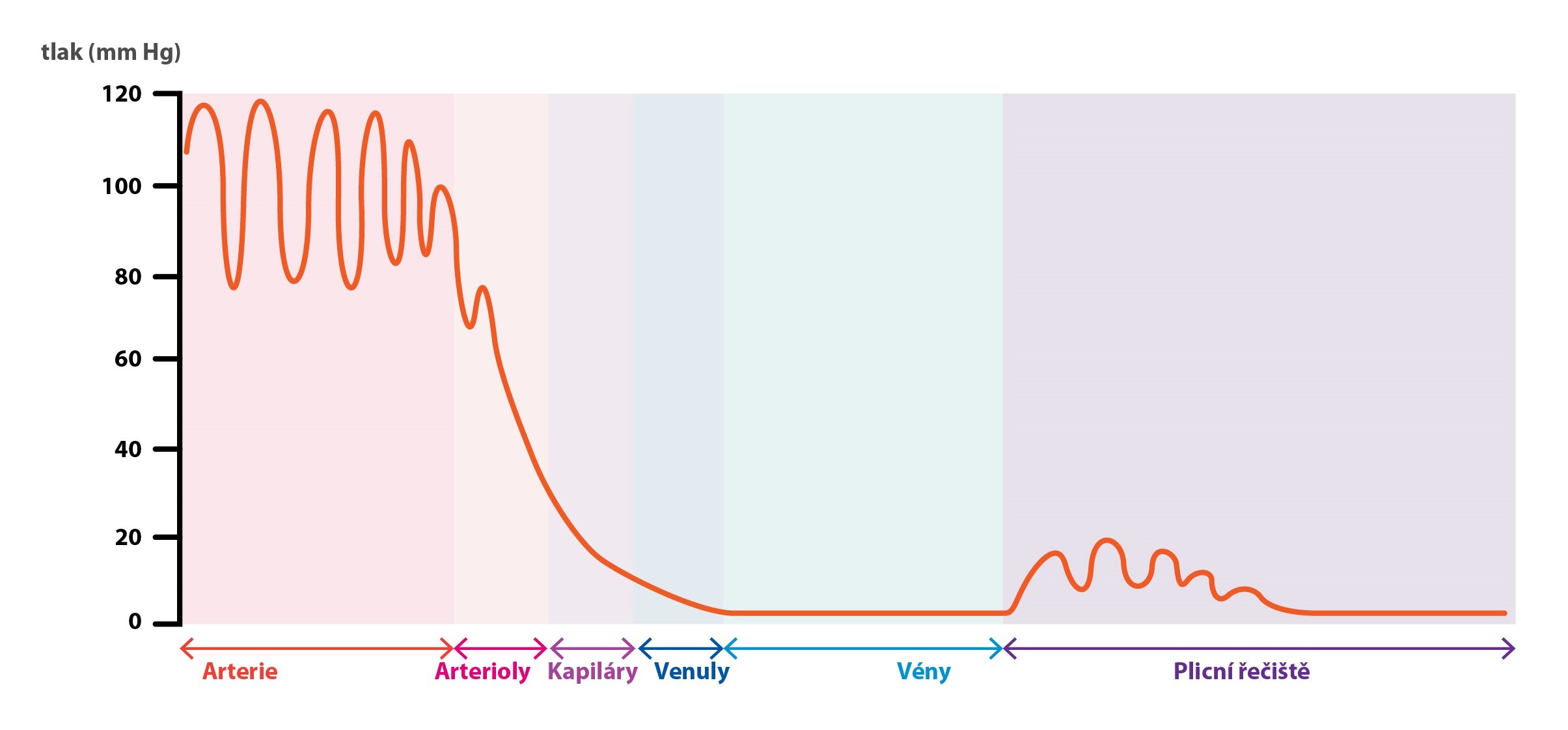
Pro detailní porozumění fyziologickým dějům v kardiovaskulárním systému je nutné znát jak biofyzikální vlastnosti krve, tak její vzájemnou interakci se systémem cév. Cévní systém lze funkčně rozdělit na arterie, arterioly, kapiláry, venuly a vény. O jejich vlastnostech pojednáme před popisem vlastních reologických veličin.
Arterie
Arterie rozvádějí krev pod vysokým tlakem po celém těle. Přizpůsobily se k tomuto účelu i morfologicky a mají silnou, na svalovinu bohatou stěnu. V každém okamžiku obíhá v arteriích asi 13 % krve přítomné v systémové cirkulaci.
Arterioly
Arterioly, nejmenší větve arterií, si berou za úlohu řízení uvolňování krve do kapilár, zejména pak snížení středního tlaku a vyvážení pulzace. Díky arteriolám nehrozí kapilárám poškození vysokým tlakem a výměna látek v mikrocirkulaci probíhá konstantním tempem. Malé arterie a arterioly se označují jako resistentní (odporové) cévy a jsou hlavním místem odpovědným za periferní odpor.
Kapiláry
V kapilárách, funkčních částech mikrocirkulace, probíhá výměna živin a elektrolytů na základě Starlingových sil – viz dále v textu. Objem krve v kapilárách a arteriolách tvoří pouze 7 % celkového systémového objemu. Přestože se jedná o malý podíl, je dostatečně velký pro zajištění nutričních potřeb všech tkání.
Venuly
Venuly sbírají krev z kapilár a postupně se slévají do větších žil.
Žíly
Žíly se často označují jako nízkotlaký systém či kapacitní cévy. Plní dvě základní úlohy. Jednak vedou krev zpět k srdci, jednak slouží jako největší zásobník krve, kterou lze uvolnit v případě potřeby. Za fyziologických okolností se v žilách nachází asi 50 % systémového intravazálního objemu.
Na každý z těchto systémů musíme pohlížet jako na zvláštní funkční systém zapojený v sérii k následujícímu. Pro zjednodušení popisu dějů, k nimž v těchto systémech dochází, byla zavedena tzv. plocha průřezu. Jedná se o plochu, kterou bychom získali přiložením např. všech arterií nebo všech kapilár vedle sebe, respektive o souhrn průřezů všech cév daného funkčního systému. Tento koncept nám umožňuje vypočítat rychlost toku krve v daném typu cévy.
Vycházíme z principu, že rychlost toku krve je přímo úměrná minutovému průtoku krve daným segmentem a nepřímo úměrná ploše průřezu:
v = F/S
Vezmeme-li v úvahu, že minutový průtok je stejný v celém řečišti (5 l/min), plocha průřezu aortou je asi 2,5 cm2, ale průřez kapilárami je až 2500 cm2, je jasné, že rychlost toku bude v kapiláře asi 100x pomalejší.
Pro porovnání rychlosti ve dvou funkčních oddílech také platí, že:
v1S1 = v2S2
Tok krve, tlak a rezistence
Tok krve je veličina udávající míru přesunu krve v cévě. Vyjadřuje se jako jednotka objemu za jednotku času – např. l/min. Tok krve se značně podobá konceptu elektrického proudu, který udává míru přesunu elektricky nabitých částic ve vodiči. S několika rozdíly:
Tlakový gradient
Tlakový gradient neboli rozdíl tlaků na začátku a konci trubice (cévy) je hlavní příčinou toku krve v cévách. Jakákoliv kapalina se bude pohybovat z místa, kde působí vysoký tlak, do místa s nízkým tlakem. Srdce jakožto pumpa pak musí tento tlakový gradient vytvořit.
Stejný princip nacházíme ve fyzice u elektrického proudu, kde místo tlakového gradientu vystupuje elektrické napětí, které není nic jiného než rozdíl elektrického potenciálu na začátku a na konci vodiče.
Vaskulární rezistence
Stejně jako elektrický proud je nepřímo úměrný odporu i tok krve. V případě odporu (neboli rezistence) cévního řečiště jde o koncept závisející na celé řadě faktorů, kterými se budeme zabývat dále v textu.
Z výše uvedeného ale vyplývá, že tok krve můžeme vypočítat z Ohmova zákona:
F = ΔP / R
kde:
F = tok krve
ΔP = tlakový gradient (P1-P2)
R = odpor cévního řečiště
Proudění krve v cévách
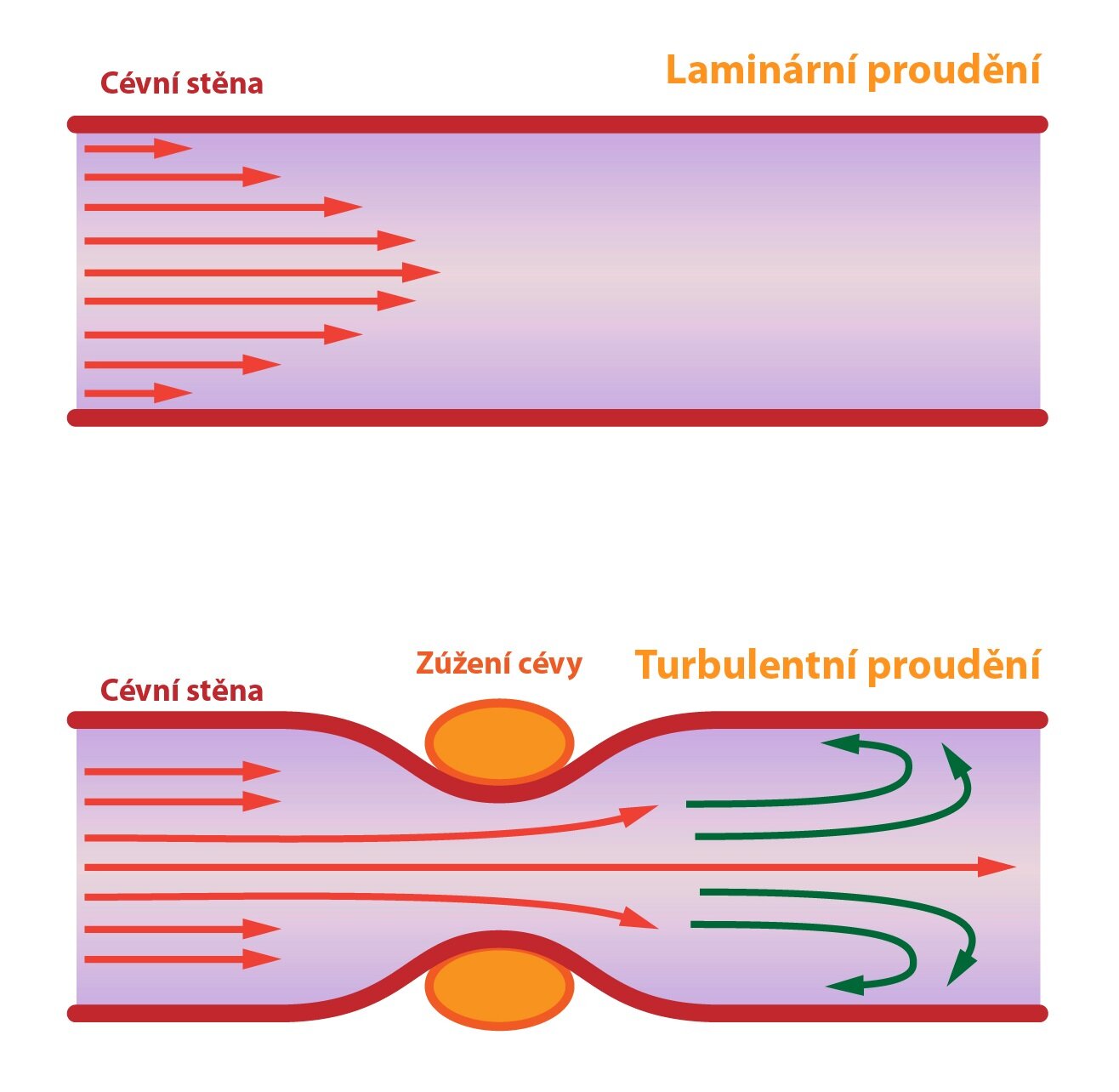
Kvantitativně můžeme vyjádřit přesun krve v cévě jako tok. Ten nám určuje, jaký objem krve cévou proteče za minutu. Existuje i další hledisko, a to čistě kvalitativní – nazýváme jej proudění. To vyjadřuje, jakým způsobem krev cévou „proteče”. Může být dvojí: laminární nebo turbulentní.
Laminární proudění
Laminární proudění nastává v rovných úsecích cév s nepoškozeným endotelem. Krví můžeme proložit tzv. proudnice. Jedná se o pomyslné křivky, které procházejí každou molekulou krve a vzájemně se nikdy nekříží. Vyjadřují, že v krvi nevznikají víry a teče uspořádaně.
Pro toto proudění je charakteristický tzv. parabolický profil rychlostí. Tento termín vyjadřuje fakt, že nejrychleji se pohybují molekuly v centru krevního proudu a nejpomaleji molekuly v kontaktu se stěnou cévy. Jednoduché zdůvodnění: tření o stěnu cévy. Proud molekul zpomalený kontaktem s endotelem zpomaluje ty, které proudí vedle něj atd.
Turbulentní proudění
Nastává, pokud je hodnota toku příliš vysoká, céva je zúžená nebo se v jejím luminu nachází nějaká překážka či nerovnost. V krvi vznikají víry a nelze jí proložit proudnice. Jestliže se vyskytne turbulentní proudění, prudce se zvýší rezistence cévy a sníží hodnota toku.
Nelze přesně určit, kdy se proudění stává turbulentním, ale dá se spočítat určitá pravděpodobnost pro tento jev, zde vyjádřená jako tzv. Reynoldsovo číslo.
Re = (v . d . ϱ ) / η
kde:
Re = Reynoldsovo číslo
v = rychlost toku krve
d = průměr cévy
ϱ (ró) = hustota krve
η (éta) = viskozita
Re pak může nabývat následujících hodnot:
1) Re < 200: turbulentní proudění se pravděpodobně nevyskytuje nikde v daném úseku
2) 200 < Re < 2000: turbulentní proudění se pravděpodobně vyskytuje na nerovných částech zkoumaného úseku a v blízkosti překážek
3) Re > 2000: turbulentní proudění se vysoce pravděpodobně vyskytuje i na rovných částech zkoumaného úseku
Odpor cévního řečiště
Rezistence nemůže být přímo měřena, lze ji pouze spočítat z tlakového rozdílu a toku krve. Vyjadřuje se v PRU, tzv. jednotkách periferní rezistence. Krevní řečiště má odpor 1 PRU, pokud při tlakovém gradientu 1 mmHg jím proteče 1 ml/s. PRU se někdy nazývají Woodsovy jednotky.
Fyziologicky je cévní rezistence daná celou řadou faktorů. Jednak třením krve o povrch cévy, jednak úrovní konstrikce. Čím vyšší úroveň konstrikce, tím větší cévní rezistence (úroveň konstrikce arteriol je dokonce rozhodujícím faktorem co do velikosti odporu krevního řečiště).
Celková vaskulární rezistence
Kdybychom chtěli vypočítat odpor celého systémového řečiště, tak tok krve odpovídá srdečnímu výdeji (tzn. přibližně 100 ml/s) a tlakový gradient mezi aortou a horní dutou žilou má velikost asi 100 mmHg. Za těchto okolností je odpor celého systémového řečiště 1 PRU. Tato hodnota se samozřejmě za různých fyziologických stavů mění a může vzrůst až k 4 PRU, pokud je kontrahována většina arteriol periferního řečiště, nebo naopak klesnout k 0,2 PRU při povšechné dilataci arteriol.
Vodivost
Vodivost udává, jak snadno cévou protéká krev při určitém tlakovém gradientu. Jedná se v podstatě o konstantu úměrnosti, pro kterou platí:
C = F / ΔP
Z toho také vyplývá, že vodivost je převrácenou hodnotou odporu:
C = 1 / R
Význam vodivosti spočívá v tom, že nám umožňuje popisovat jevy, pro které by bylo vyjádření v cévním odporu méně názorné.
Například z experimentů s průměrem cévy a hodnotou toku vyšlo, že vodivost se zvyšuje se 4. mocninou průměru. Pokud tedy zvýšíme průměr dvakrát, vodivost se zvýší šestnáctkrát. Máme-li cévu, kterou při průměru 1 mm (d = 1 mm) protekl 1 ml krve za sekundu (F = 1 ml/s) a tato céva se bude dilatovat na dvojnásobný průměr (d = 2 mm) – tzn. i poloměr se zvýší 2x – nárůst toku bude šestnáctinásobný (F = 16 ml/s).
Tento princip lze vyjádřit jako Poiseuilleho zákon:
F = (π . ΔP . r4) / (8 . η . l)
Tento zákon také vysvětluje rozhodující roli arteriol v řízení krevního průtoku periferními tkáněmi. Ty jsou totiž schopny dilatovat až čtyřikrát – mohou vést k lokálnímu zvýšení průtoku až 256krát.
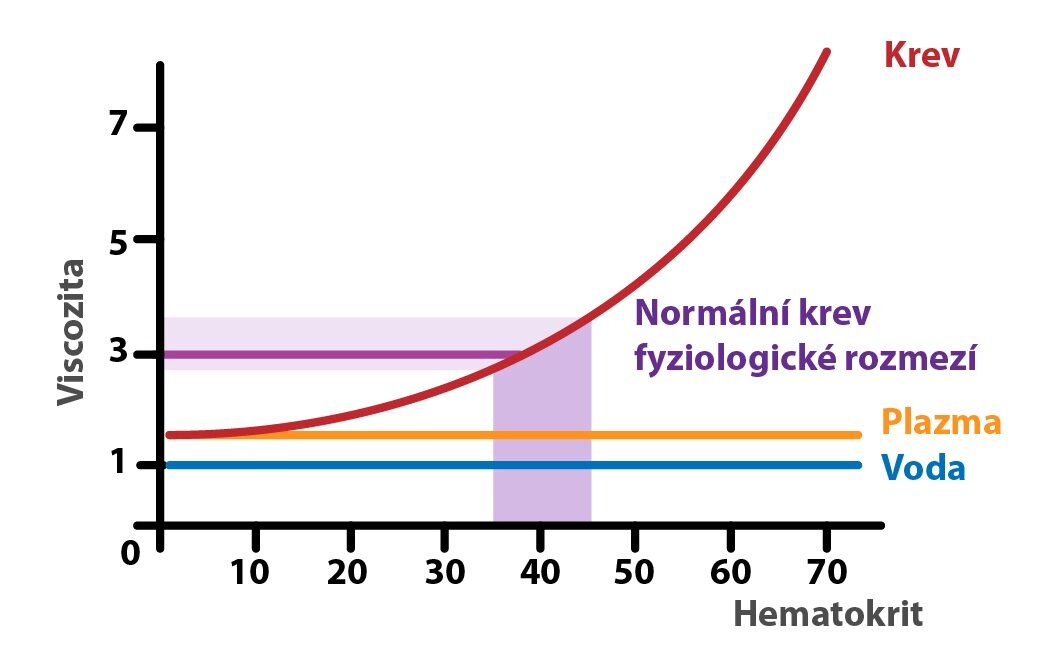
Viskozita
Viskozita neboli vazkost je veličina, která charakterizuje vnitřní tření tekutiny a závisí především na přitažlivých silách mezi částicemi. Za fyziologických podmínek je viskozita krve asi 3x vyšší než viskozita vody. Za tento nárůst viskozity odpovídají největší měrou červené krvinky, jež zvyšuji vnitřní tření. Můžeme tedy tvrdit, že spolu s hematokritem roste i viskozita.
_
Tlak krve (TK) a jeho měření
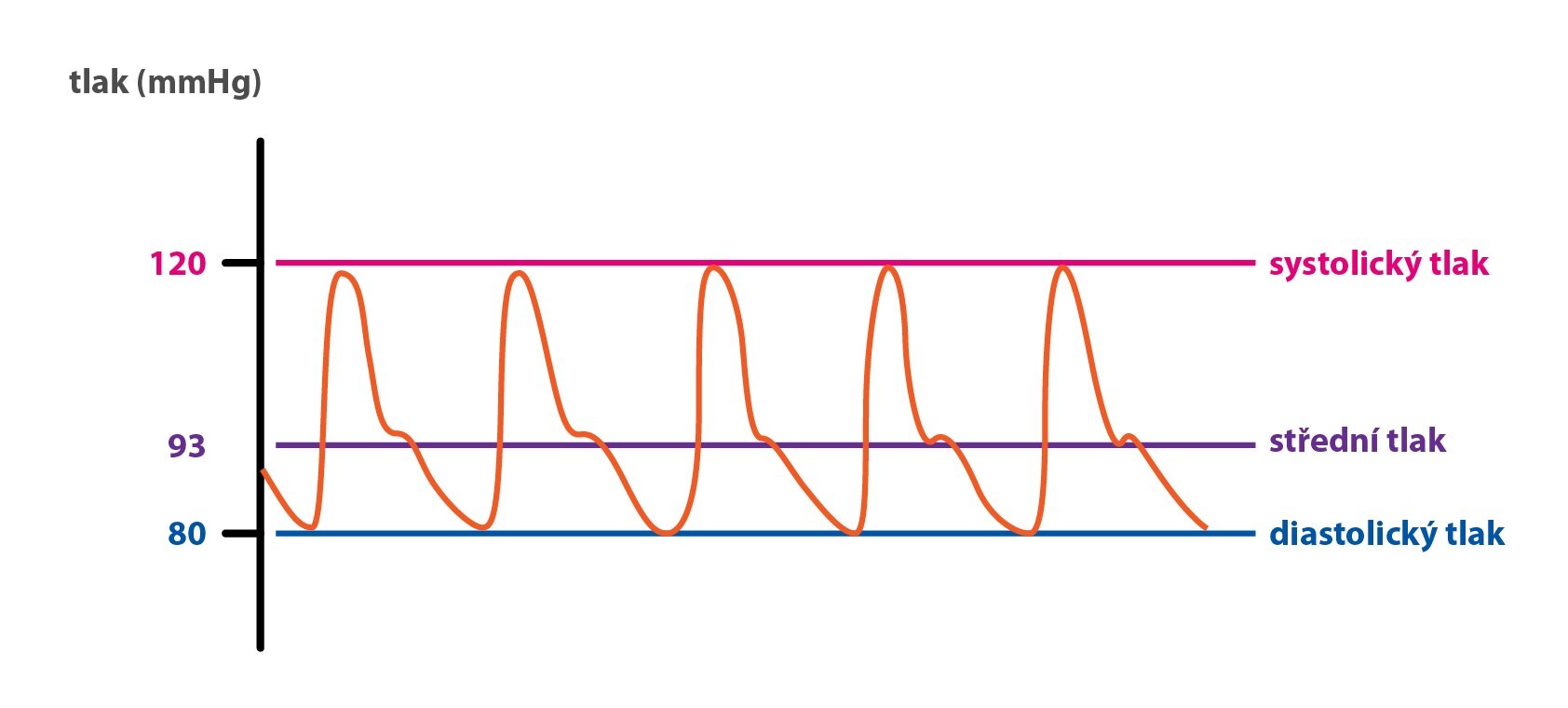
Pod pojmem krevní tlak rozumíme tlak v systémových tepnách. V průběhu srdečního cyklu – při vypuzovací fázi, kdy je levou komorou překonán tlak krve ve velkých tepnách a otevře se aortální chlopeň, stoupá tlak v aortě na maximum – systolický tlak. Pak po uzavření aortální chlopně postupně klesá tlak ke svému minimu – diastolický tlak. Rozdíl mezi těmito tlaky se nazývá tlaková amplituda. Nejdůležitějším parametrem, dle kterého můžeme posoudit prokrvení periferie, je tlak střední, průměr tlaku během srdečního cyklu.
Měření krevního tlaku
Měření můžeme provést přímo nebo nepřímo. Přímé měření TK je možné po zavedení kanyly do krevního proudu, jedná se tedy o měření krvavou cestou. Nejčastěji se používají přístupy a. radialis, a. brachialis a a. femoralis.
Standardní metodou aplikovanou při rutinním měření TK je auskultační metoda (Riva-Rocci) pomocí nafukovací manžety omotané kolem paže, manometru a stetoskopu umístěného v kubitální jamce nad a. brachialis. Při měření se manžeta nafoukne nad očekávanou hodnotu systolického TK a v tomto momentě je a. brachialis uzavřena, takže ve stetoskopu není slyšet žádný zvuk. Při pomalém snižování tlaku v manžetě se v okamžitu, kdy systolický tlak v arterii překročí tlak v manžetě, začnou v stetoskopu objevovat zvuky synchronní s tepem a hodnota na manometru se rovná systolickému tlaku v mmHg. Tento jev, tzv. Korotkovův fenomén, vzniká turbulentním prouděním v brachiální arterii. Nakonec, při vymizení zvuku, tedy při změně turbulentního proudění na laminární, se odečte diastolický tlak. Normální krevní tlak u dospělého jedince činí 120/80 Torr.
Tlak krve v plicnici
Kvůli nižšímu odporu v plicním řečišti musí pravá komora při čerpání krve vygenerovat nižší tlak než levá komora k vypuzení krve do velkého řečiště. Střední tlak v plicnici dosahuje hodnoty asi 15 mmHg.
_
Průtok krve orgány
Průtok krve mozkem
Do mozku přitéká až 15 % klidového srdečního výdeje, a to z důvodu vysoké spotřeby kyslíku v mozkové tkáni. Mozek sice představuje jen 2 % tělesné hmotnosti, ale vyžaduje až 20 % celkové dodávky kyslíku. Ten je utilizován zejména v šedé hmotě mozkové.
Zásobení mozku okysličenou krví probíhá prostřednictvím dvou vnitřních krkavic a dvou vertebrálních arterií, které se dále spojují v a. basilaris. Ta společně s vnitřními karotickými tepnami tvoří Willisův okruh, z něhož odstupuje šest velkých cév zásobujících kůru mozku. Odtok krve zajišťují zejména hluboké žíly a sinusy odvádějící krev do v. jugularis interna.
O významu mozkomíšního moku a hematoencefalické bariéry pojednává Kapitola 12.
Regulace průtoku krve mozkem
Průtok krve mozkem musí být regulován tak, aby se i během měnících se podmínek udržela jeho celková hodnota konstantní. Ovlivňuje ho arteriální a venózní tlak na úrovni mozku, intrakraniální tlak, viskozita krve a stupeň aktivní konstrikce či dilatace mozkových arteriol. Uplatňují se zde především metabolické mechanismy.
Nejzásadnějším faktorem způsobujícím vazodilataci je vzestup pCO2 (hyperkapnie) – zvýšeným průtokem krve se odstraní přebytek CO2. Proto při hyperventilaci, kdy nastává naopak hypokapnie, mohou z důvodu vazokonstrikce mozkových cév vznikat mdloby. Vyšší hladina K+, vyšší osmolarita či adenozin vyvolávají také vazodilataci. Lokální pokles pO2 též zvyšuje průtok krve mozkem. Mnoho látek s vazoaktivními účinky v jiných tkáních mozkovou cirkulaci vůbec neovlivňuje.
Neurogenní kontrola není příliš významná. Za zmínku stojí noradrenergní vlákna sympatiku vycházející z ganglion cervicale superior s významným vazokonstrikčním účinekem. Parasympatikus s mediátorem acetylcholinem má malý regulační význam.
Nitrolební tlak je určován tlakem mozkové tkáně, tlakem mozkomíšního moku a tlakem krve na skelet lebeční. Zvětšení kteréhokoli kompartmentu intrakrania (mozkové tkáně, mozkomíšního moku či krve) vyvolá vzestup intrakraniálního tlaku. Při vzestupu žilního tlaku se tedy také zvýší intrakraniální tlak a takovýto zvýšený intrakraniální tlak způsobí snížení perfúze mozku tím, že stlačí intrakraniální mozkové tepny. To vede k relativnímu zvýšení tlaku krve v tepnách, a tedy ke snaze autoregulačních mechanismů o jeho snížení (nastává tak snížení efektivního perfúzního tlaku).
Vlastní autoregulace spočívá v tom, že při zvýšení systémového tlaku dochází vCNS kompenzačně k vazokonstrikci, při poklesu systémového tlaku se udržuje dostatečný průtok CNS vazodilatací cerebrálního řečiště.
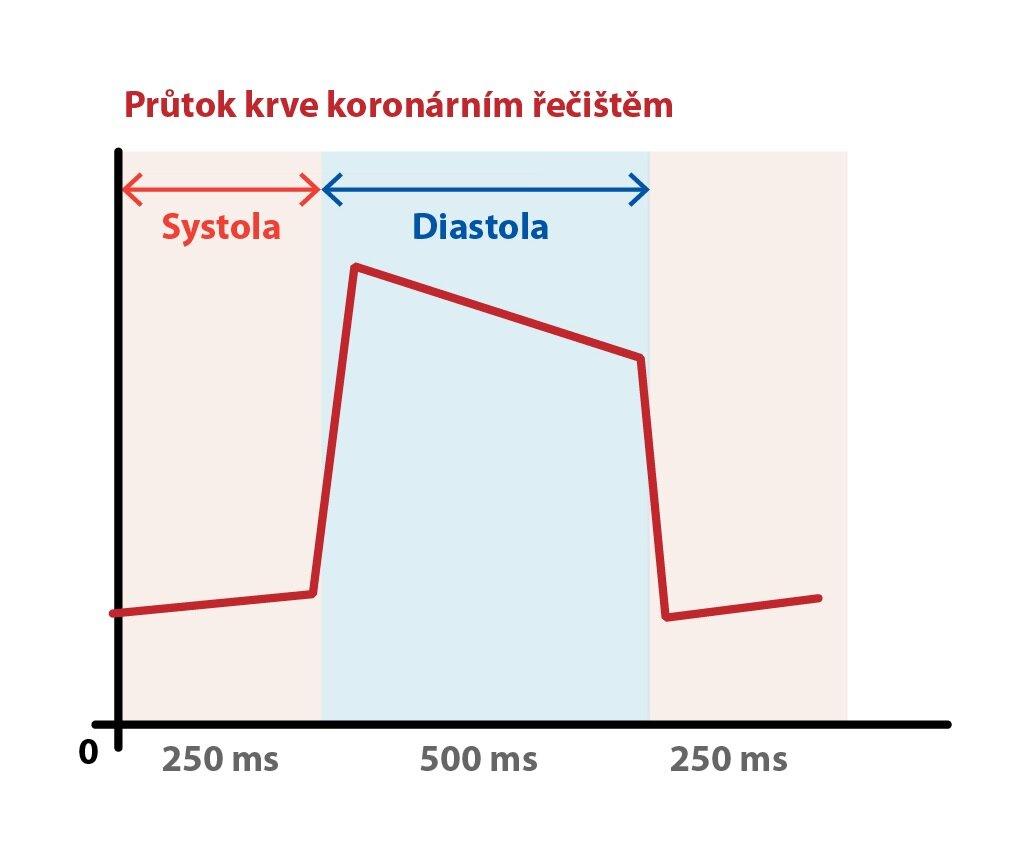
Průtok krve koronárním řečištěm
Koronární průtok srdcem v klidu je asi 250 ml/min. Myokard zásobují dvě koronární tepny odstupující nad aortální chlopní. Levá koronární arterie zásobuje přední část septa, převodní soustavu a většinu levé komory. Pravá věnčitá tepna zásobuje většinu pravé komory, zadní části septa a většinou i spodní stěnu levé komory. Velké větve uložené subepikardiálně se zanořují do myokardu, kde končí v subendokardiálním prostoru jako kapiláry. Jen velmi tenkou vrstvu těsně pod endokardem může okysličovat krev srdečních dutin.
Během systoly jsou intramurálně probíhající koronární tepny stlačeny stahujícím se myokardem. Tento intramurální tlak je v této fázi tak výrazný, že průtok levou koronární arterií během systoly téměř ustává a na jejím počátku se dokonce obrací. Poměr trvání systoly, kdy se řečiště přivírá, a diastoly, kdy je naopak otevřeno, je velmi důležitý. Při extrémně vysoké srdeční frekvenci se významně zkracuje doba průtoku tepnami, protože diastolická fáze srdečního cyklu je zkrácená.
Během ejekční fáze systoly míjí proud krve odstupy koronárních tepen v oblasti nad aortální chlopní. Po dosažení tlakového maxima se vlivem pružníkového efektu proud v kořeni aorty obrací a chlopeň se uzavírá. Proud krve nyní směřuje do odstupů koronárních tepen. V tomto okamžiku již srdce prožívá fázi izovolumické relaxace, mizí tedy komprese tepen, a proto tu proud dosahuje svého maxima.
Regulace průtoku krve koronárním řečištěm
Nejvýznamnějším regulátorem koronárního průtoku je pO2 v krvi. Pokles pO2 způsobí vazodilataci. Při nedostatku kyslíku také nemůže být AMP dostatečně regenerován na ATP, což vyústí v hromadění produktu odbourávání AMP – adenozinu, hlavního vazodilatačního působku. Vazodilataci dále způsobuje zvýšení pCO2, pokles pH, vyplavení buněčného draslíku, prostaglandiny, histamin, NO (z endotelu) atd.
Autonomní nervová regulace probíhá prostřednictvím α-adrenergních receptorů, které zprostředkovávají vazokonstrikci, a β2-adrenergních receptorů způsobujících vazodilataci. Klesá-li krevní tlak, je převládajícím účinkem reflexního zvýšení noradrenergní aktivity zvýšení koronárního průtoku v myokardu, zatímco kožní, renální a splanchnické cévy se zužují. Tímto mechanismem je průtok srdcem, podobně jako průtok mozkem, udržován, i když průtok ostatními orgány klesá.
Průtok krve plicním řečištěm
Nízkotlakým plicním krevním oběhem proteče 100 % srdečního výdeje. Plicní oběh se anatomicky liší od jiných částí na úrovni mikrocirkulace, protože arterioly a venuly jsou kratší, mají větší průměr a bohatě anastomozují. Střední tlak v a. pulmonalis činí asi 15 mmHg – tlak v plicním oběhu je tedy výrazně nižší, než v systémovém řečišti.
Regulace průtoku krve plicním řečištěm
Řízení krevního oběhu zprostředkovávají lokální metabolity, zejména kyslík a oxid uhličitý. Zde však navozují opačný účinek než v jiných tkáních. Hypoxie či vzestup parciálního tlaku oxidu uhličitého vyvolávají vazokonstrikci, a to pomocí inhibice tvorby NO v endoteliálních buňkách cévní stěny. Díky tomu je při hypoventilaci určité oblasti krev redistribuována tak, aby dosáhla lépe ventilovanou část plic. Směrem k plicní bázi se tlak krve zvyšuje – vyšší hydrostatický tlak krve vystoupí až na +12 mmHg. To způsobuje rozdílnou perfúzi v různých etážích plic.
Průtok krve splanchnickou oblastí
Krev do střev přitéká prostřednictvím mesenterických arterií a objem krve odpovídá metabolické aktivitě ve střevech. Během trávení se krevní průtok zdvojnásobuje. Krev ze žaludku, střev, ale i z pankreatu a sleziny odtéká portální žilou, vrátnicí, do jater a odtud jaterními žílami do dolní duté žíly. Do splanchniku vstupuje asi 30 % srdečního výdeje.
Krevní oběh v játrech je dvojí – nutriční a funkční. Nutriční zajišťuje jaterní tepna (a. hepatica), která přivádí kyslík pro zabezpečení funkce jater. Oproti tomu funkční oběh je zprostředkován vrátnicovou žilou (v. portae, TK 10 mmHg), jež přináší vstřebané živiny ze střev a větví se až na sinusoidy. Ty protékají mezi trámci hepatocytů a setkávají se v centrální žíle. Centrální žíly se opět spojují až do jaterních žil, které se vlévají do dolní duté žíly.
Jaterní acinus obsahující terminální větve vrátnicové žíly, jaterní tepny i žlučovodu je funkční jednotkou jater. Tok krve ze středu acinu směrem k terminálním větvím jaterních žil (vv. centrales) napovídá o okysličení acinu. Jeho centrální část (zóna I) je nejlépe okysličená, v dalších částech (zóna II a zóna III) kyslíku postupně ubývá, a proto je zóna III nejnáchylnější k postižení při hypoxii.
Regulace průtoku krve játry
Regulace průtoku probíhá prostřednictvím adenozinu, který je zde konstantně produkován. Při snížení portálního průtoku se adenozin méně odplavuje, takže může více lokálně působit a dilatovat arterioly. Další cesta regulace, sympatikus, zprostředkovává vazokonstrikci. Vazodilatační aferentace do jater se nevyskytuje.
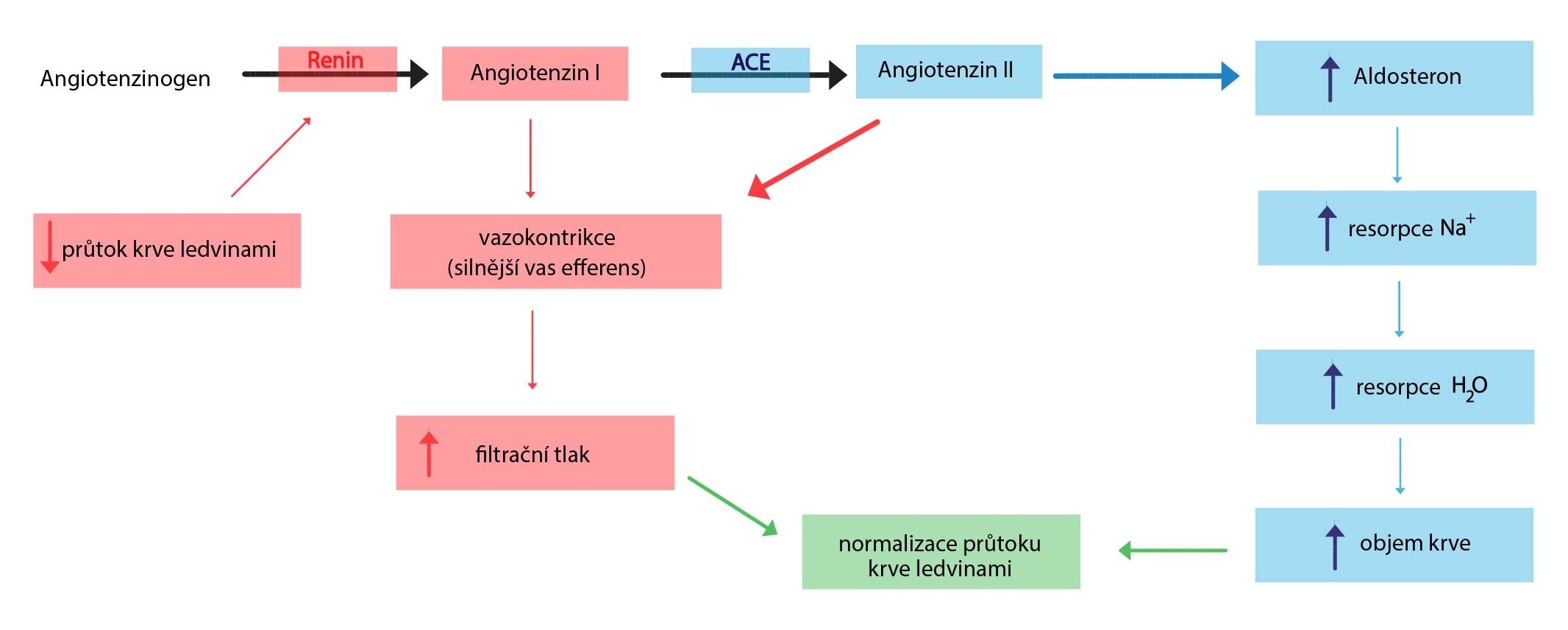
Průtok krve ledvinami
V klidu projde ledvinami asi 25 % minutového objemu. Většina krve (90 %) protéká kůrou ledvin. Každou ledvinu zásobuje renální arterie. Tato tepna odstupuje přímo z aorty, před vstupem do ledviny se dělí na 2-3 větve zásobující horní, střední a dolní část ledvin. Dále se tyto větve dělí až na interlobulární arterie, které pak dávají vznik aferentním arteriolám přivádějícím krev do glomerulů. Krev se sbírá do interlobulárních vén, jež ji odvádějí do venae arcuatae a z nich do interlobárních žil postupně se spojujících až do renální žíly.
Regulace průtoku krve ledvinami
Vazodilatace
Vazodilatační účinek má kallikrein-kininový systém, po jehož aktivaci nastává vazodilatace glomerulárních arteriol. Tento systém zároveň snižuje vazokonstrikční účinek angiotensinu II. Vazodilatačně dále působí prostaglandiny (E2 a I2) a endoteliální oxid dusnatý.
Vazokonstrikce
Sympatikus prostřednictvím noradrenalinu a jeho účinku na adrenergní receptory způsobuje jednak vazokonstrikci renálních arteriol (α1-receptory, méně α2), jednak zvýšení sekrece reninu (β1-receptory).
Nejsilnější vazokonstrikční látkou jsou endoteliální endoteliny. Vazokonstrikční účinek na vas efferens i vas afferens má renin-angiotensinový systém. Citlivost vas efferens k angiotensinu II je vyšší.
Průtok krve kosterním svalstvem
Kosterním svalstvem v klidu proteče asi 25 % klidového srdečního výdeje, ovšem při maximální fyzické práci stoupá tato hodnota až na 90 %.
Regulace průtoku krve kosterním svalstvem
Regulace průtoku probíhá pomocí sympatiku. Aktivace α1-adrenergních receptorů (noradrenalin) vyvolává vazokonstrikci, zvyšuje cévní odpor a snižuje průtok krve. Aktivace β2-adrenergních receptorů (adrenalin) vede k vazodilataci. Lokální metabolity mají vliv na vazodilataci, zejména laktát, adenozin a K+.
Průtok krve kůží
Kůží, důležitým nástrojem těla v řízení termoregulace, proteče asi 5 % klidového srdečního výdeje. Cévy v kůži inervuje jen sympatikus. Adrenalin i noradrenalin způsobují vazokonstrikci. Navzdory tomu při tělesné zátěži, tedy aktivaci sympatiku, jsou kožní cévy dilatovány. Tato odpověď je reflexem na zvýšení tělesné teploty v hypotalamu. Mezi lokální vazodilatační působky patří histamin a bradykinin, mezi vazokonstrikční patří serotonin a substance P.
_
Regulace krevního oběhu
Zásadní úkol, na kterém se podílejí všechny složky regulace krevního toku, zní: docílit dostatečného zásobení organismu krví při změnách zevních i vnitřních podmínek a změnách zátěže organismu. Nástrojem k dosažení tohoto cíle jsou změny průsvitu cév.
Lokální regulační mechanismy – autoregulace
Autoregulací rozumíme schopnost jednotlivých tkání regulovat místní krevní průtok. Podle mechanismu působení ji můžeme rozdělit na myogenní a metabolickou.
Myogenní autoregulace
Myogenní autoregulace vychází z hladké svaloviny cév samotných, její princip spočívá v reakci arteriol na zvýšené napětí cévní stěny. Buňky hladké svaloviny reagují na zvýšené napětí cévní stěny kontrakcí. To platí pro arterioly v ledvinách, srdci, GIT a mozku, nikoli však pro cévy kůže a plic. Vazokonstrikce vzniká aktivací protažením aktivovatelných Na+ a Ca2+ kanálů hladké svaloviny cévy – nastane depolarizace membrány a aktivace L-typu Ca2+ kanálů následovaná svalovou kontrakcí.
Metabolická regulace
Metabolická regulace probíhá prostřednictvím zvýšení koncentrace produktů metabolismu, jako například CO2, H+, ADP, AMP či adenozinu, a také zvýšením koncentrace K+ v intersticiu. Výsledkem je dilatace prekapilárních arteriol. Toto ale neplatí absolutně – adenozin nevyvolává vazodilataci v ledvinách a plicích a zvýšení pCO2 se vazodilatačně neuplatní v plicích, právě naopak. Snížení pO2 stimuluje tvorbu vazodilatačních látek – prostaglandinu I2 či NO. Lokální metabolická regulace se nejvíce uplatňuje v srdci a v mozku.
Lokální vazoaktivní látky vylučované endotelem
Endoteliální buňka reaguje na řadu fyziologických podnětů tvorbou látek, které ovlivňují svalovou buňku cévní stěny. Těmito stimuly se mohou stát protažení, střižné napětí vyvolané tokem krve, hladiny hormonů, látky uvolněné z krevních elementů (trombocyty, makrofágy). Odpovědí je syntéza lokálních vazoaktivních látek. Jedná se o parakrinní působení.
Oxid dusnatý (NO)
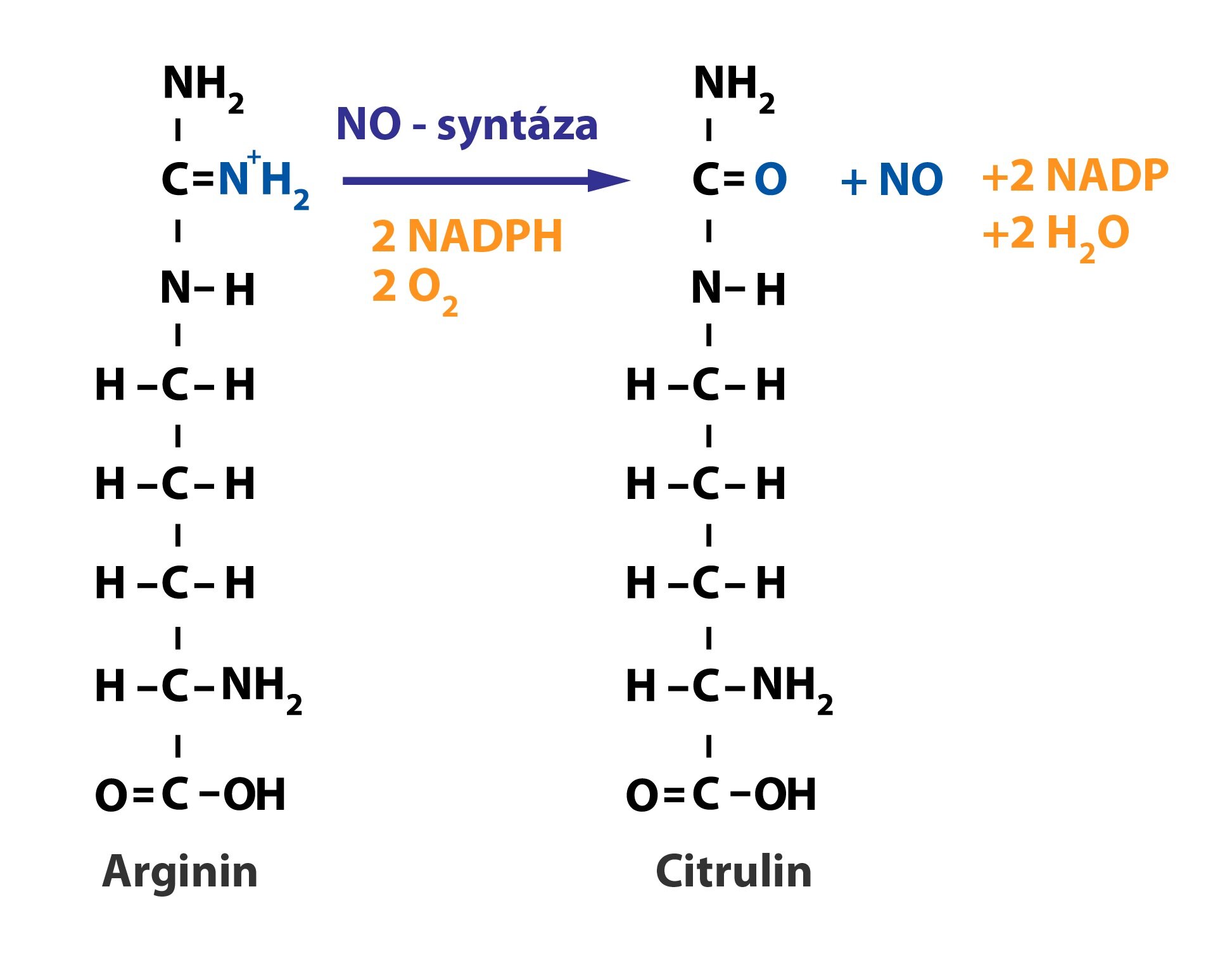
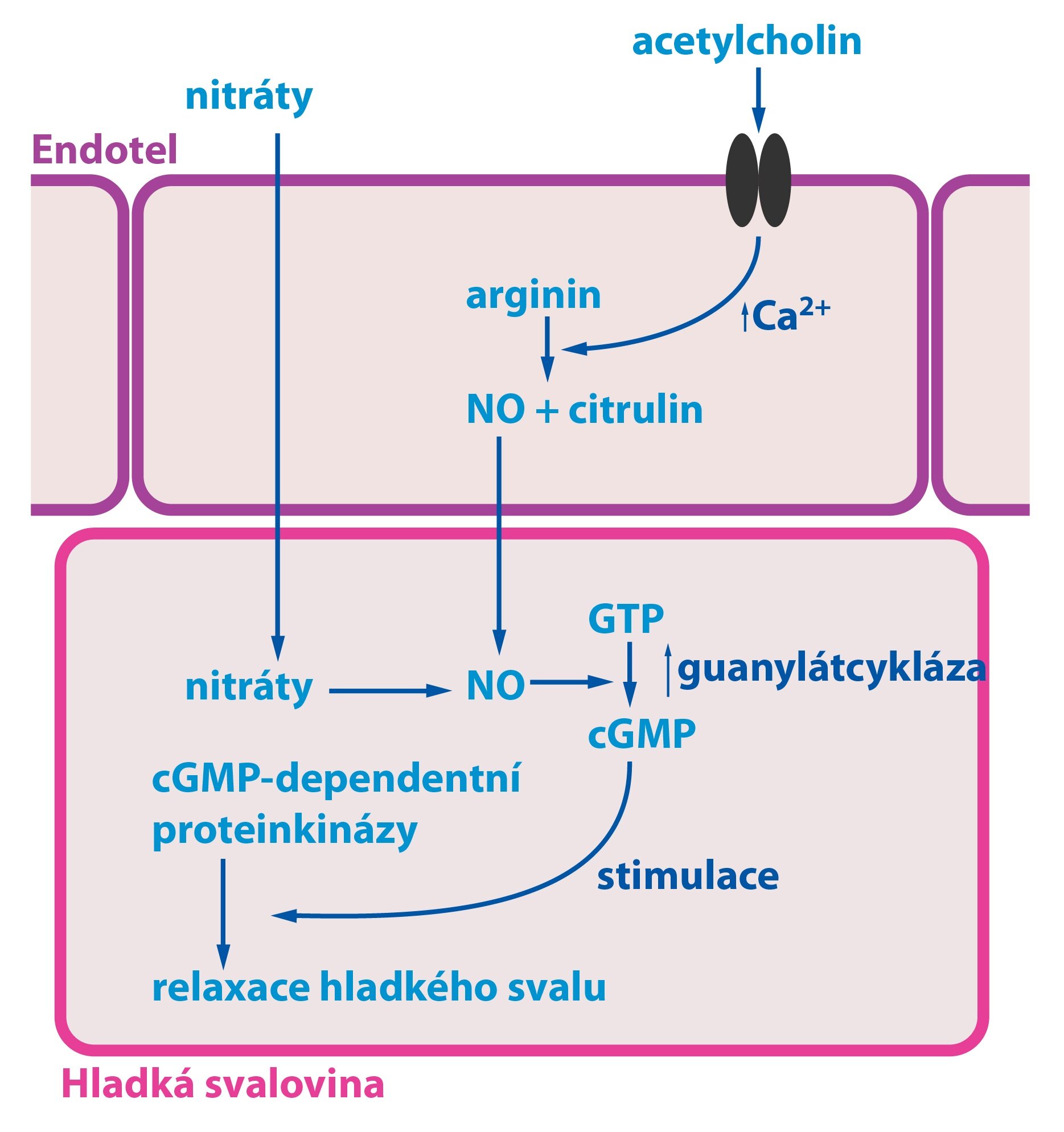
Oxid dusnatý je vazodilatační látka produkovaná endotelem. Jeho uvolnění může způsobit mnoho faktorů – acetylcholin (prostřednictvím M-receptorů), ATP, endotelin-1, histamin, ale i ANP. NO se tvoří z L-argininu reakcí katalyzovanou NO-syntázou.
Nyní si popíšeme mechanismus jeho působení. Po navázání acetylcholinu na receptor dojde k nastartování kaskády druhých poslů. V našem případě nastane zvýšení intracelulární koncentrace Ca2+ (skrze inositoltrifosfát, který se tvoří z fosfatidylinositol-4,5-bisfosfátu), jejímž důsledkem je aktivace endoteliální NO-syntázy. NO dále difunduje do buněk přilehlé hladké svaloviny, kde aktivuje guanylátcyklázu. Ta, obdobně jako adenylátcykláza, tvoří cGMP, jenž stimuluje cGMP-dependentní proteinkinázy. Výsledkem je relaxace buněk hladké svaloviny cévní stěny. Některé užívané léky (např. nitráty) dovedou vstoupit do buněk hladké svaloviny, kde se při jejich metabolismu uvolňuje NO – vedou tedy k vazodilataci. NO-syntáza se vyskytuje nejen v endotelových buňkách, ale i v některých buňkách imunitního systému (je jednou z cytotoxických látek) a v některých neuronech.
Endoteliny (ET-1, ET-2, ET-3)
Endoteliny, zejména ET-1, se vazbou na receptor ETA stávají jednou z nejsilnějších vazokonstrikčních látek. Uvolnění ET-1 je zvýšeno působením vazopresinu a angiotenzinu II. Jestliže se ET-1 naváže na receptor ETB, dojde k uvolnění NO, a tedy k vazodilataci. Podobně jako NO se endoteliny produkují nejen v endoteliálních buňkách – v jiných tkáních plní specifické funkce.
Eikosanoidy
Eikosanoidy, deriváty kyseliny arachidonové, mají také vazoaktivní efekt. Prostaglandin F2α a tromboxany A2 a B2 působí vazokonstrikčně, prostaglandin PGE2 a prostacyklin (PGI2) působí vazodilatačně.
Hormonální regulační mechanismy
Vazokonstrikční hormony
K vazokonstrikčním hormonům patří vazopresin, noradrenalin, adrenalin či angiotensin II.
Vazopresin ve vysokých dávkách vyvolává vazokonstrikci prostřednictvím receptoru V1A a této skutečnosti se využívá v intenzivní medicíně.
Adrenalin působí ve vysokých koncentracích přes α1-adrenoreceptory vazokonstrikčně, v nižších koncentracích naopak prostřednictvím β2-adrenoreceptorů vazodilatačně na cévy kosterních svalů, srdce a jater.
Noradrenalin prostřednictvím vazomotorických nervů a α1-adrenoreceptorů si počíná ve všech orgánech vazokonstrikčně. Podíl fyziologicky cirkulujícího hormonu noradrenalinu na vazokonstrikci je nižší (v porovnání se sympatoadrenální inervací), intravenózní podání noradrenalinu se nicméně využívá v resuscitační péči při závažných hypotenzích.
Angiotensin II je hormon s generalizovaným vazokonstrikčním účinkem – blíže o systému renin-angiotensin-aldosteron viz: Kapitola 11.
Serotonin uvolněný z trombocytů při zástavě krvácení také vyvolá vazokonstrikci.
Vazodilatační hormony
Do této skupiny patří kininy, histamin, natriuretické peptidy, VIP a částečně i adrenalin.
Bradykinin a kalidin vznikají pomocí enzymu kalikreinu z kininogenů krevní plazmy a cestou NO relaxují hladkou svalovinu cév. Histamin vyvolává prostřednictvím NO také vazodilataci. Všechny tři výše zmíněné látky také mění permeabilitu kapilár.
Natriuretické peptidy (ANP – atriální natriuretický peptid a BNP – mozkový natriuretický peptid, brain natriuretic peptide) jsou hormony tvořící se v srdečních síních a komorách. Oba dva vykazují významný vazodilatační účinek, zvyšují natriurézu (v distálních tubulech inhibují zpětnou resorpci Na+ – zvýšení ztrát Na+ močí) a diurézu a snižují aktivitu sympatiku. Podrobnější informace viz: Kapitola 7.
O vazodilatačním působení adrenalinu skrze β2-adrenoreceptory jsme již hovořili výše.
Nervové regulační mechanismy
Nervová regulace krevního průtoku probíhá převážně cestou sympatiku, s mediátorem noradrenalinem, prostřednictvím α1-adrenoreceptorů. Sympatikus působí vazokonstrikčně, proto míra konstrikce závisí na aktuálním tonu sympatiku – snížením tonu sympatiku nastane vazodilatace, zvýšením tonu naopak vazokonstrikce. Výjimku tvoří cévy genitálií a potních žláz, které vlivem parasympatiku (tedy díky acetylcholinu – cestou stimulace tvorby NO a inhibicí uvolňování noradrenalinu) aktivně dilatují.
Centra řízení krevního oběhu, umístěná v prodloužené míše a pontu, dostávají informace přímo z krevního oběhu. Tyto informace přicházejí z chemoreceptorů a baroreceptorů.
Chemoreceptory
Chemoreceptory lokalizované v glomus caroticum a oblouku aorty mají vysokou spotřebu O2 a velmi citlivě reagují na pokles pO2. Jsou také citlivé na pCO2 a pH, ale v porovnání se změnou pO2 je reflexní odpověď mnohem slabší. Díky aferentaci do kardiovaskulárních center v prodloužené míše se zvýší působení sympatiku na srdce a cévy, tedy dojde ke zvýšení krevního tlaku a dodávky O2.
Chemoreceptory v prodloužené míše nejcitlivěji reagují na změny parciálního tlaku CO2 a pH, méně citlivé jsou na změny pO2. Zvýšení pCO2 a pokles pH aktivuje chemoreceptory, které následně stimulují nárůst aktivity sympatiku i parasympatiku. Výsledkem je zvýšení kontraktility srdce a zvýšení periferního odporu. V srdci dochází díky převládajícímu vlivu parasympatiku ke snížení tepové frekvence. Intenzivní arteriolární vazokonstrikce přesměruje krev přednostně do mozkových cév.
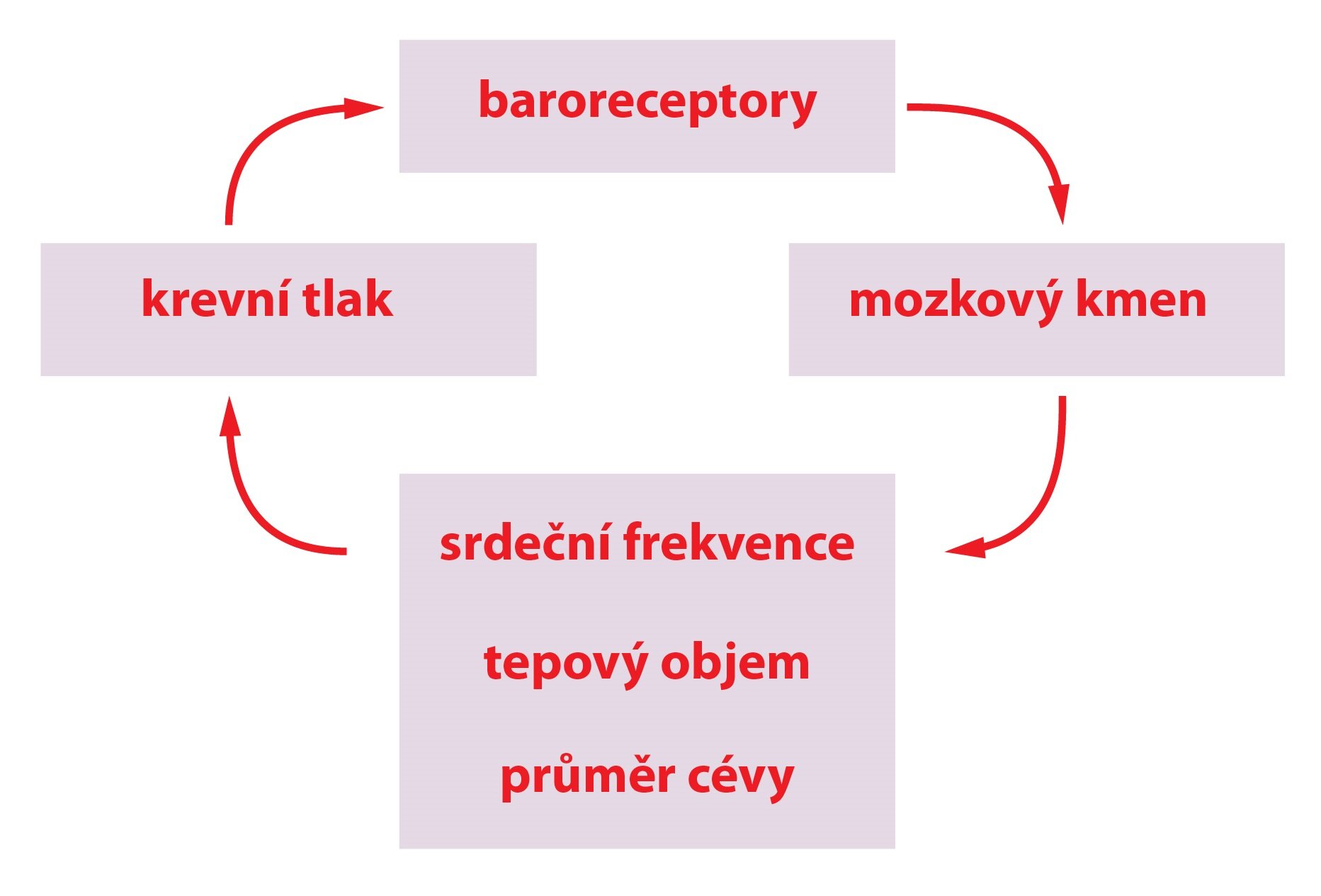
Baroreceptory
Baroreceptory jsou mechanoreceptory reagující na změnu tlaku. Maximum reakce u receptorů v karotickém sinu nastává při nižších tlacích (180 mmHg), receptory v oblouku aorty reagují při tlacích ještě vyšších. Při jejich aktivaci dochází k depolarizaci a vzniku akčního potenciálu v aferentních nervech, přičemž vzestup krevního tlaku zvyšuje jejich frekvenci. Díky aktivaci mozkového centra dojde k inhibici sympatiku a aktivaci parasympatiku. Baroreceptorový reflex (baroreflex) je tedy mechanismus sloužící k akutní regulaci krevního tlaku. Jedná se o autonomní reflex zprostředkovaný baroreceptory a autonomním nervovým systémem.
V mozkovém centru řízení oběhu se nachází také presorická oblast, odkud jsou konstantně vysílány impulzy do sympatiku k srdci a cévám pro udržení klidového cévního tonu.
_
Mikrocirkulace
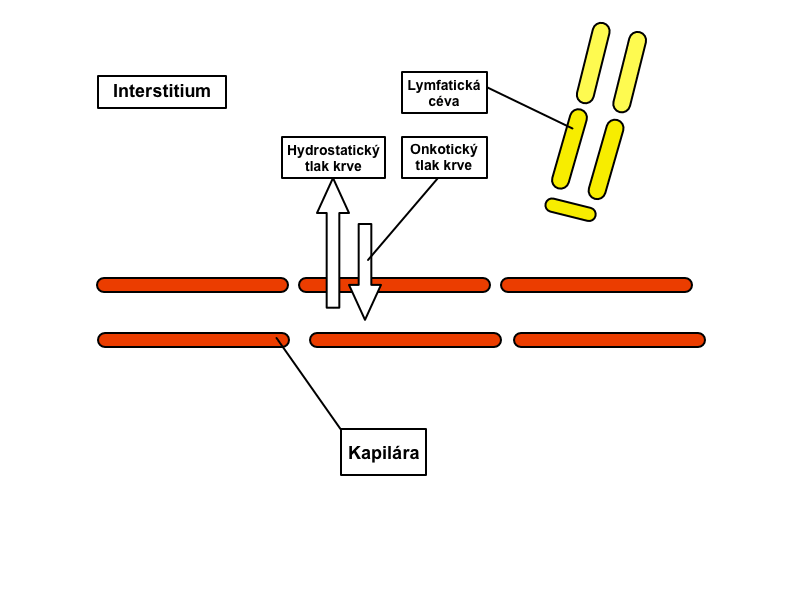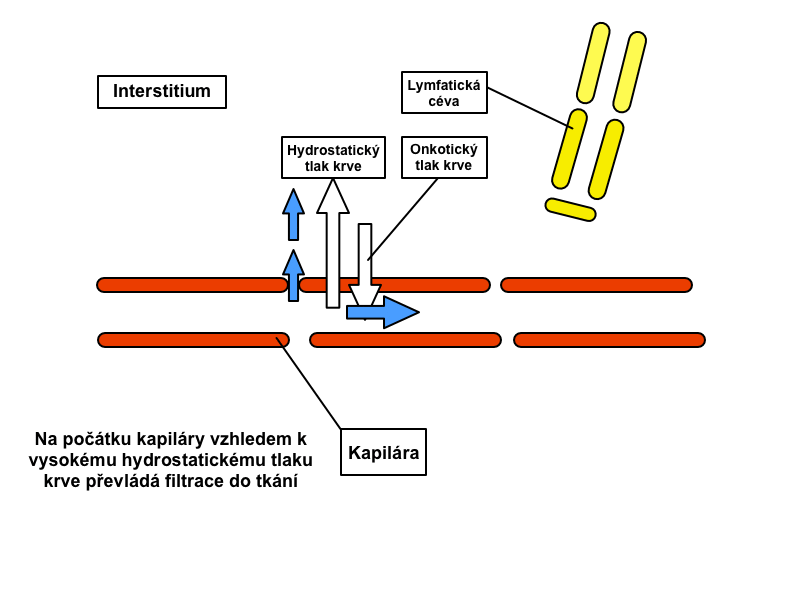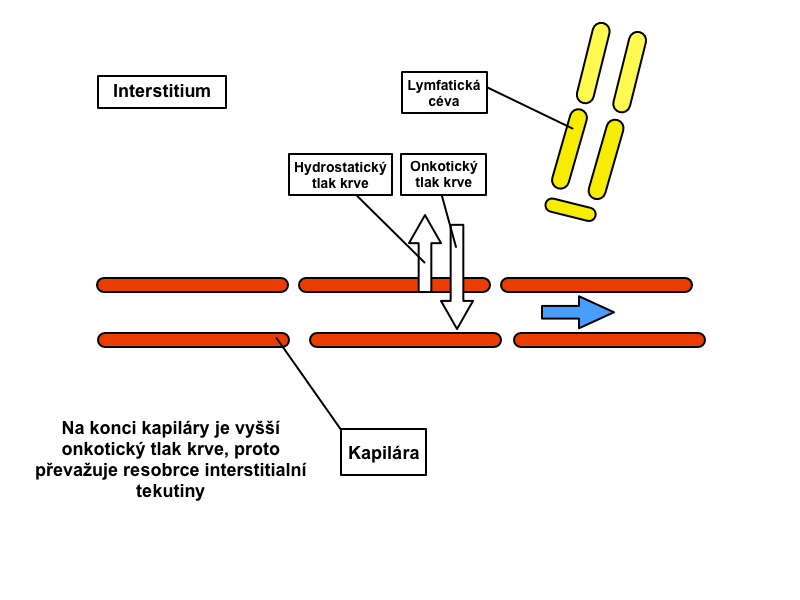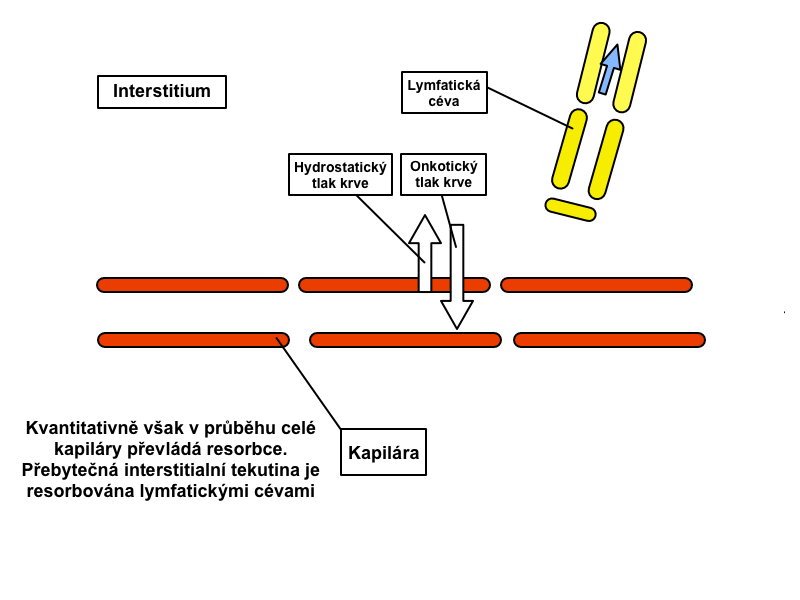
Kapiláry se podílejí na celkovém odporu krevního řečiště asi z 1/3. Tyto cévy jsou uzpůsobeny k výměně látek a tekutin, která je možná díky mimořádně velkému celkovému povrchu kapilár a jejich tenkým stěnám. Ty si můžeme představit jako tenké membrány tvořené endoteliálními buňkami, jejichž vnější obal tvoří bazální membrána. V některých případech se v kapilárách vyskytují i póry, jejichž rozměry jsou menší než velikost albuminu. Látky procházejí přes kapilární stěnu několika cestami – skrze spojení mezi endoteliálními buňkami, póry, vezikulárním transportem, difuzí nebo filtrací. Hlavním faktorem určujícím průtok krve kapilárou je saturace krve kyslíkem, podle níž je ovládán tonus prekapilárního sfinkteru.
Za jeden den se stěnou kapilár profiltruje až 20 l tekutiny. Resorpcí se do krevního řečiště nevrací celý tento objem, ale asi jen 18 litrů tekutiny. Zbytek se do krevního řečiště vrací prostřednictvím lymfatické cirkulace. Hlavním transportním mechanismem v kapilárách je difuze přes kapilární stěnu. Kyslík a oxid uhličitý mohou přecházet přímo přes stěnu kapiláry, zatímco ionty, glukóza a voda procházejí póry v kapilární stěně.
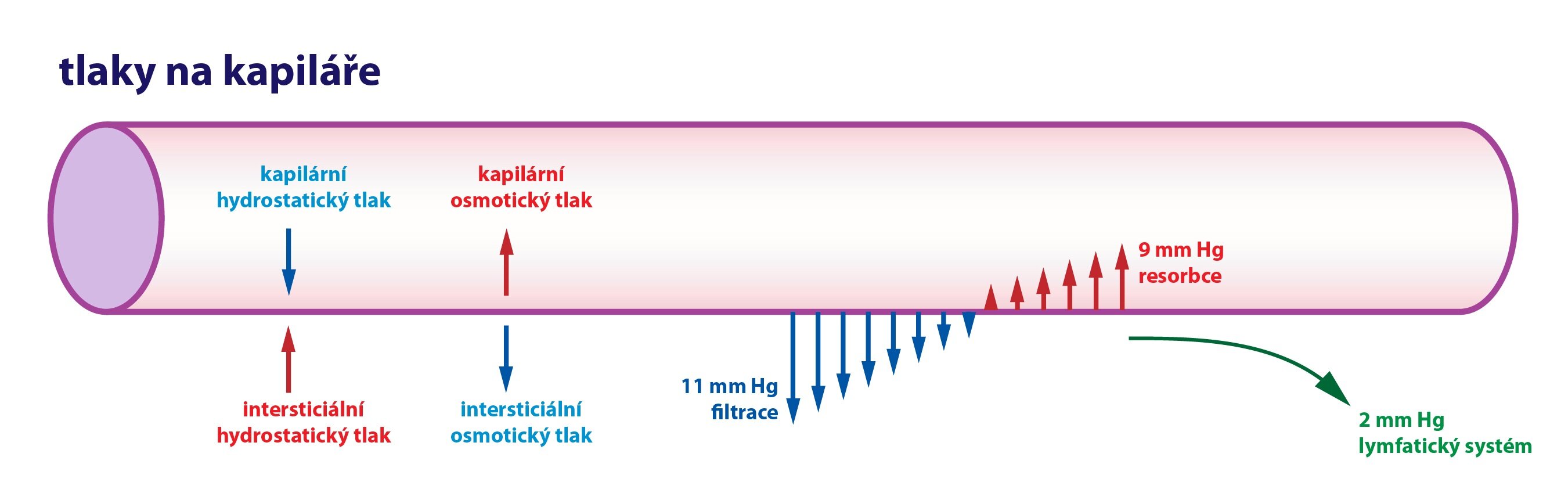
Pohyb přes stěnu kapiláry určují čtyři tzv. Starlingovy síly. Jedná se o:
1) Kapilární hydrostatický tlak – působí směrem ven z kapiláry
2) Intersticiální hydrostatický tlak – jeho velikost závisí na orgánu – je pozitivní v ledvinách, játrech a mozku, negativní v kůži
3) Kapilární koloidně-osmotický tlak – působí směrem do kapiláry, rovná se onkotickému tlaku
4) Intersticiální koloidně-osmotický tlak – působí směrem z kapiláry
Rychlost filtrace v jednotlivých úsecích kapilár je různá a závisí právě na rozdílu Starlingových sil. Rozdíl kapilárního hydrostatického tlaku a intersticiálního hydrostatického tlaku určuje hydrostatický tlakový gradient. Rozdíl koloidně-osmotického tlaku v plazmě a osmotického tlaku intersticiální tekutiny definuje osmotický tlakový gradient, který ve valné většině směřuje dovnitř kapiláry.
Na arteriálním konci kapiláry míří výsledná síla ven z kapiláry (filtrační tlak převyšuje onkotický tlak), na venózním konci výsledná síla naopak směřuje dovnitř kapiláry (onkotický tlak převyšuje filtrační tlak). Navzdory nižšímu výslednému tlaku na venózním konci se až 90 % tekutiny vrací zpátky do kapiláry díky vyšší permeabilitě v tomto místě.
V různých kapilárách se ale rovnováha Starlingových sil může významně odchylovat od tohoto obecného schématu. Například v ledvinách přestupuje tekutina směrem ven v celé délce kapiláry, ve střevě je tomu právě naopak.
_
Lymfatická cirkulace
Denně se v kapilárách profiltruje asi 20 litrů tekutiny, zpátky do krevního oběhu se jí vrací asi 90 %, zbylé dva litry odvádí systém lymfatických cév. Lymfa obsahuje především bílkoviny (včetně srážlivých faktorů), tuky, vstřebávané ze střev do lymfy, a lymfocyty, jež lymfatickými cestami vstupují do oběhu. Proudění lymfy zabezpečují: pohyb kosterních svalů, chlopně lymfatických cév, negativní nitrohrudní tlak při nádechu, nasávací efekt proudu krve v žilách, do kterých ústí lymfatické řečiště, a rytmické kontrakce stěn velkých lymfatických duktů (frekvence kontrakcí stoupá úměrně k objemu lymfy).
_
Žilní návrat
Krev je odváděna z orgánů do srdce žilním systémem. Žilní návrat definujeme jako objem krve, která se navrátí do pravé síně za jednu minutu. Za fyziologických okolností se žilní návrat rovná srdečnímu výdeji.
Na žilním návratu se podílí:
1) Zbylý krevní tlak – pozůstatky tlaku po přechodu krve kapilárami
2) Negativní tlak srdce – tlak vznikající v pravé síni při systole – srdce „nasává“ krev do síně
3) Svalová pumpa – kontrakce kosterních svalů stlačujících žíly
4) Intratorakální podtlak – při vdechu se zvýší podtlak v hrudní dutině. Ten vede k rozšíření žil v hrudníku a tím k nasávání krve do velkých žil
5) Přetlak v břišní dutině – stejně jako předchozí, vzniká při vdechu a jsou s intratorakálním podtlakem vzájemně propojené
6) Pohybu krve nesprávným směrem zabraňují žilní chlopně
Při změně polohy z lehu do stoje jsou cévy na nohou zatíženy hydrostatickým tlakem krevního sloupce, což vede k rozšíření žil. Tím se deponuje určité množství krve v těchto žilách a o tento objem (cca 0,4 l krve) se sníží centrální krevní objem. Tak klesá návrat krve do levého srdce, což má za následek snížení tepového objemu a minutového srdečního výdeje. Tato situace by mohla vyústit v ortostatický kolaps. Snížení krevního tlaku ale vyvolá snížení aktivity baroreceptorů v sinus caroticus a arcus aortae, což vede k inhibici parasympatiku a ke snížení inhibice sympatiku. To s sebou přináší zvýšení periferního cévního odporu, zvýšení srdeční frekvence a kontraktility (ortostatický reflex).
Centrální žilní tlak (CVP), resp. střední tlak v horní duté žíle před jejím vyústěním do pravé síně (shodný s tlakem v pravé síni) odráží tlak v pravé komoře na konci diastoly. Závisí zejména na objemu krve a jeho normální hodnota je 0-9 mmHg. Zvýšení CVP může signalizovat srdeční insuficienci.
_
Fetální krevní oběh
Funkce placenty v těhotenství je pro plod zásadní. Placenta zajišťuje příjem živin i kyslíku a odstranění nežádoucích metabolitů a CO2.
Okysličená krev z placenty teče pupečníkovou žílou z menší části do jater a z větší části cestou ductus venosus do dolní duté žíly, kde se smísí s venózní krví z dolní poloviny těla. Dolní dutá žíla ústí do pravé síně, odkud krev směřuje přes foramen ovale do levé síně a dále do levé komory a aorty. V pravé síni dochází jen k částečnému mísení krve z horní poloviny těla s krví z dolní poloviny těla. Krev z horní poloviny těla totiž putuje z horní duté žíly přes pravou síň do pravé komory a odtud do plicnice, ze které cestou ductus arteriosus přitéká do aorty, ale až za odstupem tepen pro horní polovinu těla. Tato smíšená krev dále pokračuje zejména do pupečníkových tepen, ale také do dolní poloviny těla.
Po porodu je spojení novorozence s placentou přerušeno, v krvi stoupá parciální tlak oxidu uhličitého a stimuluje tak první inspirační pohyb. Ten vyvolá podtlak v hrudní dutině, což způsobí odsátí krve z pupečníkové žíly a placenty. Díky rozvinutí plic se také sníží odpor v plicním řečišti. Tím se změní směr toku krve v ductus arteriosus – část arteriální krve tedy teče i do plic. To má za následek zvýšení tlaku v levé síni odpovědného za uzavření foramen ovale. Ductus arteriosus, ductus venosus i foramen ovale po porodu postupně zanikají (maximálně do dvou týdnů po porodu).
V případě, že zůstanou fetální arteriovenózní spojky otevřeny delší dobu po porodu, vznikají oběhové zkraty, které mohou vyústit až v srdeční insuficienci.
Autoři podkapitoly: Peter Ivák, Josef Kroupa, Patrik Maďa a Josef Fontana