Náplň podkapitoly:
1. Úvod do acidobazické rovnováhy
2. Systémy zodpovídající za udržování acidobazické rovnováhy
3. Laboratorní vyšetření stavu acidobazické rovnováhy
4. Základní poruchy acidobazické rovnováhy a jejich kompenzace
_
Úvod do acidobazické rovnováhy
Udržování stálosti vnitřního prostředí patří mezi vitální funkce stejně jako např. krevní oběh nebo dýchání. Jak jsme se již zmínili v Podkapitole 7/6 udržení stálého pH – izohydrie patří mezi základní komponenty vnitřního prostředí (společně se stálým objemem – izovolumií, stálou tonicitou – izoosmolaritou a stálým iontovým složením – izoionií).
Koncentrace protonů a pH
Izoionie znamená udržování stálé hladiny aniontů a kationtů v krevní plazmě. Izohydrie představuje udržování konstantní hodnoty koncentrace H+. K vyjádření koncentrace H+ využíváme veličinu pH:
pH = – log c(H+)
Koncentrace H+ v plazmě a v extracelulárním prostoru savců je udržována v úzkém fyziologickém rozmezí. Pro arteriální krev se fyziologická koncentrace H+ pohybuje okolo 40 nmol/l (srovnejte tuto hodnotu s hodnotami ostatních iontů v plazmě – např. [Na+] = 140 mmol/l či [HCO3–] = 25 mmol/l). Pokud dosadíme tuto hodnotu do rovnice pro pH, získáme fyziologickou hodnotu pH arteriální krve:
pH = -log 40 x 10-9 mol/l
pH = 7,4
Fyziologické rozmezí pH arteriální krve činí 7,36-7,44.
Hodnotu pH arteriální krve nad 7,44 nazýváme alkalemie, pH arteriální krve pod 7,36 acidemie. Větší odchylky pH vedou k mnoha závažným důsledkům – ke změnám struktury proteinů (enzymů), permeability membrán, distribuce elektrolytů. Hodnoty pH arteriální krve ↓ 6,8 a ↑ 7,8 jsou neslučitelné se životem.
Dosud uvedené hodnoty platí pro arteriální krev, v dalších tělesných kompartmentech je koncentrace H+ a tudíž i pH odlišná. Například pH intracelulární tekutiny je více variabilní a nižší – činí ~ 7,0 ([H+] = 100 nmol/l). Pokud porovnáme hodnotu intracelulárního pH a pH arteriální krve, zjistíme rozdíl přibližně 0,4. Toto odpovídá 2,5-násobnému rozdílu v koncentraci H+. Právě po tomto koncentračním gradientu odcházejí H+ z buněk do krve. Proto nepřekvapí, že pH venózní krve a intersticiální tekutiny dosahuje nižších hodnot než pH arteriální krve – činí přibližně 7,35.
Kyseliny a zásady v organismu
Kyselinu definujeme jako látku odštěpující H+ (Arrhenius) nebo jako donor H+ (Brönsted). Zásadou je naopak látka odštěpující OH– (Arrhenius) nebo akceptor H+ (Brönsted).
Zdrojem kyselin v organismu je převážně metabolismus, zásady se do těla dostávají hlavně potravou. Osud kyselin i zásad v těle může být dvojí. Buď podstoupí metabolickou přeměnu (např. přeměna laktátu na glukózu glukoneogenezí či spálení laktátu v srdci), nebo jsou z organismu vyloučeny.
Z hlediska ABR můžeme rozlišit tři druhy reakcí – protonproduktivní, protonkonsumpční a protonneutrální. Zde uvádíme některé jejich zástupce:
1) Protonproduktivní reakce
a) Anaerobní glykolýza ve svalech a v erytrocytech
Glukóza → 2 CH3CHOH COO– + 2 H+
b) Ketogeneze – tvorba ketolátek
Mastné kyseliny → ketolátky + n H+
c) Lipolýza
TAG → 3 FA + glycerol + 3 H+
d) Syntéza urey v játrech
CO2 + 2 NH+4 → urea + H2O + 2 H+
2) Protonkonsumpční reakce
a) Glukoneogeneze
2 laktát + 2 H+ → Glc
b) Oxidace neutrálních a dikarboxylových aminokyselin
3) Protonneutrální reakce
a) Kompletní oxidace glukózy
b) Lipogeneze z glukózy
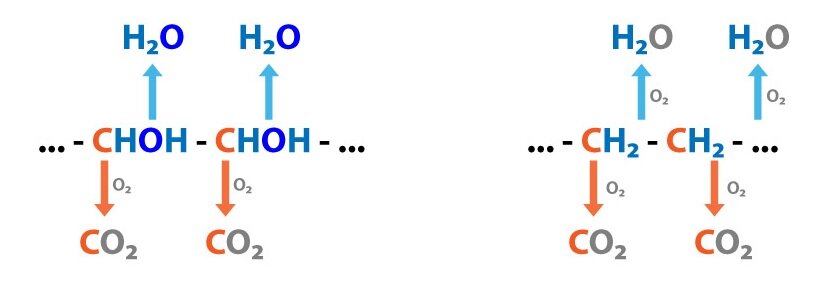
Lidský organismus (ve zdraví i nemoci) denně vyprodukuje velké množství kyselin, jež jsou zdrojem protonů. Zjednodušeně můžeme říci, že metabolismus okyseluje:
1) Kompletní oxidace látek
Uhlíkatý skelet → CO2 + H2O → HCO3– + H+
2) Nekompletní oxidace
Sacharidy → glukóza → pyruvát, laktát + H+
Triacylglyceroly → mastné kyseliny, ketolátky + H+
Fosfolipidy → fosfát + H+
Proteiny → AK → sulfát, močovina + H+
Pro potřebu této podkapitoly můžeme kyseliny vznikající v organismu rozdělit do dvou velkých skupin – na kyseliny těkavé (respirační, vydýchatelné) a netěkavé (metabolické).
Hlavní těkavou kyselinou je kyselina uhličitá. Ta vzniká z oxidu uhličitého (kyselinotvorný oxid) a vody. Za den vyprodukuje náš metabolismus mezi 15 000-20 000 mmol CO2 (a tudíž i kyseliny uhličité), který je však velmi efektivně eliminován z těla respiračním systémem. Proto nazýváme kyselinu uhličitou těkavou kyselinou.
Netěkavé kyseliny můžeme rozdělit na organické a anorganické. Celkově jich za den vzniká přibližně 1 mmol / kg tělesné hmotnosti. Následně jsou buď zmetabolizovány či vyloučeny (hlavně ledvinami).
Mezi organické netěkavé kyseliny, jež jsou kontinuálně tvořeny jako produkty metabolismu (neúplnou oxidací TAG, sacharidů i bílkovin) řadíme například kyselinu mléčnou, mastné kyseliny či ketolátky (kyselina acetoctová a kyselina β-hydroxymáselná). Za normálních podmínek jsou tyto kyseliny následně kompletně metabolizovány na CO2 a H2O, takže nemají vliv na celkovou rovnováhu protonů.
Mezi anorganické netěkavé kyseliny patří H2SO4 (vzniká oxidací sulfhydrylových skupin – např. z aminokyselin obsahujících síru cysteinu a methioninu) či H3PO4 (vzniká hydrolýzou fosfoproteinů, fosfolipidů či nukleových kyselin). Tyto kyseliny se převážně exkretují močí.
Z uvedeného je tedy patrné, že produkce ATP je spřažena s produkcí H+. Lidské tělo je z evoluce vybaveno zvládat kyselou nálož.
_
Systémy zodpovídající za udržování acidobazické rovnováhy
Udržování konstantního pH se v lidském těle účastní více systémů. Zde uvádíme jejich přehled v pořadí, v jakém se uplatňují:
1) Chemické pufrační systémy
Pufry řeší především výkyvy pH při běžném metabolismu – krátkodobá, akutní regulace – reagují okamžitě.
2) Respirační systém
Respirační systém umožňuje regulaci (eliminaci/zadržení) oxidu uhličitého (pCO2). Respirační centrum v mozkovém kmeni (prodloužené míše) reaguje za 1-3 min.
3) Ledviny
Ledviny mají komplexní roli v udržování ABR. Jejich zásah vyžaduje hodiny až dny.
Na udržování pH krve se podílejí také:
4) Játra
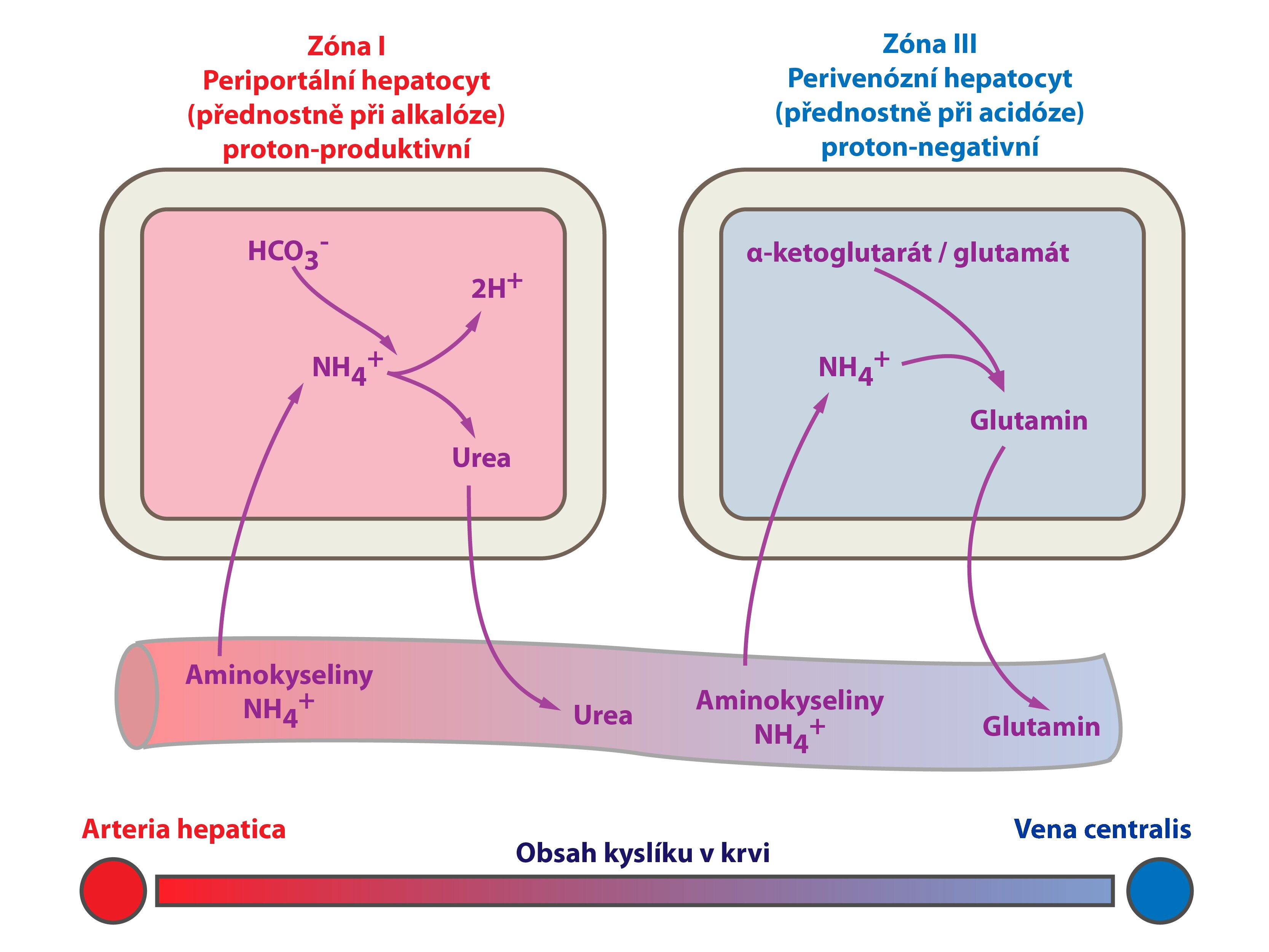
Játra jako klíčový orgán energetického metabolismu mají významný vliv na ABR. Jako příklad můžeme uvést rozdílný osud amoniaku podle stavu ABR – játra z něj mohou nasyntetizovat buď močovinu nebo glutamin:
a) NH4+ → močovina + 2 H+ → okyselení organismu
CO2 + 2 NH4+ → CO(NH2)2 + 2 H+ + H2O
H+ + HCO3– → H2O + CO2 (spotřeba HCO3–)
b) NH4+ → syntéza glutaminu → netvoří se H+, glutamin je vychytáván ledvinami, kde umožňuje vylučování H+ ve formě NH4+
5) Myokard
Myokard ovlivňuje ABR například skrze oxidaci laktátu či ketolátek.
Pufrační systémy
Pufry jsou látky mající schopnost uvolňovat i vázat H+. Dokáží vyrovnávat krátkodobé a akutní změny v acidobazickém metabolismu a tím udržovat stálou hodnotu pH. Hodnota pH pufru závisí na logaritmu poměru zásady ke kyselině – tzv. Henderson-Hasselbalchova rovnice:
pH = pK + log [konjugovaná baze] / [kyselina]
Její podoba pro bikarbonátový pufr (HCO3–/CO2):
pH = pKH2CO3 + log ([HCO3–] / [H2CO3])
pH = pKH2CO3 + log ([HCO3–] / α x pCO2)
α = koeficient rozpustnosti oxidu uhličitého – přepočet parciálního tlaku CO2 na molární koncentraci v mmol/l (α = 0,226 je-li pCO2 v kPa, α = 0,03 je-li pCO2 v Torr)
Pufry nejlépe fungují při pH = pK ± 1.
Složení pufračních systémů (poměr koncentrací báze / kyselina) lze vypočítat ze vztahu mezi hodnotami pH a pK. Například poměr složek bikarbonátového pufru (pKH2CO3 = 6,1) činí při fyziologickém pH (pH = 7,4) přibližně 20 / 1:
pH = pKH2CO3 + log ([HCO3–] / [H2CO3])
7,4 = 6,1 + log ([HCO3–] / [H2CO3])
1,3 = log ([HCO3–] / [H2CO3])
[HCO3–] / CO2 ≈ 20 / 1
V lidském těle se nachází mnoho pufračních systémů. Zde uvádíme jen ty, které hrají významnou roli – bikarbonátový pufr (HCO3–/CO2), hemoglobinový pufr (v erytrocytech), fosfátový pufr, proteiny a amoniakální pufr. Jejich lokalizaci a význam zachycuje následující tabulka.
Hlavní pufrační systémy organismu dle jednotlivých tělesných kompartmentů
|
Lokalizace |
Pufry |
Komentář |
|
ISF |
Bikarbonátový | Pufruje metabolické kyseliny |
| Fosfátový | Nízká koncentrace – malý význam | |
| Proteiny | Nízká koncentrace – malý význam | |
|
Krev |
Bikarbonátový | Pufruje metabolické kyseliny |
| Hemoglobin | Pufruje CO2 (vznik kyseliny uhličité) | |
| Plazmatické proteiny | Minoritní | |
| Fosfátový | Nízká koncentrace – malý význam | |
|
ICF |
Proteiny | Významný pufr |
| Fosfátový | Významný pufr | |
|
Moč |
Fosfátový | Odpovídá za většinu tzv. titrovatelné acidity moči |
| Amoniakální | Významný: odstraňování aminodusíku i protonů; kation! |
_
Následující tabulka zachycuje pufrační kapacitu jednotlivých pufrů krve.
Pufry krve a jejich pufrační kapacita
|
Pufr |
Plazma |
Erytrocyty |
Celkem |
| HCO3– / CO2 |
35 % |
18 % |
53 % |
| Hb / Hb-H+ |
– |
35 % |
35 % |
| Plazmatické proteiny |
7 % |
– |
7 % |
| Anorganický fosfát |
1 % |
1 % |
2 % |
| Organický fosfát |
– |
3 % |
3 % |
|
43 % |
57 % |
100 % |
_
Jakýkoliv drift v pH vyvolá odpověď ve všech pufračních systémech, všechny tělesné pufry jsou totiž v rovnováze. Změna koncentrace kteréhokoli člena jakéhokoli pufračního páru se odrazí na pH a tím i na složení všech tělesných pufrů.
Bikarbonátový pufr (HCO3–/CO2)
Bikarbonátový pufr je nejdůležitější pufrační systém v krevní plazmě (obecně v ECT) skládající se ze slabé H2CO3 (pK1 = 6,1) a její konjugované báze HCO3– (bikarbonát).
Koncentrace HCO3– je měřena v plazmě v mmol/l (průměrná hodnota je 24 mmol/l). Koncentrace H2CO3 je špatně měřitelná, protože kyselina uhličitá je velmi nestálá sloučenina v plazmě. Koncentrace H2CO3 může být vyjádřena pomocí parciálního tlaku CO2 (pCO2), neb koncentrace plynu je přímo úměrná jeho parciálnímu tlaku. pCO2 je dobře měřitelný (v kPa či v mmHg). Jeho normální hodnota v tepenné krvi se pohybuje kolem 5,3 kPa – 40 mmHg. pCO2 vynásobený koeficientem rozpustnosti α dává výslednou molární koncentraci rozpuštěného CO2 (α = 0,226 je-li pCO2 v kPa, α = 0,03 je-li pCO2 v Torr). Převodní vztah mezi mmHg a Pa zní 1 Pa = 0,0075 mmHg. Při fyziologickém pH plazmy jsou HCO3– a CO2 přítomny v poměru 20 / 1.
Podoba Henderson-Hasselbalchovy rovnice pro HCO3–/CO2 systém:
pH = pK + log [konjugovaná baze] / [kyselina]
pH = pK + log ([HCO3–] / [H2CO3])
pH = 6,1 + log ([HCO3–] / pCO2 x α)
pH = 6,1 + log (24 / 40 x 0,03)
pH = 6,1 + 1,3
pH = 7,4
Systém HCO3–/CO2 je tzv. otevřený pufrační systém, protože tělo může aktivně měnit jeho obě složky. pCO2 lze regulovat pomocí respiračního systému (úrovní ventilace – frekvence a hloubka dýchání) a vylučování / tvorba HCO3– je ovlivňována ledvinami a játry. Účinnost pufru je mnohem větší, než by se dalo předpokládat z pKa = 6,1. Jeho význam je právě tak velký, protože tělo umí aktivně měnit obě jeho složky.
Pomocí stavu bikarbonátového pufru klinicky posuzujeme stav ABR u pacienta (měření pH, [HCO3–] a pCO2).
Proteiny jako pufry
Tělesné proteiny (plazmatické a IC) jsou nejhojnějším a nejmocnějším pufrovacím systémem těla. Některé aminokyseliny mají jako postranní řetězce kyselé či zásadité skupiny (postranní řetězce His, Lys, Arg, Glu, Asp). Z krevních proteinů je nejvýznamnější hemoglobin – 35 % pufrační kapacity krve, zbylé bílkoviny představují jen 7 % pufrační kapacity krve.
Role erytrocytů a hemoglobinu v ABR
V pracující tkáni dochází k intenzivní výměně krevních plynů. CO2 se difuzí dostává do erytrocytů. Tam se buď váže na Hb, nebo reaguje s vodou za katalýzy enzymem karboanhydráza (CA, karbonátdehydratáza):
CO2 + H2O ↔ H2CO3
Vzniklá kyselina uhličitá disociuje:
H2CO3 ↔ HCO3– + H+
Více než 70 % vzniklého HCO3– opouští erytrocyty přes speciální HCO3–/Cl– antiport – výměnou za ionty Cl– v procesu nazývaném Hamburgerův efekt (chloridový posun – chloride shift). H+ vznikající disociací kyseliny uhličité je pufrován hemoglobinem. Deoxygenovaný hemoglobin představuje silnější bázi než oxygenovaný Hb, a proto je schopný vychytávat H+ kationty lépe.
V plicích se HCO3– mění za katalýzy CA zpět na CO2, který je vydýchán. H+ se do reakce dodává svým uvolnění z hemoglobinového pufru poté, co se vazbou O2 na hemoglobin afinita hemoglobinu k H+ snižuje. Sled reakcí je tedy v plicích opačný než v pracujících tkáních, zjednodušeně:
HCO3– + H+ → CO2 + H2O
Další informace k tomuto tématu jsou obsaženy v Podkapitole 6/4.
Fosfátový pufr
Fosfátový pufr je tvořen anorganickým a organicky vázaným fosfátem (estery organických látek – meziprodukty metabolismu, např. AMP, ADP, ATP). Jedná se o významný intracelulární pufr a pufr moči, v krvi představuje jen 5 % její pufrační kapacity.
Pufry moči
Nejdůležitější pufry moči jsou amoniakální (NH3 / NH4+) a fosfátový pufr. Denně se vylučuje 30-50 mmol NH4+ a jeho exkrece se významně reguluje během poruch ABR. Vylučování aminodusíku může být silně redukováno nebo naopak velmi zvýšeno – při acidóze se zvyšuje aktivita glutaminázy v ledvinách. Glutamináza štěpí glutamin na glutamát a NH3, který je následně vyloučen do moče. Celému procesu napomáhají játra, která při acidóze produkují méně urey, a naopak více glutaminu. Fosfátů se vylučuje denně ~ 20 mmol (tzv. titrovatelná acidita moči). Fyziologické pH moči se pohybuje mezi 4,4-8,0.
Úloha respiračního systému v udržování ABR
Respirační systém denně vylučuje asi 15-20 mol CO2. Vzhledem k dobré rozpustnosti CO2 je jeho koncentrace stejná v alveolech i v arteriální krvi (pCO2 = 5,33 kPa – 40 mmHg). Ve smíšené venózní krvi je pCO2 cca 6,13 kPa (46 mmHg).
pCO2 závisí na úrovni minutové ventilace (počet dechů x dechový objem):
1) Zvýšení ventilace → pokles pCO2 → zvýšení pH (alkalizace)
2) Snížení ventilace → nárůst pCO2 → snížení pH (acidifikace)
Při zvýšení pCO2 dochází k aktivaci dechového centra, jehož vnímavost však klesá při hodnotách pCO2 nad 8 kPa. Jediným stimulem se pak stává snížený pO2.
Úloha ledvin v udržování ABR
Chemické pufry mohou zadržet nárůst kyselin či bazí, ale nedovedou je eliminovat z těla. Respirační systém umí eliminovat těkavou kyselinu uhličitou vyloučením CO2 (či ho naopak zadržet). Jen ledviny dovedou tělo efektivně očistit od netěkavých (metabolických) kyselin (kyselina fosforečná, sírová, močová, …) a tím vzdorovat metabolické acidóze. Navíc pouze ledviny se umí účinně vypořádat s alkalózou (jinak by nám zbylo jen nedýchat).
Ledviny zasahují do ABR tím, že:
1) Resorbují, vylučují či tvoří nový bikarbonát
2) Vylučují či tvoří nový H+
Přitom je nutno si uvědomit, že ztráta bikarbonátu je to samé jako přijmutí H+ a vytvoření bikarbonátu je to samé jako ztráta H+. Jak si ukážeme dále, jsou tyto procesy propojené (např. vylučování H+ v proximálním tubulu je spojeno s tamní resorpcí HCO3– či vylučování H+ v distálním tubulu je spojeno s tamní produkcí nového HCO3–). Vyšší [HCO3–] zvyšuje pH, zatímco nižší [HCO3–] pH snižuje.
Nyní si podrobně probereme tyto základní procesy: resorbci bikarbonátu, tvorbu nového bikarbonátu, tvorbu amonného iontu, vylučování protonů ledvinami a sekreci bikarbonátu.
Resorpce bikarbonátu
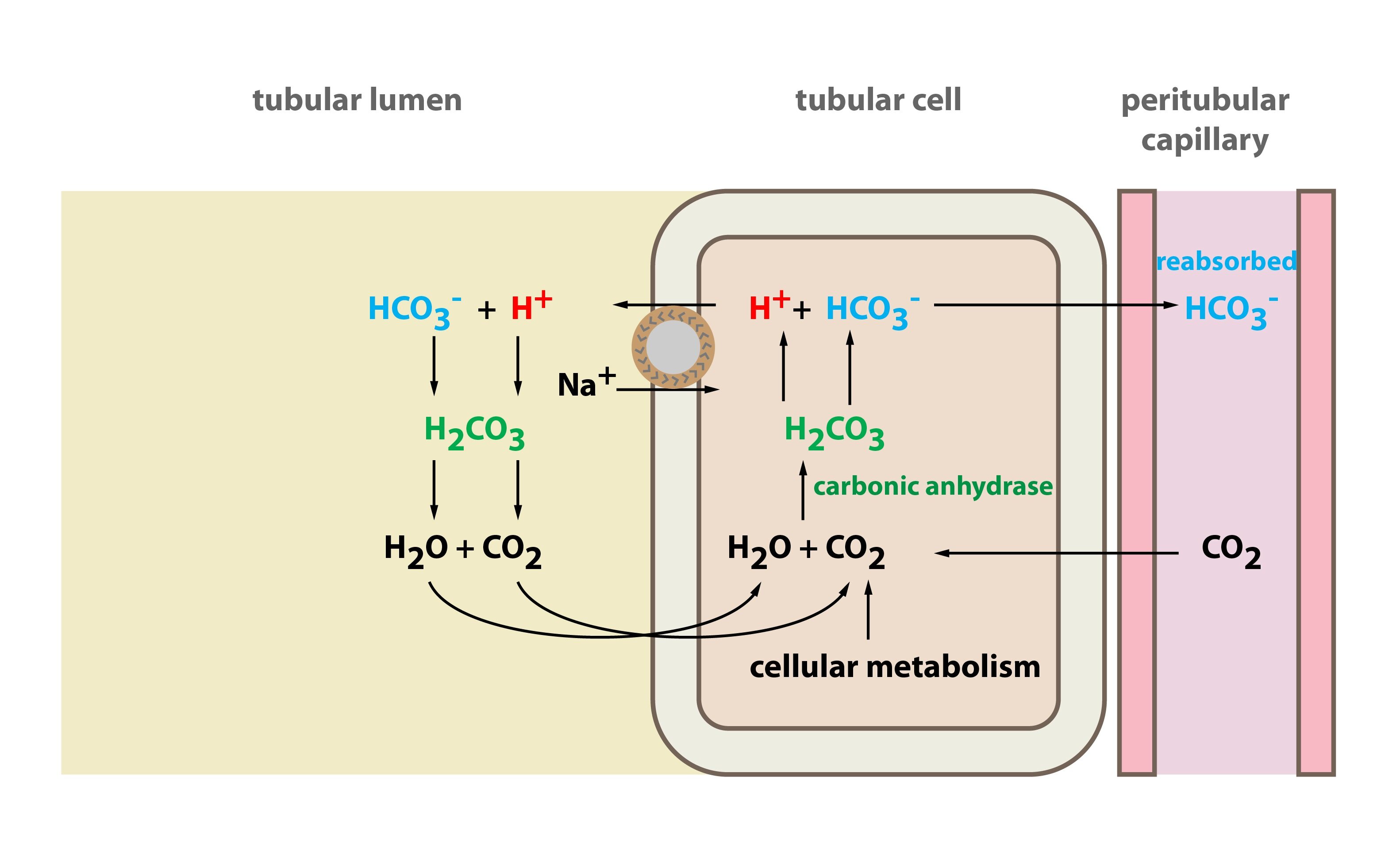
Resorpce bikarbonátu probíhá v buňkách proximálního tubulu. V primární moči je přefiltrovaný HCO3–, ke kterému se do lumina proximálního tubulu přes apikální membránu transportuje H+. K tomuto transportu slouží Na+/H+-antiport. V moči vzniká H2CO3, jež se rozpadne na H2O a CO2. Obě tyto látky snadno procházejí apikální membránou do buněk proximálního tubulu, kde se opět spojí a vytvoří H2CO3. H2CO3 disociuje a vzniká bikarbonát a H+. H+ je vyloučen zpět do moče a celý cyklus se může zopakovat. Bikarbonátové ionty následně přecházejí přes bazolaterální membránu do intersticiální tekutiny (a následně do krve peritubulární kapilární pleteně) prostřednictvím buď Na+/3HCO3–-kotransportéru, či anion exchangeru (Cl–/HCO3– přenos). Za každý sekretovaný H+ se tedy resorbuje Na+ a HCO3–. Na+ se navrací do krve i aktivním transportem výměnou za K+ – Na+/K+-ATPáza.
Tvorba nového bikarbonátu (spojená s exkrecí H+)
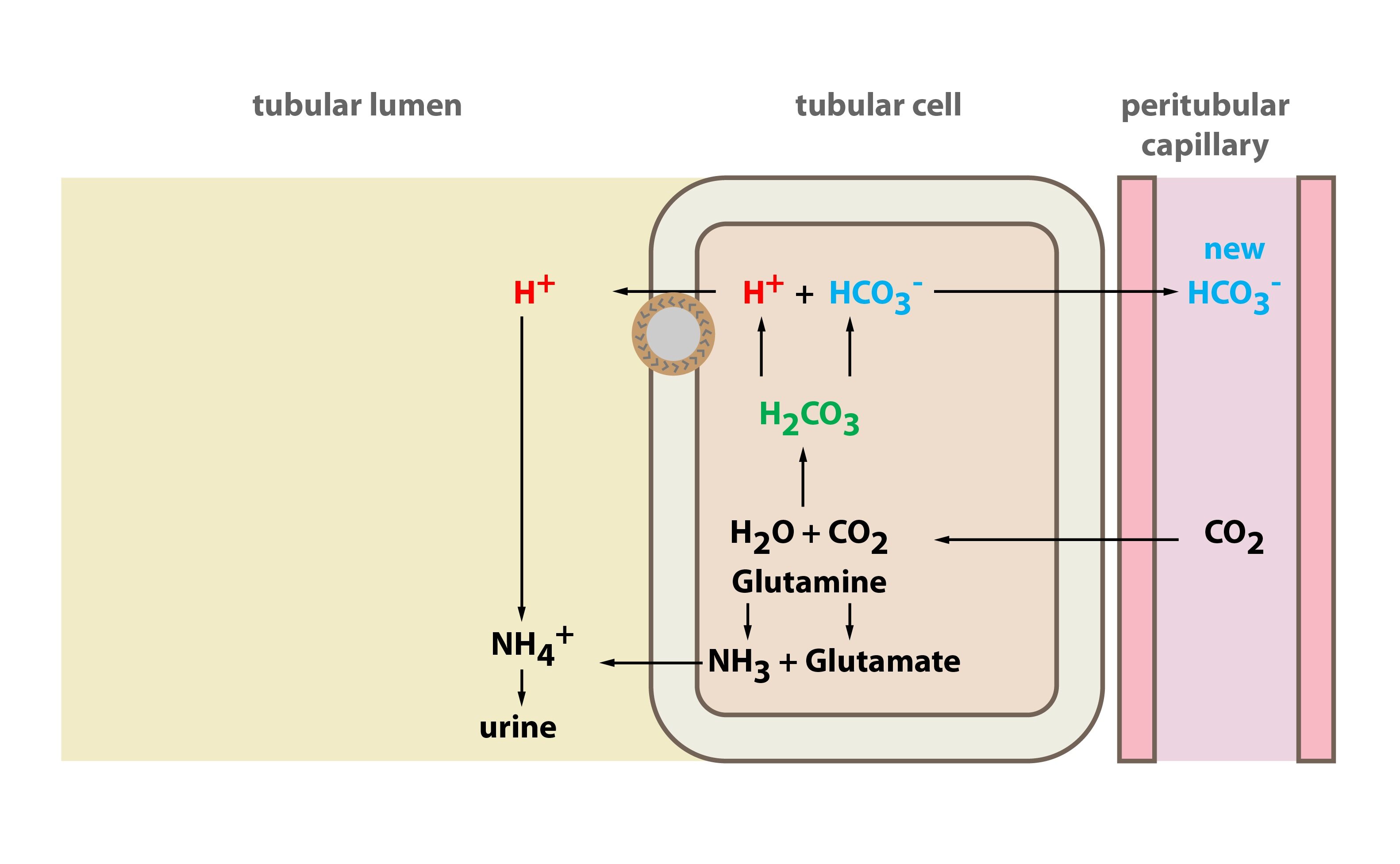
Tvorba nového bikarbonátu probíhá ve vmezeřených buňkách typu A lokalizovaných v distálním tubulu a sběracím kanálku. Ty absorbují CO2 z krve a uvnitř buněk dochází k reakci CO2 + H2O katalyzované enzymem karboanhydrázou za vzniku H2CO3. Ta disociuje na H+ + HCO3–. Buňky následně aktivně za spotřeby ATP (protonovou pumpou – H+-ATPázou) vylučují H+ do moči. Ke zvýšení kapacity exkrece jsou H+ v moči pufrovány amoniakálním a fosfátovým pufrem a následně vyloučeny. Vytvořený bikarbonát putuje do krve (peritubulární kapiláry) převážně výměnou za Cl– (Cl–/HCO3–-exchanger v bazolaterální membráně). Hormon aldosteron stimuluje sekreci H+.
Exkrece amonného iontu
Tento proces využívá amoniak vzniklý metabolismem glutaminu v tubulárních buňkách. Na každý zmetabolizovaný glutamin vznikají dva amonné ionty a dva bikarbonáty. Bikarbonáty jsou přeneseny do krve a amonné ionty jsou vyloučeny močí.
Vylučování protonů ledvinami
Oba výše popsané procesy, resorpce bikarbonátu i tvorba nového bikarbonátu, vyžadují ke svému průběhu transport H+ do lumen tubulů (H+ pocházejí z disociace kyseliny uhličité). Přesný mechanismus přenosu je ale vzájemně odlišný.
V buňkách proximálního tubulu dochází na jejich apikální membráně k vylučování H+ výměnou za vstřebaný Na+ (Na+/H+ antiport). Na bazální membráně účinkuje Na/K-ATPáza a HCO3–/Cl– exchanger.
Vmezeřené buňky typu A (v distálním tubulu a ve sběracím kanálku) secernují H+ do tubulu protonovou pumpou (H+-ATPázou). Aldosteron posiluje exkreci H+ a K+ v distálním tubulu a sběracím kanálku – vyloučení K+ či H+ za vstřebání Na+.
Výsledkem obou popsaných procesů je vznik vysokého koncentračního gradientu pro H+ – v moči je až 1000x vyšší koncentrace protonů než v buňce/krvi. Maximálně tisícinásobný rozdíl v koncentraci H+ také vysvětluje, proč minimální fyziologicky dosažitelné pH moče činí přibližně 4,4 (40 μmol/l H+) – srovnej s pH krve 7,4 (40 nmol/l H+).
Sekrece bikarbonátu
Pokud v těle roste pH (alkalóza), začínají se výrazně uplatňovat vmezeřené buňky typu B. V nich probíhá sekrece bikarbonátu spojená se ziskem H+. Jedná se o opačné mechanismy než ve vmezeřených buňkách typu A (viz výše). Dokonce ale i během alkalózy nefrony jako celek vylučují méně bikarbonátu než zadržují.
Souhrnem se dá říci, že pH extracelulární tekutiny je udržováno pufračními systémy a zúčastněnými orgány na hodnotách 7,36-7,44. Respirační systém moduluje pCO2 a ledviny ovlivňují [HCO3–].
_
Laboratorní vyšetření stavu acidobazické rovnováhy
Laboratorní vyšetření stavu acidobazické rovnováhy sestává jednak z vyšetření parametrů ABR (pH, [HCO3–], pCO2, pO2 a BE) a jednak z vyšetření ostatních látek, které mají významný vliv na ABR. Mezi ně například patří:
1) Koncentrace kationtů: Na+, K+, Ca2+, Mg2+
2) Koncentrace aniontů: Cl–, laktát, albumin
3) Koncentrace metabolitů: urea, kreatinin, event. ketolátky
Stav acidobazické rovnováhy u pacienta klinicky posuzujeme podle stavu bikarbonátového pufru. Hovoříme o tzv. vyšetření parametrů ABR dle Astrupa (ASTRUP).
Toto vyšetření slouží k posouzení aktuálního stavu ABR pacienta. Vzorky se měří na analyzátorech a jsou nazývány jako „Astrup“ podle jednoho z prvních autorů teorie ABR. Některé parametry nejsou měřeny přímo, ale jsou jen vypočítány softwarem na bázi Henderson-Hasselbalchovy rovnice.
Ke stanovení se používá arteriální krev (arteria radialis nebo femoralis), někdy se odebírá i kapilární krev. K analýze se používá nesrážlivá krev (heparin). Arteriální krev musí být bez vzduchových bublin (přítomnost vzduchu by zvýšila hodnotu pO2, snížila pCO2 a vychýlila pH alkalickým směrem) a vyšetření se musí provést co nejdříve po jejím odběru.
Normální hodnoty arteriálního Astrupu:
Přímo se měří:
1) pH = 7,36-7,44
2) pCO2 = 4,80-5,90 kPa (35-45 mmHg), průměr je 5,35 kPa (40 mmHg)
pCO2 < 4,8 kPa → hypokapnie
pCO2 > 5,9 kPa → hyperkapnie
3) pO2 = 9,9-13,3 kPa (80-100 mmHg)
Na základě naměřených parametrů se vypočítávají:
4) [HCO3–] = 24 ± 2 mmol/l
5) BE = 0 ± 2,5 mmol/l
BE (base excess, nadbytek/přebytek bazí)
Base excess je definován jako počet molů silné kyseliny, který je třeba přidat do jednoho litru plně okysličené krve, aby bylo dosaženo pH 7,4 při pCO2 = 5,3 kPa a při teplotě 37 °C. Jedná se o optimální veličinu pro hodnocení metabolické složky ABR. Normální hodnoty činí 0 ± 2,5 mM. Záporné hodnoty BE značí nadbytek kyselin v krvi – metabolickou acidózu. Kladné hodnoty BE naopak značí nadbytek bazí – metabolickou alkalózu.
Podobnou veličinou jako BE je base deficit (BD). Jak už název napovídá, jedná se naopak o nedostatek bazí udávaný v mmol/l – kolik bazí chybí.
Ionty a pH
Iontové složení ECT úzce souvisí s parametry ABR. Změny pH nejvíce odráží kalémie.
Acidóza → vyplavování K+ z buněk → hyperkalémie → ztráty K+ močí (při následné rychlé alkalizaci organismu se K+ vrací do buněk, což vede k hypokalémii → nebezpečí hlavně pro srdce – přenos signálu na membráně)
Alkalóza → K+ nahrazuje nedostatek H+ v buňkách → pokles K+ v krvi → hypokalémie; místo H+ se do moči vylučuje K+ (výměnou za Na+)
Anion gap (AG, aniontová mezera)
Anion gap je veličina, která prakticky odpovídá součtu koncentrací „neměřitelných„ aniontů (albumin – proteiny krevní plazmy, fosfáty, sulfáty, organické anionty). Přesnější než termín „neměřitelných” je běžně nestanovovaných. AG se vypočítá:
AG = ([Na+] + [K+]) – ([Cl–] + [HCO3–])
Na+ (140) + K+ (5) = Cl– (105) + HCO3– (25) + AG (15)
Norma AG: 14 ± 2 mmol/l
AG se využívá k posouzení příčin metabolické acidózy. Jednou z příčin metabolické acidózy je totiž kumulace kyselin. Koncentrace některých z nich (či jejich aniontů) se ale běžně neměří. Pokud toto nastane, vznikne nečekaný rozdíl mezi celkovým množstvím naměřených kationtů a aniontů, což může výpočet AG odhalit. Objeví-li se jakékoliv běžně neměřené anionty (odvozené od kyselin), stanou se při hodnocení součástí AG, jehož hodnota se tedy zvětší – ukazuje na akumulaci kyselin – acidóza.
Zvýšení hodnoty AG může být podmíněno:
1) Zmnožením aniontů, které AG fyziologicky tvoří
2) Přítomností nových aniontů
Tato metoda je bohužel závislá na přesnosti jiných měření. Malé chyby ve velkých číslech znamenají úměrně větší chybu ve výsledku. Pokud je potřebná informace o množství aniontů, můžeme změřit přímo jejich koncentraci. V praxi analyzujeme například množství:
1) Laktátu při hypoxii tkání
2) 3-hydroxybutyrátu při diabetické ketoacidóze
3) Fosfátů či sulfátů při selhání ledvin
_
Základní poruchy acidobazické rovnováhy a jejich kompenzace
Acidóza je proces vedoucí k poklesu pH. Alkalóza je naopak proces vedoucí k vzestupu pH. Výpočty v ABR se počítají s plazmou člověka, jejíž pH se pohybuje v zásadité části spektra ~ 7,4 (koncentrace H+ je 40 nmol/l).
Respirační poruchy jsou signalizovány změnou pCO2 (porucha respirace) – hyper nebo hypokapnie, metabolické poruchy změnou BE ([HCO3–]).
Rozeznáváme čtyři základní poruchy ABR:
1) Respirační acidóza: pokles pH krve, jehož primární příčinou je vzestup pCO2
2) Respirační alkalóza: vzestup pH krve, jehož primární příčinou je pokles pCO2
3) Metabolická acidóza: pokles pH krve, jehož primární příčinou je snížení BE ([HCO3–])
4) Metabolická alkalóza: vzestup pH krve, jehož primární příčinou je vzestup BE ([HCO3–])
Kompenzace a korekce poruch ABR
Principem kompenzace je snaha organismu o normalizaci pH při trvání poruchy ABR. Jeden systém ABR nahrazuje porušenou funkci druhého systému, neboli, vzniklá porucha ABR je kompenzovaná druhou složkou ABR. Metabolické poruchy jsou tedy kompenzovány respiračním systémem a naopak. Cílem je vrátit pH co nejblíže k fyziologické hodnotě.
Korekce se v těle týká jen metabolických poruch. Metabolická porucha je korigována jinou částí metabolické složky ABR. Lékaři ale korigují jak respirační, tak metabolické poruchy – respirační poruchy umělou plicní ventilací a metabolické např. dialýzou.
Důležité je si uvědomit, že při kompenzaci ani korekci prováděné samotným tělem nedochází k úplnému návratu k normálnímu pH.
Respirační poruchy ABR
Všichni lidé (v nemoci i ve zdraví) produkují denně velké množství kyselin. Hlavní „kyselinou” je CO2, který je za normálních okolností vylučován respiračním systémem z organismu. Neschopnost respiračního systému balancovat exkreci CO2 vede ke vzniku respiračních poruch ABR. Normální hladina pCO2 se pohybuje v rozmezí 4,80-5,90 kPa (35-45 mmHg). Pokles pH a hodnoty pCO2nad 5,90 kPa (45 mmHg) signalizují respirační acidózu, naopak nárůst pH a hodnoty pCO2 pod 4,80 kPa (35 mmHg) naznačují respirační alkalózu.
Respirační poruchy se kompenzují renálně. Ledviny zadrží nebo vyloučí HCO3– tak, aby se vyrovnal poměr HCO3– k pCO2 a pH se opět přiblížilo k normě. Rozvoj této kompenzace trvá hodiny až dny.
Respirační acidóza (RAc)
RAc vzniká, jestliže se vydýchává relativně malé množství CO2 (hypoventilace) a tím se zvyšuje pCO2 v plazmě (hyperkapnie) → zvýšený pCO2 vyvolá pokles pH krve.
Mezi příčiny respirační acidózy například patří:
1) Úbytek funkceschopné plicní tkáně (pneumonie, cystická fibróza či emfyzém)
2) Obstrukce dýchacích cest (př. zapadlý jazyk)
3) Nedostatečná ventilace (např. neuromuskulární poruchy, poruchy CNS, astmatický záchvat či při otravách – opiáty)
4) Omezení pohyblivosti hrudníku (např. při deformaci páteře)
Organismus kompenzuje RAc zvyšováním koncentrace HCO3– v krvi jeho zvýšenou resorpcí/tvorbou v tubulárních buňkách ledvin (produkuje se kyselá moč). Tělesné pH se tím přibližuje k normě.
Pokud je tento stav doprovázen sníženým pO2 rozvíjí se souběžně i metabolická acidóza způsobená hromaděním laktátu – laktátová acidóza (viz dále v textu).
Respirační alkalóza (RAl)
Respirační alkalóza vzniká v důsledku hyperventilace. Ta vyústí ve zvýšené vydechování CO2, které vede ke snížení pCO2 (hypokapnie). Významné je, že vzniklý nárůst pH ovlivňuje poměr ionizovaného a vázaného kalcia v krvi a to více ve prospěch vázaného. H+ ionty totiž soutěží s Ca2+ o vazebné místo na albuminu, což se projeví poklesem ionizovaného Ca2+ při vzestupu pH a opačným efektem při poklesu pH. Nedostatek ionizovaného kalcia může vyústit až v rozvoj křečí.
Mezi příčiny respirační alkalózy patří:
1) Hyperventilace z psychických důvodů (vydýchávání CO2 = vydýchávání emocí) nebo ve vyšších nadmořských výškách (dýchání při nedostatku O2). Přitom pCO2 v plazmě klesá. (Pozn. Tím o něco klesá i HCO3–, protože se ho část změní na CO2 (HCO3– + H+ ↔ CO2 + H2O ). Ionty H+ potřebné pro tuto reakci jsou trvale dodávány z nebikarbonátových pufrů.)
2) Poranění CNS
3) Otrava salicyláty (Aspirin), horečka atd.
Ke kompenzaci je nutný další pokles HCO3–. Toto je zajištěno větším vylučováním HCO3– ledvinami.
Metabolická acidóza (MAc)
Metabolická acidóza je nejčastější poruchou ABR. Je signalizována poklesem pH krve (zvýšení H+) a negativní hodnotou BE ([HCO3–]). Base Excess je nejlepším ukazatelem hodnocení metabolické složky ABR. Dá se také říci, že metabolická acidóza je pH, které je příliš kyselé na daný pCO2 (metabolickou komponentu musíme vždy posuzovat s přihlédnutím k pCO2).
Metabolická acidóza může mít tyto obecné příčiny:
1) Hromadění „metabolické“ kyseliny, jejíž aniont následně vytlačuje bikarbonáty
2) Ztráta bikarbonátů (doprovázených kationtem, nejčastěji sodíkem)
3) Vzácněji ztráta kationtu, hlavně sodíku, která je kompenzována poklesem bikarbonátu
Mezi tzv. metabolické kyseliny patří všechny tělesné kyseliny s výjimkou H2CO3(oxidu uhličitého). Ty se nedají vydýchat, ale musejí být neutralizovány a následně zmetabolizovány, či vyloučeny ledvinami.
Bikarbonáty se nejčastěji ztrácí z GIT. Duodenální a pankreatická šťáva je bohatá na bikarbonáty, které neutralizují nízké pH tráveniny ze žaludku. Bikarbonáty se fyziologicky zpětně resorbují v tenkém střevě. Při některých onemocněních GIT (průjmy, syndrom krátkého střeva…) není vstřebávání dostatečné. Jinou příčinou mohou být ztráty bikarbonátů ledvinami (renální tubulární acidóza, nežádoucí účinek diuretické léčby – inhibitory karboanhydrázy – acetazolamid).
Výpočet anion gapu napomáhá v diferenciální diagnostice metabolické acidózy. Nadprodukce kyselin v metabolismu vede k vysokému AG, při zvýšeném vylučování HCO3– zůstává AG normální.
Nyní zmíníme konkrétní stavy, jež vedou k metabolické acidóze:
1) Hypoxie – nedostatek O2 ve tkáních. Tkáně následně zpracovávají glukózu anaerobní glykolýzou na kyselinu mléčnou a rozvíjí se tzv. laktátová acidóza (typicky doprovází respirační acidózu, šokové stavy či předávkování biguanidy – metforminem).
2) Nadprodukce ketolátek (kyselina acetoctová a β-hydroxymáselná) se rozvíjí, pokud glukóza nemůže sloužit jako zdroj energie a ve zvýšené míře se odbourávají tuky: doprovází například diabetes mellitus či hladovění. Stav označujeme jako ketoacidózu.
3) Otravy alkoholy např. methanolem či ethylenglykolem, které se metabolizují na silné organické kyseliny (formiát a oxalát) → zvýšené množství H+. Šťavelany mohou způsobit selhání ledvin. MAc může být vyvolána i předávkováním salicyláty (aspirinem).
4) Insuficience ledvin vylučovat normálně produkované kyseliny – renální acidóza (hromadí se sulfáty, fosfáty a další anionty, které se normálně vylučují močí)
5) Těžké průjmy
6) Ztráta HCO3– ledvinami
Při všech těchto situacích nastává nejprve pufrování přebytečných H+ (HCO3– a nebikarbonátové pufrové báze), přičemž vznikající CO2 (z HCO3–) opouští organismus respiračním systémem. Druhý krok je kompenzace pomocí hyperventilace – vydýchání CO2 vedoucí k poklesu pCO2 a postupnému nárůstu pH. Hovoříme o hlubokém Kussmaulově acidotickém dýchání (stimulace dechového centra vysokou koncentrací H+). Jestliže příčina acidózy trvá a respirační kompenzace nestačí, nastupuje renální korekce – zvýšené vylučování H+ a tvorba nového bikarbonátu ledvinami (vmezeřené buňky typu A). Výsledkem je kyselá moč.
Metabolická alkalóza (MAl)
Metabolická alkalóza je charakterizována zvýšením pH a vzestupem BE. Může mít tyto obecné příčiny:
1) Ztráta některých aniontů (obvykle chloridů nebo proteinů), která je kompenzována doplněním bikarbonátů
2) Vzestup koncentrace kationtu – nejčastěji Na+
3) Zvýšený přísun alkálií (alkalizující léky – např. infúze HCO3–)
Nyní zmíníme konkrétní stavy, jež vedou k metabolické alkalóze:
1) Zvracení – ztráta HCl a tím i ztráta H+ – rozvíjí se tzv. hypochloremická alkalóza (vzniká i při podávání diuretik – např. furosemidu – ztráta K+ a Cl–)
2) Hypoproteinémie – bílkoviny jsou anionty, pokles jejich koncentrace se tedy též kompenzuje doplněním HCO3–. Setkáme se s ní při selhání jaterní proteosyntézy, při nefrotickém syndromu, či při malnutrici.
3) Hyperaldosteronismus – pro zvýšenou hladinu aldosteronu retinují ledviny více Na+, což kompenzuje doplnění HCO3– (udržení elektroneutrality). Šetření Na+ probíhá navíc přes zvýšení ztrát K+ a H+ do moči – alkalóza.
4) Iatrogenní dodání bazí (např. infúze HCO3–)
Nejdříve dochází k pufrování. Dále ke kompenzaci využije organismus hypoventilace, čímž vzroste pCO2 a pH se zpětně přibližuje k normě. Pokud není alkalóza renálního původu, může být normalizována zvýšenou exkrecí HCO3– močí (vmezeřené buňky typu B).
Jedním ze závažných důsledků alkalózy je pokles kalémie, který může vyústit až v poruchy srdečního rytmu.
Smíšené poruchy ABR
Smíšené poruchy ABR se vyskytují poměrně často. V zásadě to jsou kombinace dvou nebo více základních poruch ABR nebo kombinace více příčin, které vyvolávají tutéž poruchu ABR. Jako příklad můžeme uvést hypoventilaci, která jednak vede k respirační acidóze pro nedostatečnou exkreci CO2 a jednak k metabolické acidóze pro nedostatečnou dodávku kyslíku pro buněčný metabolismus.
Autoři podkapitoly: Josef Fontana a Petra Lavríková