Náplň podkapitoly:
1. Úvod do tvorby moči
2. Glomerulární filtrace
3. Tubulární resorpce a sekrece
_
Úvod do tvorby moči
Tvorba moči je významný děj pro celý organismus. Je jí upravována nejen acidobazická rovnováha, ale i osmolarita krve, složení plazmy i volum tekutin, a tím ovlivňovány všechny buňky v těle.
Zdravý dospělý člověk vyprodukuje 1,5-2 litry moči za den, na čemž se podílejí tři základní mechanismy:
1) Glomerulární filtrace
2) Tubulární resorpce
3) Tubulární sekrece
Funkční anatomie
Základní funkční jednotkou pro tvorbu moči je nefron. Velice důležité je uspořádání samotného nefronu, který začíná corpusculum renale Malpighi, jenž je tvořeno glomerulem, do něhož vstupuje arteriola glomerularis afferens a vystupuje arteriola glomerularis efferens, a Bowmanovým pouzdrem. Samotný tubulus renalis má tři úseky. Proximální tubulus, u kterého ještě rozlišujeme pars convuluta (počáteční stočený úsek) a pars recta, intermediální tubulus (Henleova klička), kde lze rozeznat crus descendens a crus ascendens, jehož proximální úsek je tvořen tlustým úsekem vzestupného raménka, a distální tubulus, který má naopak nejprve pars recta a pak teprve pars convuluta, a následně se prostřednictvím tubulus reuniens napojuje na sběrací kanálky.
Funkční histologie
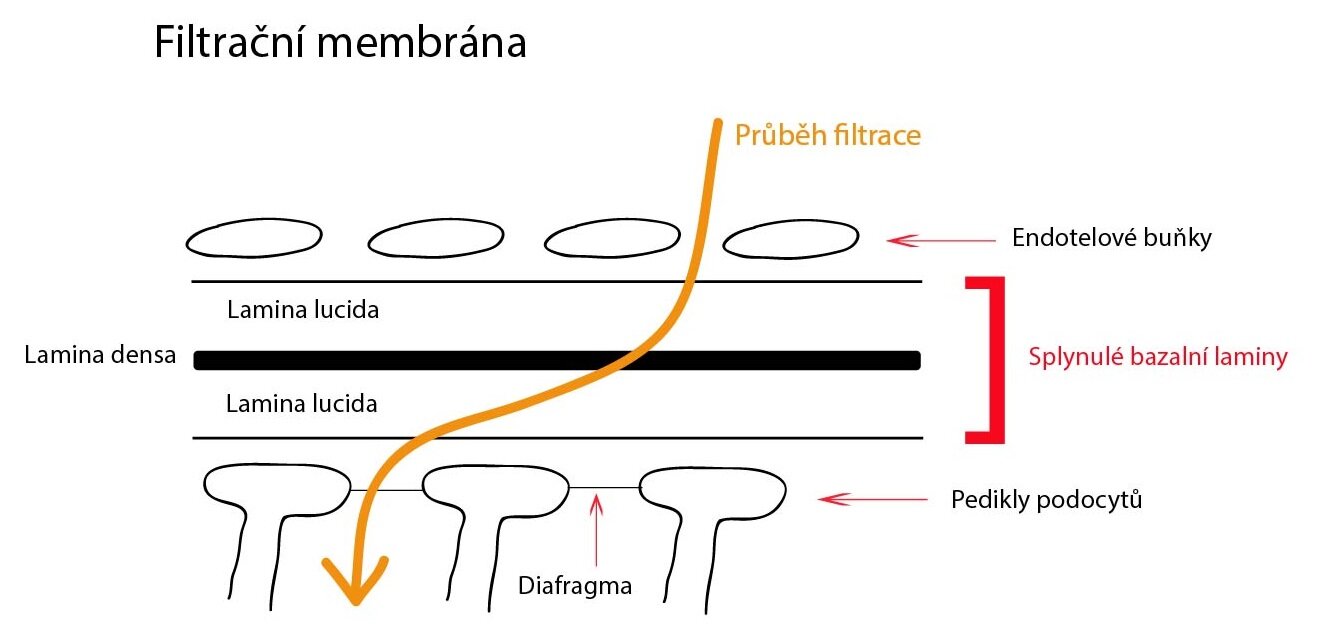
Samotný glomerulus je tvořen fenestrovanými kapilárami bez diafragmy a díky velice jemnému řízení průtoku i tlaku krve v o něco širší a. afferens a o něco užší a. efferens zde dochází ke glomerulární filtraci do Bowmanova pouzdra. Viscerálním listem Bowmanova pouzdra jsou podocyty těsně naléhající svými pedikly na bazální membránu kapilár. Parietální list je tvořen plochým jednovrstevným epitelem. Filtrační bariéru tedy představuje endotel kapilár, bazální membrána a pedikly podocytů. Mezi výběžky pediklů je ještě rozprostřena štěrbinová membrána (slit diaphragm) tvořená například proteinem nefrinem. Díky svému negativnímu náboji brání průniku plazmatických bílkovin.
Mimo to v glomerulu ještě najdeme mezangium, které poskytuje mechanickou oporu, má fagocytární aktivitu a secernuje prostaglandiny. Mesangiální buňky mimo glomerulus s buňkami macula densa (konečná část vzestupného úseku Henleovy kličky) a s granulárními buňkami (modifikované buňky hladkého svaloviny a. afferens) tvoří juxtaglomerulární aparát. V tomto místě se dostává ledvinné tělísko do kontaktu s tubulárním systémem.
Proximální tubulus je tvořen jednovrstevnou kubickou výstelkou s kartáčovým lemem na luminální straně, tenká část Henleovy kličky je tvořena plochými buňkami chudými na organely. V distálním tubulu jsou buňky menší než v proximálním bez kartáčového lemu. Sběrací kanálky patří histologicky k vývodným cestám močovým, ale v tvorbě moči mají nezastupitelný význam, proto se o nich zmíníme i zde.
_
Glomerulární filtrace
Objem tekutiny, který je za časovou jednotku filtrován ve všech glomerulech, lze vyjádřit jako glomerulární filtraci (GFR). Norma je 120 ml/min/1,73m2 tělesného povrchu, tedy 180 l/den. Z tohoto filtrátu se zhruba 99 % zpětně vrací tubulární resorpcí do extracelulární tekutiny (zpět do těla). Pohyb tekutiny přes filtrační membránu je řízen a určován poměrem hydrostatického tlaku v kapilárách a onkotickým tlakem bílkovin v plazmě, méně pak hydrostatickým tlakem intersticiální tekutiny a onkotickým tlakem v této tekutině. Tyto síly se nazývají Starlingovy a je zde několik odlišností od obecných zásad. Jednak tekutina není vyměňována mezi kapilárou a intersticiem, ale mezi kapilárou a tekutinou Bowmanova pouzdra. Dále se liší hydrostatický tlak v kapilárách, pohyb je tedy pouze jednostranný, a to ve směru filtrace. A konečně – filtrační bariéra (viz výše) má unikátní strukturu a vlastnosti, které nedovolují prostupu bílkovin do filtrátu (primární moči). GFR tedy závisí na průtoku krve ledvinami, filtračním tlaku, na onkotickém tlaku plazmy a na velikosti filtrační plochy.
Řízení glomerulární filtrace
Hlavní determinantou je průtok krve ledvinami, který je přímo úměrný rozdílu tlaků mezi a. a v. renalis a nepřímo úměrný perifernímu odporu vas afferens, vas efferens a arteria interlobularis. Rozlišujeme tzv. lokální a centrální regulační mechanismy.
Lokální regulační mechanismy
U lokálních regulačních mechanismů se uplatňuje zejména myogenní autoregulace a tubuloglomerulární zpětná vazba.
Myogenní autoregulace
Při zvýšeném tlaku dojde ke kontrakci cévy a tím ke zvýšení periferního odporu. Při snížení tlaku nastává opačný proces. Průtok krve ledvinou a tedy i GF se díky tomuto mechanismu při běžném kolísání středního arteriálního tlaku krve v rozmezí 80-180 mmHg téměř nemění.
Tubuloglomerulární zpětná vazba
Při poklesu GF zachytí macula densa, která je součástí juxtaglomerulárního aparátu, snížený průtok tubulární tekutiny a snížené množství sodných iontů a vyšle parakrinně chemický signál, který vyvolá vazodilataci vas afferens, což vede ke zvýšení hydrostatického tlaku a k obnově normální úrovně GF.
Centrální regulační mechanismy
Centrální regulační mechanismy jsou méně významné a podílí se na nich například sympatikus, adrenalin, angiotensin II, prostaglandiny či adenosin.
Postgangliový neuromediátor sympatiku noradrenalin vyvolává zejména ve vas afferens vazokonstrikci a tím sníží průtok krve ledvinou, a tedy i GF. Uplatňuje se zejména při stresových situacích, včetně bolesti a krvácení. Podobně působí i hormon adrenalin.
Angiotenzin II působí jak ve vas afferens, tak ve vas efferens přes angiotensinové receptory AT1 simultánně se sympatikem a adrenalinem.
Prostaglandiny (zejména E2 a I2) lokálně produkované v ledvinách působí na vas afferens i efferens a tlumí účinky sympatiku a angiotensinu II.
Adenosin je obecně účinné vasodilatans, ve vas afferens však působí vazokonstrikčně.
Dále je průtok krve ledvinou ovlivňován atriálním natriuretickým peptidem (ANP), glukokortikoidy, oxidem dusnatým či kininy, které GF potencují, naproti tomu antidiuretický hormon (ADH), ATP a endotelin způsobí snížení průtoku krve.
Stanovení glomerulární filtrace
Chceme-li GF stanovit, což je jedním ze základních funkčních vyšetření ledvin, pak musíme použít látku, která se z těla vylučuje jen glomerulární filtrací (inulin, kreatinin) a tubuly pouze protéká. Jako příklad si můžeme uvést výpočet tzv. clearance (= objem plazmy, který se za časovou jednotku úplně očistí od indikátorové látky) endogenního kreatininu, jejíž vzorec má následující podobu:
kde:
U – koncentrace kreatininu v moči v mmol/l
V – objem moči (diuréza) v ml/s
P – koncentrace kreatininu v plazmě v mmol/l
V praxi se ale využívá složitějších korigovaných výpočtů na povrch těla se zhodnocením i jiných tělesných parametrů – např. rovnice dle Cockrofta a Gaulta, rovnice MDRD atd.
_
Tubulární resorpce a sekrece
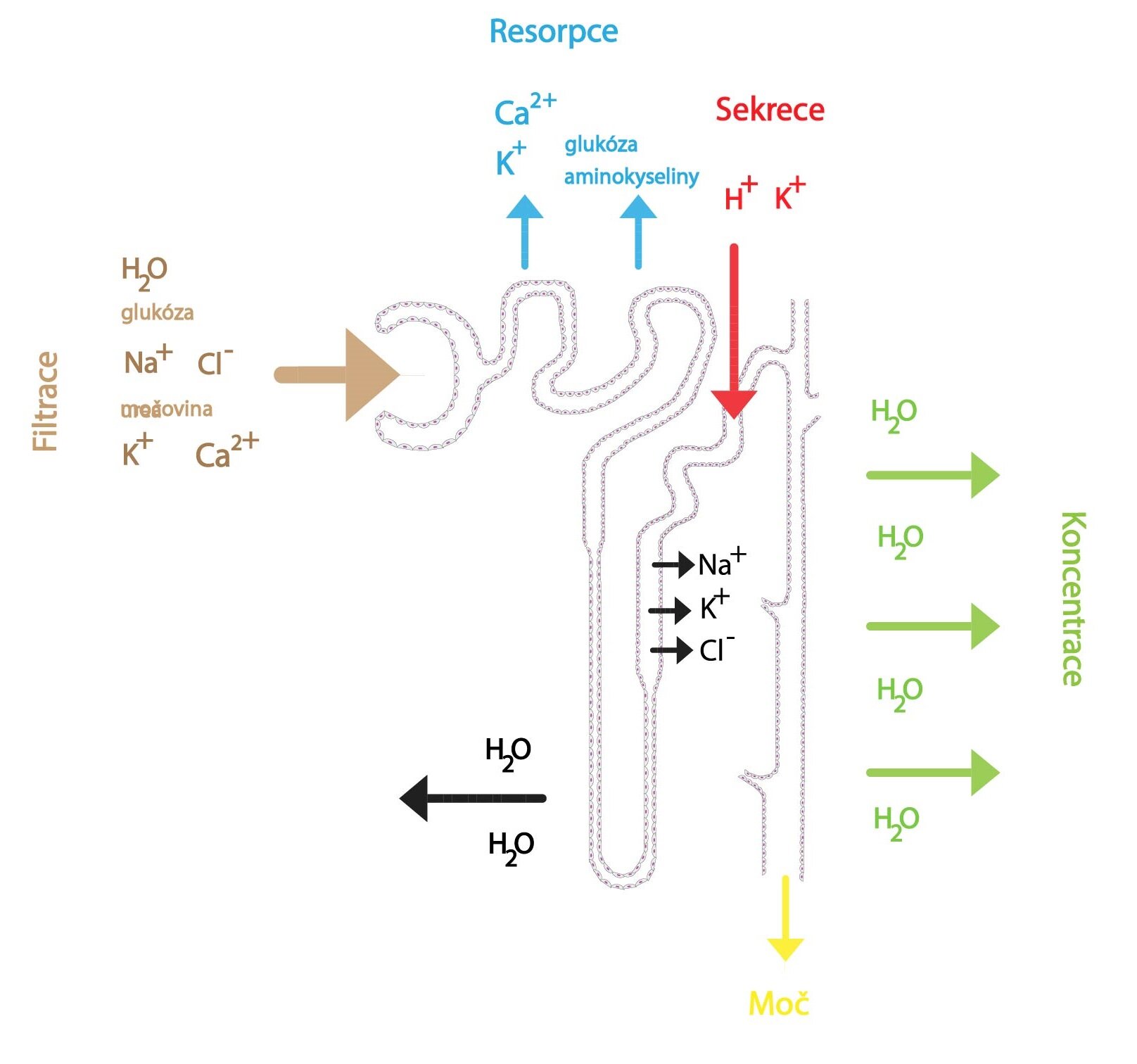
Jak jsme již uvedli výše, tak z celkového filtrátu se zhruba 99 % zpětně vrací tubulární resorpcí do extracelulární tekutiny (zpět do těla). Hlavním úkolem tubulů je tedy izoosmotická resorpce (zpětné vstřebávání) primární moči. Kromě vody se vstřebávají například ionty (sodíku, chloru, draslíku, vápníku, hořčíku, bikarbonáty či fosfáty), močovina, glukóza či aminokyseliny. To vše probíhá nezávisle na množství extracelulární tekutiny v organismu – hovoříme o tzv. obligátní resorpci. Její primární význam spočívá tedy v udržení volumu tekutin v organismu za jakýchkoli podmínek.
Transport se uskutečňuje buď pasivně difúzí ve směru koncentračního nebo elektrického gradientu, primárně aktivním transportem proti gradientu (za přímé spotřeby makroergní sloučeniny), nebo sekundárně aktivním transportem (transportní bílkovina využívá koncentračního gradientu vytvořeného primárně aktivním transportem realizovaným jinou transportní bílkovinou). Látky mohou být transportovány transcelulárně nebo paracelulárně. Voda je transportovaná vždy pasivně. Základem sekundárně aktivního transportu je Na+/K+-ATPáza umístěná na bazolaterální membráně. Tou se vytvoří koncentrační gradient pro sodík, jenž přestupuje dle svého elektrochemického gradientu z tubulární tekutiny do epitelových buněk přes apikální membránu. Transportní proteiny pak působí jako symportéry (umožní vstup sodným iontům, pokud s sebou strhnou ještě další látku), nebo antiportéry (umožní sodným iontům vstup, pokud je naopak do tubulární tekutiny vypuzena jiná látka). Pro pochopení dějů v tubulárním systému si tedy nejprve musíme představit buňky tubulárního epitelu, které jsou svojí apikální membránou obráceny k tubulární tekutině (primární moč), na druhé straně k tekutině peritubulární (zde se nachází i již zmíněná Na+/K+-ATPáza).
Proximální tubulus
V první polovině proximálního tubulujsou resorbované sodné ionty transportovány spolu s ionty bikarbonátovými a řadou látek (glukózou, aminokyselinami, laktátem, močovinou a fosfáty). Vstřebané látky jsou osmoticky aktivní, strhávají s sebou tedy i vodu, čímž stoupne koncentrace chloridových iontů v tubulární tekutině, což má nemalý význam pro resorpci v další části proximálního tubulu.
Neméně důležité je také pochopit přesun bikarbonátových a vodíkových iontů v závislosti na iontech sodných. Důležitou úlohu zde hraje enzym karbonátdehydratáza (karboanhydráza), jež se vyskytuje v apikální membráně i intracelulární části epitelové buňky. Prvním krokem je sekrece H+ do tubulární tekutiny pomocí Na+/H+-antiportu, který se nachází v luminální (apikální) membráně buněk proximálního tubulu. Přenesené H+ mohou v tubulární tekutině reagovat s přefiltrovanými bikarbonátovými ionty za vzniku kyseliny uhličité. Karbonátdehydratáza napomáhá rozkladu kyseliny uhličité v tubulární tekutině na vodu a oxid uhličitý. Obě vzniklé látky pak volně difundují do epitelových buněk tubulu, kde za opětovné katalýzy karbonátdehydratázou vzniká kyselina uhličitá, která může disociovat na vodíkové a bikarbonátové ionty. Bikarbonátové ionty následně přecházejí přes bazolaterální membránu do intersticiální tekutiny prostřednictvím buď Na+/3HCO3–-kotransportéru, či anion exchangeru (Cl–/HCO3– přenos). H+ se vrací pomocí antiportu se sodnými ionty do tubulární tekutiny. Za každý sekretovaný H+ se tedy resorbuje Na+ a HCO3– (Na+ se vrací do krve aktivním transportem výměnou za K+ – Na+/K+-ATPáza). Právě jsme popsali resorpci bikarbonátových iontů v proximálním tubulu.
Renální (tubulární) práh
Glukóza, aminokyseliny a řada dalších organických látek se v této části tubulu za fyziologických podmínek resorbují kompletně. Kapacita této resorpce má ale určitou maximální hodnotu – hovoříme o tzv. renální/tubulárním prahu (tubulárním maximu). Jako příklad si můžeme uvést ledvinný práh pro glukózu. Pokud je toto maximum/práh překročeno (důsledkem příliš vysoké koncentrace látky v krevní plazmě – například 10 mmol/l pro glukózu), objeví daná látka v definitivní moči. Neresorbované molekuly jsou osmoticky aktivní, strhávají s sebou tedy vodu a zvyšují diurézu – hovoříme o osmotické polyurii.
Ve druhé polovině proximálního tubulu jsou sodné ionty transportovány spolu s ionty chloridovými do intersticia jak transcelulárně (na bazolaterální membráně napomáhá K+/Cl–-symport), tak paracelulárně. V tubulární tekutině zůstává relativní nadbytek kladných iontů (sodné, draselné, vápenaté, hořečnaté) a ty doprovází chloridy paracelulárně. Taktéž zde jsou látky následovány pasivní resorpcí vody.
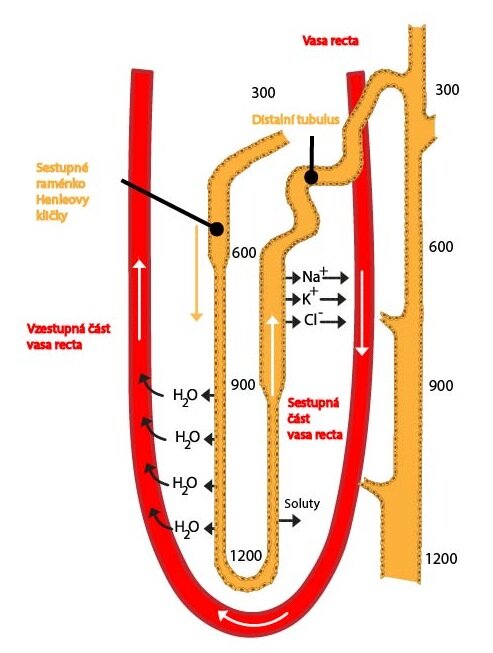
Henleova klička
V Henleově kličce se resorbuje asi 25 % solutů (tlustý segment vzestupného raménka), ale jen asi 15 % vody (sestupné raménko). To, že tlustá část vzestupného raménka je neprostupná pro vodu a má aktivní mechanismus na vstřebávání sodných a chloridových iontů, je zásadní pro vytvoření vysokého osmotického tlaku (hyperosmolarity) ve dřeni, který pak zajišťuje tvorbu koncentrované moči. Resorpce iontů se zde děje obdobně jako v proximálním tubulu, velice důležitý je ale symport iontů sodných, draselných a chloridových, kdy se přes apikální membránu propouští jeden iont sodíku, jeden draslíku a dva chlóru. Tento symport využívá energii získanou přestupem iontů sodných a chloridových ve směru jejich koncentračního gradientu k transportu iontů draselných do buňky (proti směru koncentračního gradientu). Část těchto iontů opouští buňku na bazolaterální membráně společně s ionty chloridovými, část se jich vrací zpět do tubulární tekutiny, čímž vytváří elektrickou nerovnováhu. Kladně nabité ionty (Na+, K+, Ca2+, Mg2+) jsou tak resorbovány paracelulární cestou, což je velice významná resorpce solutů. To má význam především pro vytvoření hypertonické dřeně v ledvinách. Do distálního tubulu odtéká hypotonická moč.
Klinická korelace:
Látka, která blokuje tento symport (furosemid), se využívá jako velmi účinné diuretikum – hovoříme o tzv. kličkových diureticích.
Distální tubulus a sběrací kanálek
V distálním tubulu a sběracím kanálku se resorbuje zhruba 7 % solutů (zejména Na+ a Cl–) a přibližně 17 % vody. Protože je zdejší resorpce ovlivněna hormony (např. ADH), hovoříme o tzv. fakultativní resorpci. Současně se zde v závislosti na regulačních mechanismech secernují vodíkové a draselné ionty. Distální tubulus a sběrací kanálek tedy hrají důležitou roli v tvorbě definitivní moči, udržení osmolarity extracelulární tekutiny a udržení pH. V první části distálního tubulu jsou resorbovány především ionty sodné a chloridové. V druhé části distálního tubulu a ve sběracím kanálku registrujeme dva typy buněk:
1) Hlavní buňky odpovědné za resorpci sodných iontů a vody (závislé na ADH) a sekreci iontů K+
2) Vmezeřené buňky obsahující karbonátdehydratázu. Ty se podílejí na udržení acidobazické rovnováhy, protože secernují buď vodíkové, nebo bikarbonátové ionty
O funkci vmezeřených buněk – blíže viz podkapitola o acidobazické rovnováze.
Kalciofosfátová resorpce a sekrece
Koncentrace celkového vápníku v séru (kalcemie) činí 2,25-2,75 mmol/l, hodnota ionizovaného vápníku v séru pak 1,1-1,4 mmol/l. Pouze ionizovaný vápník (přibližně 48 % kalcemie) je filtrovatelný ledvinami. Resorpce probíhá jak aktivně (15-20 %), tak pasivně paracelulárně (80 %), a to v oblasti proximálního tubulu, vzestupné části Henleovy kličky a částečně i v distálním tubulu. Parathormon stimuluje zpětnou resorpci transcelulární cestou v této oblasti nefronu. Kalcitriol působí stejně, akorát převážně v distální části tubulu. Naproti tomu kalcitonin zvyšuje vylučování iontů kalcia útlumem zpětné tubulární resorpce.
Koncentrace fosfátů v séru je 0,7-1,5 mmol/l, v moči je referenční mez 15-90 mmol/l. Fosfáty jsou taktéž ovlivňovány parathormonem, který tlumí resorpci fosfátů a kalcitoninem, jenž resorpci fosfátů taktéž snižuje.
Řízení tubulárních procesů
Podobně jako u glomerulární filtrace rozlišujeme lokální a centrální regulační mechanismy.
Lokální mechanismy
Lokální mechanismyjsou představovány zejména Starlingovými silami (zvýšený onkotický tlak v plazmě povede ke zvýšené reabsorpci vody a solutů z intersticia do kapilár, což podporuje tubulární resorpci) a glomerulotubulární rovnováhou (při vzestupu GF jsou glukóza i aminokyseliny následovány sodnými ionty a vodou, objem resorbované tekutiny tak vzroste úměrně se zvýšenou GF).
Centrální mechanismy
Centrální mechanismyjsou představovány mnoha hormony – např. ADH, aldosteronem, angiotenzinem II, adrenalinem, natriuretickými peptidy (ANP a BNP) či parathormonem. Uplatňuje se také sympatikus.
ADH (antidiuretický hormon, vasopresin) je produkován v hypotalamu a secernován v neurohypofýze jako odpověď na zvýšenou osmolaritu extracelulární tekutiny, v menší míře na pokles objemu ECT. ADH se váže na V2-receptor buněk distálního tubulu, a především buněk sběrného kanálku. Jeho působením se zvyšuje počet akvaporinů v membráně buněk a molekuly vody mohou prostupovat po směru osmotického gradientu do peritubulární tekutiny (ECT). ADH taktéž účinkuje na transport urey ve sběrném kanálku a na transport Na+ a Cl– v tlustém segmentu vzestupného raménka Henleovy kličky.
Aldosteron je secernován v zona glomerulosa kůry nadledvin jako odpověď na zvýšenou koncentraci angiotensinu II a draselných iontů v plazmě. Má tedy důležitou úlohu pro udržování stále hladiny draselných iontů (podporuje sekreci draselných iontů v tlustém segmentu Henleovy kličky a v distálním tubulu) a pro regulaci stálého objemu ECT. Jako koncová molekula systému renin-angiotenzin-aldosteron, stimuluje při poklesu objemu cirkulující plazmy zpětnou resorpci sodných iontů a tím pasivně i vody (distální tubulus a sběrací kanálky).
Angiotenzin II stimuluje tvorbu aldosteronu a resorpci sodných iontů a následně molekul vody v proximálním tubulu při poklesu volumu ECT.
Sympatikus spolu s adrenalinem stimuluje vstřebávání sodných iontů a molekul vody v proximálním tubulu a v tlustém segmentu Henleovy kličky.
Jak již název napovídá, zvyšují natriuretické peptidy (ANP – atriální natriuretický peptid a BNP – mozkový natriuretický peptid) natriurézu. V distálních tubulech totiž inhibují zpětnou resorpci Na+, čím zvýšují jeho ztráty močí. Sodné ionty s sebou strhávají molekuly vody a důsledkem je tedy i zvýšení diurézy. Oba peptidy jsou secernovány buňkami srdce. ANP je secernován kardiomyocyty srdečních síní, stimulem pro jeho sekreci je zvýšené napětí ve stěně srdečních síní (např. při zvýšení žilního návratu – způsobí roztažení síní). BNP je u člověka secernován především kardiomycyty srdečních komor – signálem je zvýšené napětí ve stěně komor. Natriuretické peptidy tedy zprostředkovávají reakci organismu na přebytek Na+ a zvýšený objem krve. Natriuretické peptidy jsou v podstatě téměř jediné látky (společně s dopaminem) podporující diurézu.
Parathormon snižuje vylučování Ca2+ ledvinami (stimuluje zpětné vstřebávání Ca2+ z primární moči) a naopak zvyšuje exkreci fosfátů močí. Ve výsledku tedy zvyšuje kalcemii a snižuje fosfatemii.
Zahušťovací a zřeďovací funkce ledvin
Pro tvorbu definitivní moči je důležitá zahušťovací a zřeďovací funkce ledvin, neboli aby se vyloučila buď nadbytečná voda, nebo nadbytečné soluty.
1) V případě zřeďování moči dochází k následujícím procesům:
a) Henleova klička vytváří gradient osmolarity směrem od kůry ke dřeni, která je hypertonická, hlavně díky neprostupnosti tlustého segmentu pro vodu a zároveň velké resorpci solutů
b) Produkce ADH je snížena
c) Močovina přechází ze dřeně do tubulárního systému a tím snižuje hypertonicitu dřeně
2) V případě zahušťování moči můžeme konstatovat, že:
1) Henleova klička vytváří gradient osmolarity hypertonické dřeně nejen díky Na+ a Cl–, ale také díky močovině – hypertonicita dřeně tedy dosahuje svého maxima
2) Produkce ADH je zvýšená
3) Močovina obíhá ve dřeni ledvin
Udržování acidobazické rovnováhy
O roli ledvin v udržování acidobazické rovnováhy detailně pojednává podkapitola o acidobazické rovnováze.
Definitivní moč
Konečným produktem všech výše popsaných procesů je definitivní moč, která je charakteristicky zapáchající, čirá, zlatožlutá tekutina o specifické hmotnosti 1 003-1 038 kg/m3, její pH se pohybuje v rozmezí 4,4-8,0. V moči zdravého člověka se nevyskytují ani bílkoviny, ani glukóza. Naopak obsahuje Na+ (100-250 mmol/l), K+ (25-100 mmol/l), Cl– (přibližně 135 mmol/l), Ca2+, kreatinin, kyselinu vanilmandlovou (degradační produkt katecholaminů), kyselinu močovou, močovinu atd. Jak již bylo řečeno, normální diuréza je 1,5-2 l/den. Polyurie představuje diurézu vyšší než 2 l/den, oligurie pak diurézu nižší než 0,5 l/den a anurie nižší než 0,1 l/den.
Autoři podkapitoly: Kristýna Dusíková, Patrik Maďa a Josef Fontana