Náplň podkapitoly:
1. Hemoglobin
2. Syntéza a odbourávání hemu / hemoglobinu
3. Krevní plyny
_
Hemoglobin
Hemoglobin (Hb), červené krevní barvivo, zabezpečuje přenos krevních plynů – především kyslíku z plic do periferních tkání, ale i části oxidu uhličitého v opačném směru (na Hb se transportuje 98 % celkového množství kyslíku a 23 % CO2). Hemoglobin také tvoří důležitý pufrační systém krve, který odstraňuje přebytek H+ (zejména v periferních tkáních těla) vazbou na His-zbytky svých molekul. Koncentrace hemoglobinu v krvi se liší podle pohlaví – ženy 120-162 g/l, muži 135-172 g/l.
Historická korelace:
Hemoglobin jako molekula byl objeven již v roce 1840, ale jeho funkci popsal až později významný francouzský fyziolog Claude Bernard.
Struktura hemoglobinu
Hemoglobin je převážně sférická molekula a jak její název napovídá skládá se ze dvou základních částí – molekul globinů (polypeptid), do kterých jsou zavzaté prostetické skupiny hemu. Celá molekula hemoglobinu je tetramer – obsahuje čtyři podjednotky, které jsou vzájemně spojeny H-můstky a iontovými vazbami. Hb tedy vykazuje kvarterní strukturu.
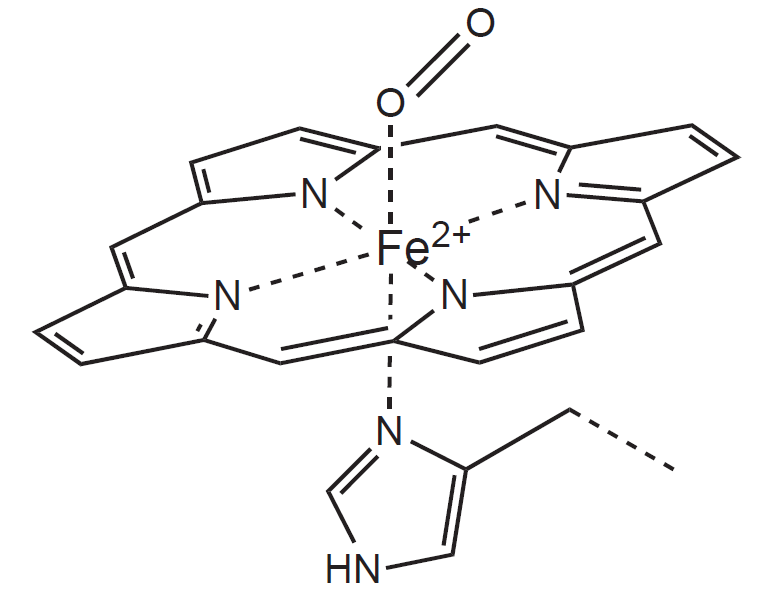
Na každou molekulu globinu je vázána právě jedna molekula hemu (cyklický tetrapyrrol) s centrálním kationtem Fe2+. Samotný hem tvoří jen 4 % celé molekuly.
Jedna molekula hemoglobinu tedy souhrnně obsahuje:
1) Čtyři polypeptidové řetězce – globiny
2) Čtyři molekuly hemu, každá molekula hemu obsahuje jeden kationt Fe2+
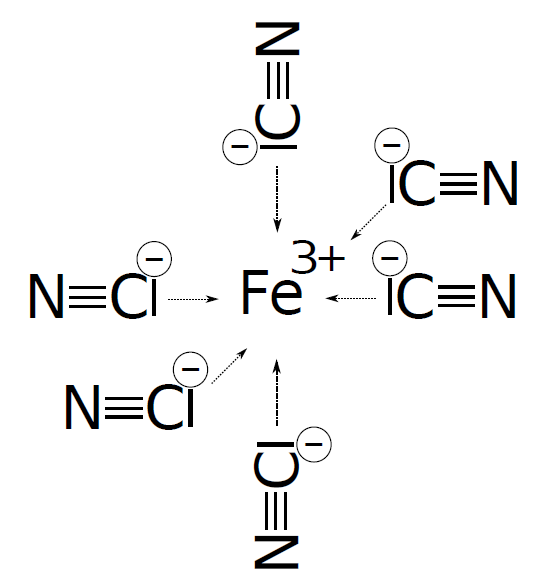
Ionty kovu využívané v katalýze reakce musí být pevně vázány na specifické místo molekuly. Toho je dosaženo prostřednictvím koordinačních (neboli dativních) vazeb, které vytvářejí iontový komplex. V kovových komplexech bývá centrální atom kovu obklopen různým počtem ligandů. Ty mají volné elektronové páry, které poskytnou kovovému iontu a vytvoří tak spolu vazbu.
Ve struktuře ferrikyanidu má každý kyanidový aniont na atomu uhlíku nevazebný elektronový pár, který dokáže tvořit vazbu s volným orbitalem ve valenční vrstvě železitého iontu.
Hem představuje speciální typ komplexu nazývaný chelát. Cheláty vznikají, pokud ligandy obsahují více než jedno vazebné místo připojené k atomu kovu. Protože Fe2+ komplexy mají ve vodě tendenci být kyslíkem oxidovány na Fe3+, je důležité umístění hemu v hydrofobní kapse tvořené polypeptidovým řetězcem globinu.
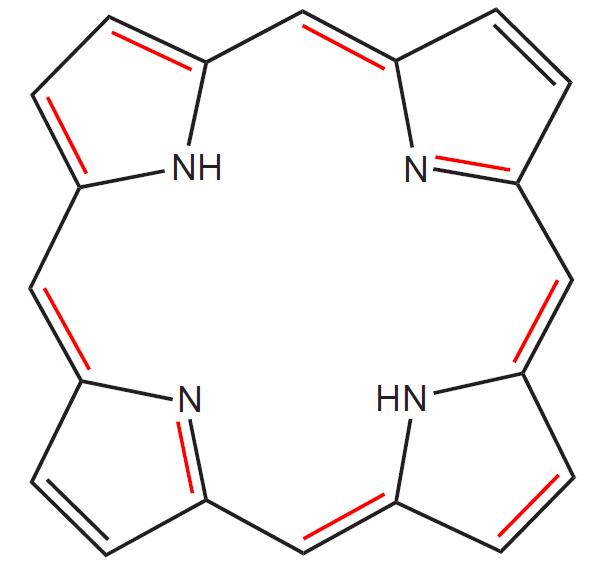
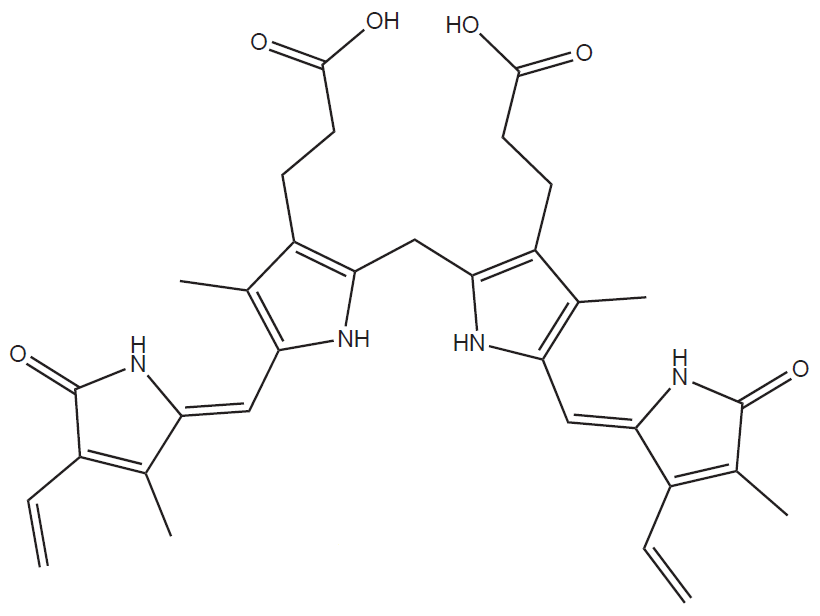
Hem náleží do skupiny látek označovaných jako porfyriny, které jsou charakterizovány cyklickou strukturou a přítomností čtyř pyrrolových jader spojených -CH= můstky (tzv. methenylové můstky). Patří tedy mezi tetrapyrroly.
Rozdíl mezi oběma skupinami, obsahujícími čtyři pyrrolová jádra, spočívá v tom, že tetrapyrroly mohou být i lineární, zatímco porfyriny jsou vždy cyklické a představují tedy podskupinu tetrapyrrolů.
Porfyriny jsou barevné sloučeniny, za což vděčí obsahu velkého množství delokalizovaných dvojných vazeb. Elektrony obklopující atomy nebo přítomné ve vazbách jsou schopné absorpce elektromagnetických vln s následným pohlcením jejich energie a přechodem na vyšší orbital. Elektrony přítomné ve dvojných vazbách (π elektrony) absorbují jen vysokoenergetické UV záření, a proto jsou sloučeniny s izolovanými dvojnými vazbami bezbarvé. Konjugace dvojných vazeb (a delokalizace π elektronů) snižuje množství energie potřebné k excitaci elektronů, a tím zvětšuje vlnovou délku světla, které může být danou látkou absorbováno. Barva, jež pozorujeme, je komplementární k barvě pohlcené (hem je tedy červený, protože absorbuje modro-zelené světlo). Červená barva hemu tedy není způsobena přítomností kationtu Fe, ale delokalizovanými elektrony v profyrinovém cyklu.
Porfyriny váží svůj centrální atom kovu čtyřmi N atomy v pyrrolových jádrech. Železo (ferri i ferro forma) ale preferuje vazbu s více než čtyřmi ligandy, a další dva ligandy se tak mohou vázat kolmo na rovinu cyklu. V případě hemu je páté místo vázáno na zbytek His globinového řetězce a poslední (šesté) může být obsazeno molekulou O2. Iont Fe2+ má tedy v molekule hemu celkem 6 koordinačně kovalentních vazeb (koordinační číslo 6).
Typy hemoglobinu
Podle druhu polypeptidových řetězců (α, β, γ, δ, ε a ζ) rozlišujeme několik typů molekul hemoglobinu. Molekula je vždy tvořena dvěma páry řetězců, přičemž řetězce v rámci jednoho páru jsou stejné.
1) Fyziologické formy hemoglobinu
a) Adultní hemoglobin: přítomný u dospělých
1. Hb A1 (2α2β): majoritní forma Hb u dospělých a dětí nad sedm měsíců
2. Hb A2 (2α2δ): minoritní forma Hb dospělých, tvoří přibližně 2 % celkového HbA
b) Fetální hemoglobin – Hb F (2α2γ)
Hb F je tvořen u plodu, po narození je odbouráván a nahrazován HbA. U novorozenců tvoří až 70 % celkového hemoglobinu. Má schopnost vazby a disociace O2 při nižším parciálním tlaku kyslíku než HbA, a může tak snadněji vázat kyslík disociující z Hb matky v placentě. Saturační křivka Hb F je posunutá doleva. V dospělosti tvoří asi 0,5 % celkového Hb.
c) Embryonální hemoglobin
Embryonální hemoglobin je tvořen u embryí buňkami krevních ostrůvků žloutkového váčku v prvních týdnech vývoje, později je nahrazen Hb F. Rozeznáváme tyto typy embryonálního Hb: Gower I (2ζ2ε), Gower II (2α2ε), Portland (2ζ2γ).
2) Abnormální / patologické formy hemoglobinu
Tyto formy vznikají při různých poruchách syntézy hemoglobinu, například při bodových mutacích, které mohou způsobit záměnu jedné aminokyseliny řetězce za jinou.
Hb S (2α2β): obsahuje bodovou mutaci v genu pro řetězec β, která způsobí zařazení Val na pozici 6 řetězce (místo Glu), a vyvolá tak změnu isoelektrického bodu globinového řetězce. Erytrocyty s HbS mají zkrácenou životnost (jen 10-20 dnů oproti 120 dnům u normálních erytrocytů), ale zároveň jsou odolnější vůči infekci prvokem Plasmodium, který vyvolává malárii (výhoda heterozygotů). V deoxyformě tvoří Hb S dlouhé řetězce asociované v tlustých vláknech, které způsobují změnu tvaru erytrocytů z bikonkávního na srpkovitý. Deformace tvaru způsobuje zhoršení elastických vlastností buněk, které pak hůře procházejí kapilárami a mohou je ucpat. Mluvíme o srpkovité anémii.
Deriváty hemoglobinu
1) Oxyhemoglobin (oxyHb): Hb s navázaným kyslíkem, má jasně červenou barvu
2) Deoxyhemoglobin (deoxyHb): Hb bez kyslíku, má tmavě červenou barvu
3) Karbonylhemoglobin (karbonylHb): Hb s CO navázaným na místě kyslíku
CO se váže asi 200-300x pevněji na Fe2+ než O2 , a i když je vazba reverzibilní, za normálního tlaku jej kyslík z vazby nevytlačí. KarbonylHb tedy nemůže přenášet O2 , což vede ke snížené schopnosti krve transportovat kyslík se vyvíjí tkáňová hypoxie. U postižených osob se přitom popisuje růžová (třešňová) barva pleti, neboť karbonylhemoglobin má karmínově červenou barvu. OxyHb lze regenerovat při vyšším parciálním tlaku O2 (např. v barokomoře). Rozpad COHb se urychlí světlem a i.v. podáním methylenové modři.
4) Methemoglobin (metHb): vzniká oxidací Fe2+ hemu na Fe3+
Tato oxidace je do do jisté míry fyziologická, v krvi se normálně vyskytuje asi 0,5-1 % Hb ve formě metHb. Zpětnou redukci zabezpečuje enzym methemoglobinreduktáza. U dětí do 1 roku není enzymatický antioxidační systém ještě plně vyvinutý, a proto je u nich riziko vzniku methemoglobinemie při pití vody z vodovodu (obsahuje dusičnany, v těle přeměňované na dusitany, které pak oxidují Fe hemu).
5) Karbaminohemoglobin (karbaminoHb): Hb s CO2 navázaným přes -NH2 skupinu globinu, má tmavě rudou barvu
6) Kyanhemoglobin (kyanHb): vazba CN– místo O2 na Fe2+
7) Glykovaný hemoglobin (HbA1c): Hb, na jehož globinové řetězce se neenzymaticky váže glukóza
U zdravého člověka se hodnoty HbA1c pohybují v rozmezí 2,8-4,0 % celkového Hb, u diabetiků bývají hodnoty vyšší (dle kompenzace diabetu). Jeho měřením můžeme zpětně sledovat compliance pacienta při léčbě diabetu.
_
Syntéza a odbourávání hemu / hemoglobinu
Syntéza hemu
Hem je syntetizován z 85 % v kostní dřeni, zbytek převážně v játrech, ale jeho tvorby jsou schopny témeř všechny buňky těla. I navzdory relativně komplexní struktuře je syntéza porfyrinového cyklu relativně jednoduchá. Začíná tvorbou tetrapyrrolu:
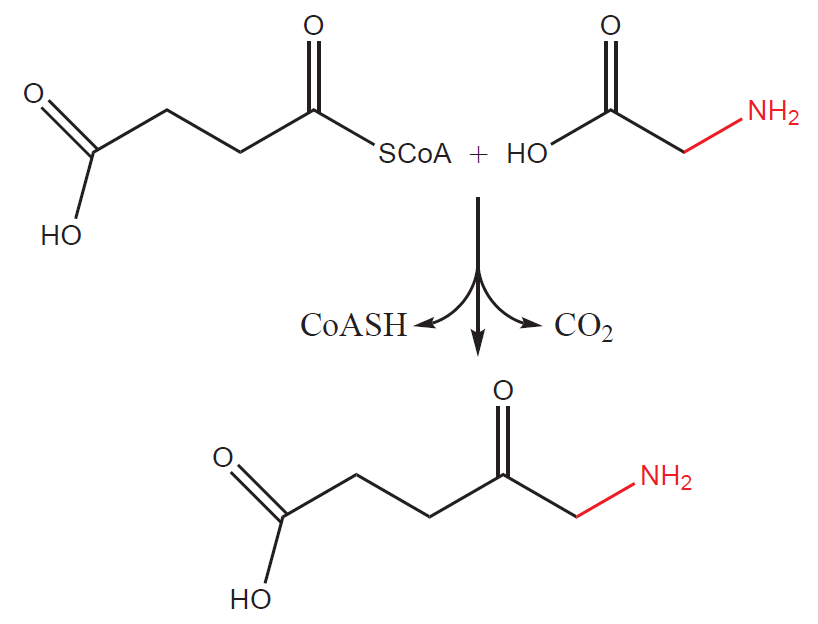
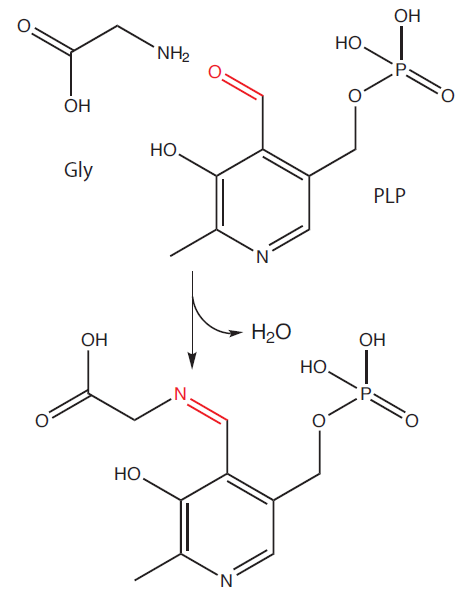
1) První krok se odehrává v mitochondriích. Sukcinyl-CoA (meziprodukt Krebsova cyklu) reaguje s glycinem za vzniku 5-aminolevulové kyseliny (také δ-aminolevulová kyselina, ALA). Katalýzu zabezpečuje enzym ALA-syntáza (ALAS), který je rychlost-limitujícím, a tak zároveň i regulačním enzymem.
ALAS je regulována negativní zpětnou vazbou konečným produktem celé dráhy – hemem. Hem při svém nadbytku inhibuje transport enzymu z místa jeho syntézy (cytosol) do mitochondrie, a tím brzdí průběh dráhy (enzym je v cytosolu pomalu odbouráván). Kofaktorem ALAS je pyridoxalfosfát (derivát vitaminu B6).
ALA je následně transportována do cytoplazmy, kde se odehrávají další dva kroky:
2) Dvě molekuly ALA se spojí za katalýzy ALA-dehydratázou (PBG-syntáza), a vytvoří tak monopyrrol – porfobilinogen (PBG).
ALA-dehydratáza je metaloenzym obsahující ve svém aktivním centru Zn. Při otravě olovem je jím Zn nahrazen a katalytická aktivita enzymu je zničena.
3) Čtyři molekuly PBG se následně spojí a vytvoří první tetrapyrrol – hydroxymethylbilan (HMB).
První cyklické tetrapyrroly vytvořené z lineárního hydroxymethylbilanu ještě neobsahují cyklus konjugovaných dvojných vazeb, a proto jsou bezbarvé. Tyto „nenasycené“ tetrapyrroly, prekurzory porfyrinů, se nazývají porfyrinogeny.
4) Hydroxymethylbilan je cyklizován a tvoří uroporfyrinogen III, který je pak sérií dalších kroků (přes koproporfyrinogen III) přeměněn na protoporfyrinogen IX, poslední „nenasycený“ prekurzor.
5) Protoporfyrinogen IX je transportován do mitochondie a na vnitřní mitochondriální membráně je oxidován na protoporfyrin IX. Oxidace vytvoří systém konjugovaných dvojných vazeb, a změní tak bezbarvý porfyrinogen na červený porfyrin.
6) Posledním krokem syntézy je vnesení kationtu Fe2+, které je katalyzováno enzymem ferrochelatázou (hemsyntáza).
Poruchy syntézy hemu
Kompletní blokády syntézy hemu nejsou kompatibilní s přežitím plodu, a proto se s nimi nesetkáváme. Existují ale parciální defekty, nazývané porfyrie. V závislosti na tom, který enzym je postižen poklesem aktivity, rozeznáváme kolem šesti typů porfyrií. Defekt může být vrozený nebo získaný a obecně vede k hromadění metabolitů před blokem a nedostatku meziproduktů za ním.
Snížená aktivita porfobilinogendeaminázy (katalyzuje vznik hydroxymethylbilanu) způsobuje porfyrii nazývanou AIP (akutní intermitentní porfyrie). Protože se snižuje syntéza hemu, je nedostatečná inhibice ALAS. To vede k hromadění ALA a PBG, které se dostávají do CNS, kůže a jiných tkání a jsou vylučovány ve zvýšené míře močí a stolicí. Příznaky tohoto onemocnění zahrnují bolesti břicha, neurologické poruchy (záchvaty, duševní poruchy), špatně se hojící rány na kůži či moč barvy portského vína. Symptomy se objevují epizodicky, mohou být vyvolány stresem, infekcemi nebo některými léky.
Léčba spočívá v infuzích hemu či heminu (komplex podobný hemu, ale obsahující Fe3+), které zpětně inhibují ALAS a suplementují nedostatek vlastního hemu.
Odbourávání hemu / hemoglobinu
Hlavním místem odbourávání hemu je RES (retikuloendoteliální systém) tvořený fagocytujícími buňkami – zejména makrofágy jater (tzv. Kupferove buňky), sleziny, kostní dřeně a podkoží (histiocyty). Pokud dojde k intravaskulární hemolýze (rozpad červených krvinek), je uvolněný Hb vázán na haptoglobin (případně uvolněný hem vyvazuje hemopexin) a komplexy jsou potom pohlcovány RES.
Molekula hemoglobinu je nejdříve rozdělena na molekuly globinů a molekuly hemu. Globinové řetězce jsou hydrolyzovány na aminokyseliny a reutilizovány.
Degradace hemu
Enzym hemoxygenáza za pomoci molekuly kyslíku a spotřeby NADPH rozštěpí porfyrinový cyklus uvolněním jednoho methylenového můstku (který se vyloučí v podobě CO) a uvolní také Fe v podobě kationtu Fe3+. Vzniklý tetrapyrrol se nazývá biliverdin. Ten stále obsahuje konjugované dvojné vazby, a proto má zelenou barvu. Biliverdin je následně enzymem biliverdinreduktázou redukován na hlavní degradační produkt katabolismu hemu – bilirubin.
Bilirubin je špatně rozpustný ve vodě, a v krvi proto musí být transportován ve vazbě na albumin (tzv. nekonjugovaný, nepřímý bilirubin). Kvůli své špatné rozpustnosti se nekonjugovaný bilirubin nedostane do moči, ale může (v případě vytěsnění z vazby nebo při vysoké produkci, kdy vazebná kapacita nestačí) pronikat přes nezralou hematoencefalickou bariéru novorozenců, kde působí toxicky na nervové buňky a vyvolává tzv. kernikterus.
Nekonjugovaný bilirubin vázaný na albumin je přenesen do jater, kde dochází ke konjugaci s jednou nebo dvěma molekulami kyseliny glukuronové, které se vážou přes esterové vazby. Reakci katalyzuje UDP-glukuronyltransferáza (snížení její aktivity podmiňuje onemocnění nazývané Gilbertův syndrom, kompletní defekt enzymu se nazývá Criglerův-Najjarův syndrom). Bilirubin mono- nebo diglukuronid je následně vyloučen do žluče a dostává se s ní do střeva. Proces konjugace s kyselinou glukuronovou se uplatňuje i při detoxikaci cizorodých látek, viz Kapitola 9.
V střevě dochází k dekonjugaci a následně činností bakterií k redukci bilirubinu na urobilinogen a sterkobilinogen. Část urobilinogenu je resorbována ze střeva zpět do krve a dostává se do moče. Urobilinogen a sterkobilinogen jsou ve střevě přeměňovány bakteriemi na sterkobilin a urobilin a ty jsou vyloučeny stolicí.
_
Krevní plyny
Termínem krevní plyny jsou označovány molekuly kyslíku (O2) a oxidu uhličitého (CO2), které jsou krví transportovány mezi kapilárním řečištěm plic a periferními tkáněmi. Obecně mohou být krevní plyny transportovány dvěma způsoby:
1) Fyzikálně rozpuštěné v krvi
Rozpustnost v krvi závisí na koeficientu rozpustnosti pro daný plyn (například pro CO2 je koeficient až 22krát vyšší než pro O2) a typicky vykazuje lineární závislost na parciálním tlaku daného plynu.
2) Chemicky vázané
Například na hemoglobin, proteiny krevní plazmy, nebo (pro CO2) v podobě HCO3–. Část látek (včetně hemoglobinu) má jen určitou vazebnou kapacitou určenou celkovým množstvím dané látky v plazmě.
Parciální tlak plynu ve směsi je definován jako tlak, který by plyn vytvářel, kdyby při stejné teplotě sám okupoval příslušný objem. Je tedy daný koncentrací plynu v směsi a celkovým tlakem této směsi. Parciální tlaky se značí pCO2, pO2 adt.
Transport kyslíku
1) Fyzikálně rozpuštěný v krvi – 1,5 %
Kvůli malé rozpustnosti kyslíku ve vodě je v jednom litru krve fyzikálně rozpuštěno jen 3,2 ml O2, což tvoří asi 1,5 % celkového množství kyslíku v krvi. Tato rozpuštěná frakce závisí lineárně na pO2.
2) Chemicky vázaný – 98,5 %
Nevýznamnějším způsobem transportu kyslíku v krvi je jeho vazba na hemoglobin. Každý kationt Fe2+ dokáže reverzibilně vázat jednu molekulu O2, a Hb se tak oxygenuje (okysličuje) na oxyhemoglobin. Jeden mol hemoglobinu tedy při úplném nasycení váže 4 moly O2. Z toho můžeme odvodit množství transportovaného kyslíku na 1 g Hb, které je in vivo přibližně 1,35 ml. Při koncentraci Hb v krvi kolem 160 g/l je tedy kyslíková kapacita hemoglobinu maximálně 216 ml O2 na 1 l krve.
Vazba kyslíku na jeden z globinů hemoglobinové molekuly má na ostatní podjednotky allosterický efekt v podobě zvýšení jejich vazebné kapacity pro kyslík. Konformace molekuly deoxyHb bývá označována jako T-forma (T – „tense“, tedy napjatý; vyjadřuje jeho nižší afinitu ke kyslíku) a molekuly oxyHb jako R-forma (R – „relaxed“, uvolněný).
Existuje plynulý přechod mezi T a R-formou podmíněný postupným navazováním či vyvazováním kyslíku z jednotlivých podjednotek hemoglobinu. Čím více podjednotek má navázanou molekulu kyslíku, tím víc se přibližuje R-formě a naopak. Vazba kyslíku totiž způsobí lokální konformační změnu příslušné podjednotky, která oslabí asociaci mezi ostatními podjednotkami. Allosterický efekt dobře demonstruuje sigmoidální tvar saturační křivky hemoglobinu.
Saturační křivka znázorňuje závislost saturace hemoglobinu kyslíkem (obvykle vyjádřena v procentech) na jeho parciálním tlaku (v kPa). Saturace vyjadřuje podíl oxygenovaného Hb k celkovému množství Hb krve (a tedy nasycenost jeho celkové transportní kapacity). 100% saturace tedy znamená, že veškerý Hb je plně obsazen kyslíkem. Z křivky můžeme vyčíst, jak se nasycení krve kyslíkem mění v závislosti na změnách parciálního tlaku O2.
V rozsahu 1,3-5,3 kPa (10-40 mmHg) saturace prudce stoupá. To je způsobeno právě allosterickým efektem, kdy i jediná navázaná molekula kyslíku na molekulu Hb zvýší afinitu všech jeho podjednotek, které pak ochotněji váží další molekuly kyslíku. Při pO2 mezi 9,3 a 13,3 kPa (70-100 mmHg) je Hb téměř plně saturován a křivka je vodorovná. Krev opouštějící plíce je v průměru saturována na 97 %, smíšená venózní krev (odtékající z tkání) má saturaci asi 75 %.
Mezi faktory ovlivňující průběh saturační křivky patří:
a) Parciální tlak CO2 (pCO2)
Při nárůstu pCO2 a tvorbě karbaminoHb se afinita Hb ke kyslíku snižuje a saturační křivka se posouvá doprava. Ulehčí se tím uvolňování kyslíku z vazby na Hb především v periferních tkáních, kde je koncentrace CO2 vyšší. Naopak v plicích, kde se CO2 dostává zpět do atmosféry, je jeho parciální tlak nižší a zpětně se obnoví vyšší afinita Hb k O2.
b) pH
Efekt pH na průběh křivky je prakticky shodný s efektem pCO2, protože CO2 významně ovlivňuje pH prostředí. Pokles pH (kromě zvýšeného obsahu CO2 může být též vyvolán zvýšenou produkcí netěkavých kyselin, například kyseliny mléčné při anaerobním metabolismu svalů) současně se vznikem karbaminoHb snižuje afinitu ke kyslíku a posouvá křivku doprava (tzv. Bohrův efekt). Nárůst pH a pokles pCO2 má opačný efekt.
c) Teplota
Zvýšená teplota snižuje afinitu Hb ke kyslíku a křivku posouvá doprava. Tento vliv má význam zejména při svalové práci, která generuje teplo, a tak ulehčuje v periferních tkáních uvolňování kyslíku z vazby.
d) 2,3-bisfosfoglycerát (2,3-BPG)
Svou vazbou na β-řetězce hemoglobinu způsobí konformační změnu molekuly a sníží tak její afinitu ke kyslíku. 2,3-BPG se syntetizuje ve zvýšené míře například při pobytu ve vyšší nadmořské výšce, nebo po fyzické aktivitě. Jeho efekt na Hb F je nižší než na Hb A.
Křivka vazby CO na Hb má extrémně prudký nárůst právě kvůli vysoké afinitě CO k hemoglobinu. Stačí již relativně nízké pCO a rychle je dosaženo maximální saturace.
Vazebná křivka metHb-O2 naopak zůstává na 0, protože Fe3+ nemá schopnost vázat kyslík.
V případě Hb F je celá křivka posunutá doleva, protože Hb F vykazuje vyšší afinitu ke kyslíku než Hb A. Je to způsobeno nižší vazbou 2,3-BPG na molekuly Hb F.
Myoglobin nemá na rozdíl od hemoglobinu kvarterní strukturu, je tvořen jen jedním polypeptidovým řetězcem. Proto jeho saturační křivka nemá sigmoidální charakter. Myoglobin vykazuje vyšší afinitu ke kyslíku a slouží jako jeho zásobárna pro potřeby svalu.
Transport oxidu uhličitého
1) Fyzikálně rozpuštěný v krvi – 5 %
V 1 litru arteriální krve je rozpuštěno přibližně 30 ml CO2, v případě venózní krve je to 35 ml. Toto množství představuje asi 5 % celkového množství CO2 v krvi.
2) Chemicky vázaný – 95 % (~ 83 % jako HCO3– a ~ 12 % ve vazbě na Hb a proteiny)
a) Oxid uhličitý vázaný ve formě HCO3– představuje jeho hlavní transportní formu v krvi s 80-85 % podílem na jeho přenosu.
b) V menší míře se CO2 reverzibilně váže na amino skupiny hemoglobinu a plazmatických proteinů – vznikají karbaminoHb a karbaminoproteiny, které dohromady transportují zbylých 10-15 % CO2.
V periferních tkáních se z buněk do krve uvolňuje CO2. Jeho vyšší koncentrace a zároveň nižší pH snižují afinitu Hb ke kyslíku, a podporují tak jeho uvolňování z vazby. Kyslík následně prostupuje do buněk, kde je využit v procesu oxidativní fosforylace. CO2 se difuzí z krve dostává do erytrocytů. Tam se buď váže na Hb, nebo reaguje s vodou za katalýzy enzymem karboanhydráza (CA, karbonátdehydratáza):
CO2 + H2O ↔ H2CO3
Tato reakce probíhá i bez katalýzy (a to i přímo v krvi), ale jen relativně pomalu. V krvi se tak nachází až 1000krát více rozpuštěného CO2 než H2CO3.
Vzniklá kyselina uhličitá (v krvi i erytrocytech) disociuje:
H2CO3 ↔ HCO3– + H+
Více než 70 % vzniklého HCO3– opouští erytrocyty přes speciální HCO3–/Cl– antiport – výměnou za ionty Cl– v procesu nazývaném Hamburgerův efekt (chloridový posun – chloride shift, tento proces probíhá i v parietálních buňkách žaludku při tvorbě HCl a při resorbci HCO3– v tubulech ledvin). Za silně osmoticky aktivním Cl– se do erytrocytu dostává také voda, která zvětšuje jejich objem, a proto je hematokrit ve venózní krvi přibližně o 3 % vyšší než v krvi arteriální. H+, který vznikl disociací kyseliny uhličité, je pufrován hemoglobinem. Deoxygenovaný hemoglobin je silnější báze než oxygenovaný Hb, a proto je se schopný vychytávat H+ kationty lépe.
V plicích se HCO3– mění za katalýzy CA zpět na CO2, který je vydýchán. H+ je do reakce dodán svým uvolnění z hemoglobinového pufru poté, co se vazbou O2 na hemoglobin afinita hemoglobinu k H+ snižuje. Sled reakcí je tedy v plicích opačný než v pracujících tkáních, zjednodušeně:
HCO3– + H+ → CO2 + H2O
Autoři podkapitoly: Petra Lavríková a Josef Fontana